Содержание
- 2. План: 1. Предмет і значення хімічної кінетики. 2. Вплив факторів на швидкість хімічної реакції. 3. Порядок
- 3. КІНЕТИКА - це розділ хімії, який вивчає швидкість хімічних реакцій і їх залежність від різних факторів.
- 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ - показує зміну концентрації реагуючих речовин (С) за одиницю часу (τ) в одиниці
- 5. На швидкість гомогенних (однорідних) хімічних реакцій впливають: природа реагуючих речовин; концентрація реагентів; температура; тиск; природа розчинника;
- 6. Для гетерогенних реакцій – найбільше значення має площа поверхні контакту ВІДЕО 1 Швидкість гетерогенної реакції прямо
- 7. 2. Вплив концентрацій речовин на швидкість хімічної реакції Щоб речовини прореагували, необхідно, щоб їх молекули зіткнулися
- 8. У середині XIX ст. (1865 р. - М. М. Бекетов, 1867 р. - К. Гульдберг, П.
- 9. k1 і k2 - це константи швидкості відповідно прямої і зворотної реакції (вони є сталими для
- 10. Вплив природи реагентів на швидкість хімічної реакції Константа швидкості реакції залежить в першу чергу від природи
- 11. Вплив температури на швидкість хімічної реакції збільшення хаотичості руху молекул приводить до збільшення кількості зіткнень Правило
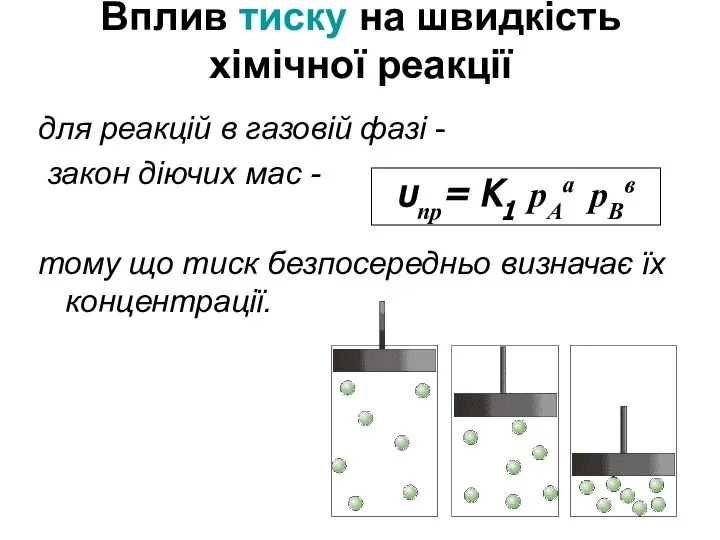
- 12. Вплив тиску на швидкість хімічної реакції для реакцій в газовій фазі - закон діючих мас -
- 13. Вплив розчинника на швидкість хімічної реакції розчинник має значення тільки для рідкофазних реакцій.
- 14. 3. Молекулярність і порядок реакції Мономолекулярна реакція - приймає участь тільки одна молекула (розклад) Бімолекулярна реакція
- 15. ПОРЯДОК РЕАКЦІЇ - число, що рівне сумі показників, що відповідають стехіометричним коефіцієнтам в рівнянні швидкості Нап,
- 17. Порядок реакції визначають: по графіку залежності концентрації реагенту від часу; 2) методом підстановки; 3) методом періоду
- 18. 4. Вплив каталізатора на швидкість хімічної реакції КАТАЛІЗАТОРИ –це речовини, які збільшують швидкість хімічної реакції. ІНГІБІТОРИ
- 19. У хімічну взаємодію вступають тільки молекули з достатньо високим рівнем кінетичної енергії, які називають активними або
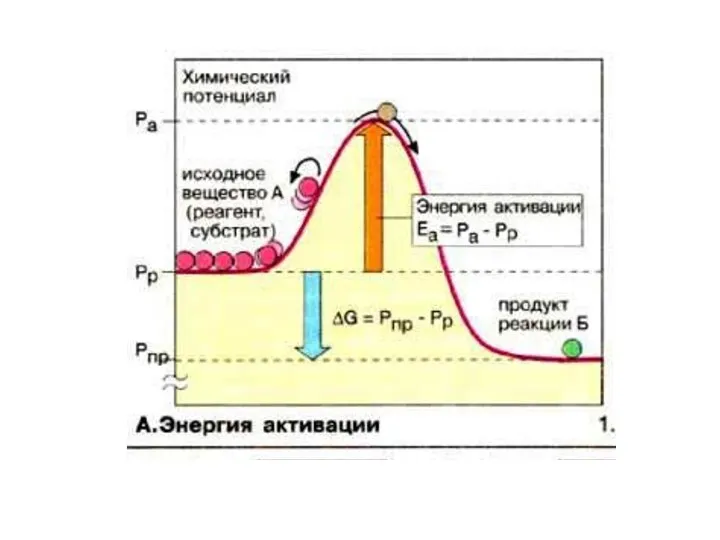
- 20. Якщо Еак Еак > 120 кДж/моль, то t > 250 ° C. ЕНЕРГІЯ АКТИВАЦІЇ (Еа) –
- 22. 5. Теорія “активних комплексів” Каталізаторами називають речовини, які допомагають знижувати енергію активації. А+В→АВ Е1 А+К→АК Е2
- 23. 6. Ферментативний каталіз ФЕРМЕ́НТИ або ензи́ми — органічні каталізатори білкової або РНК природи. Поділяються на: прості
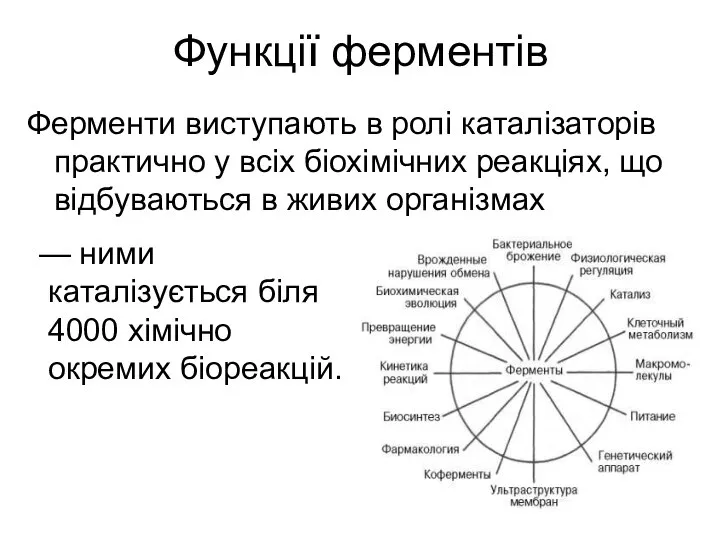
- 24. Функції ферментів Ферменти виступають в ролі каталізаторів практично у всіх біохімічних реакціях, що відбуваються в живих
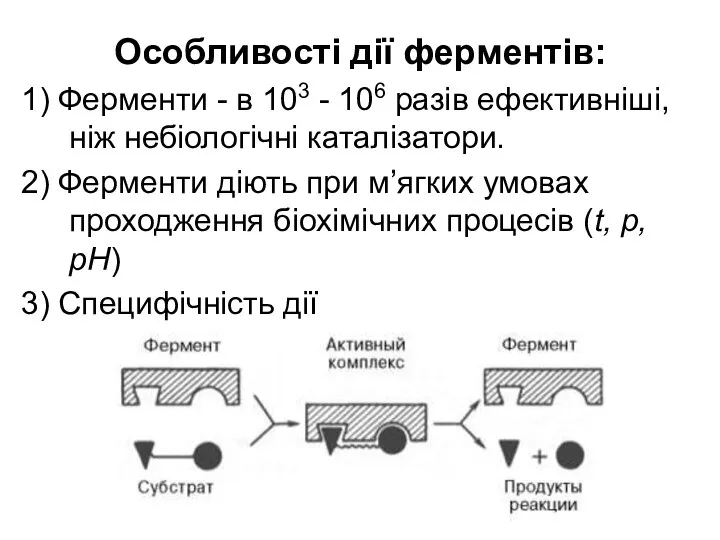
- 25. Особливості дії ферментів: 1) Ферменти - в 103 - 106 разів ефективніші, ніж небіологічні каталізатори. 2)
- 26. 4) Швидкість біохімічних реакцій залежать як від концентрації реагуючих речовин (субстрата - S) і від концентрації
- 27. Для дальшого протікання реакції: де Р - продукт реакції k1 - константа швидкості утворення комплексу; k2
- 28. Рівняння Міхаеліса-Ментен: k1 = [E]·[S] = k2·[ES] = (k2 + k3) · [ES] Константу К3 називають
- 29. Кm -знаходиться експериментально Де k2 – константа розпаду k3 – константа утворення
- 30. Рівняння Міхаеліса - Ментена має два граничних випадки : коли [S] коли [S] >> Km, то
- 32. Скачать презентацию






















![Рівняння Міхаеліса-Ментен: k1 = [E]·[S] = k2·[ES] = (k2 + k3)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395702/slide-27.jpg)

![Рівняння Міхаеліса - Ментена має два граничних випадки : коли [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395702/slide-29.jpg)
 Требования к осадителю
Требования к осадителю Круговорот химических веществ в природе Выполнила: Подсыпанина Наташа Ученица: 10 «А» класса Учитель: Макарова Е. И.
Круговорот химических веществ в природе Выполнила: Подсыпанина Наташа Ученица: 10 «А» класса Учитель: Макарова Е. И. Будем знакомы -
Будем знакомы - Радиационная стойкость материалов
Радиационная стойкость материалов Гравиметрический метод анализа
Гравиметрический метод анализа Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Самовосстанавливающиеся материалы
Самовосстанавливающиеся материалы Углеводы: моносахариды, олигосахариды и полисахариды
Углеводы: моносахариды, олигосахариды и полисахариды The ideal gas equation
The ideal gas equation Функции белков
Функции белков  Применение алканов Работа Гончаровой Натальи Ученицы 11 «А» класса Учитель: Попова И.В.
Применение алканов Работа Гончаровой Натальи Ученицы 11 «А» класса Учитель: Попова И.В. Общая и неорганическая химия
Общая и неорганическая химия Властивості газів
Властивості газів Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Щелочные металлы
Щелочные металлы Презентация по Химии "Йод" - скачать смотреть
Презентация по Химии "Йод" - скачать смотреть  Синтез ультрадисперсного мела для различных эффективных использований
Синтез ультрадисперсного мела для различных эффективных использований Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно
Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно Щелочные металлы
Щелочные металлы Особенности течения кариеса во временных зубах
Особенности течения кариеса во временных зубах The phenomenon of radioactivity. Radioisotopes. The nuclear reaction
The phenomenon of radioactivity. Radioisotopes. The nuclear reaction Небелковые азотистые компаненты крови
Небелковые азотистые компаненты крови Презентация по Химии "Молочная кислота" - скачать смотреть _
Презентация по Химии "Молочная кислота" - скачать смотреть _ Презентация Соединения химических элементов 8 класс.
Презентация Соединения химических элементов 8 класс.  Щелочноземельные металлы
Щелочноземельные металлы 6 КАЗ Изохинолин туынд
6 КАЗ Изохинолин туынд Солі амонію
Солі амонію