Содержание
- 2. При одинаковом количестве атомов углерода в молекулах углеводороды могут отличаться числом атомов водорода. Пример: -Одному и
- 3. Классификация углеводородов Классификацию углеводородов проводят по следующим структурным признакам, определяющим свойства этих соединений: 1) строение углеродной
- 4. Открытая (незамкнутая) цепь алифатических углеводородов может быть неразветвленной или разветвленной. Углеводороды с неразветвленной углерод- ной цепью
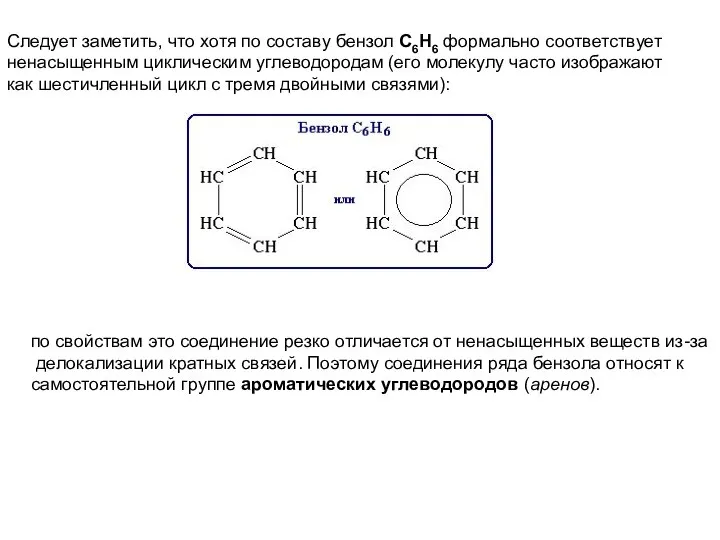
- 5. Следует заметить, что хотя по составу бензол С6Н6 формально соответствует ненасыщенным циклическим углеводородам (его молекулу часто
- 6. АЛКАНЫ (предельные углеводороды, парафины) Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между
- 7. Следовательно, состав алканов соответствует общей формуле CnH2n+2. Поэтому часто используется такое определение: Алканы — углеводороды, состав
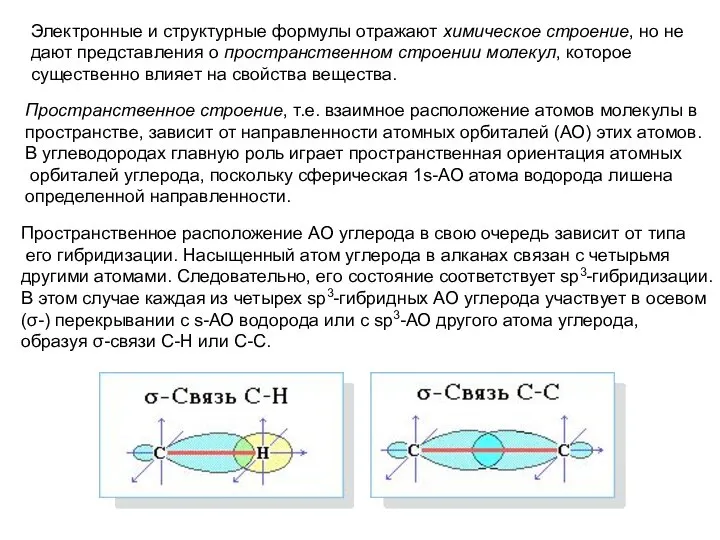
- 8. Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое
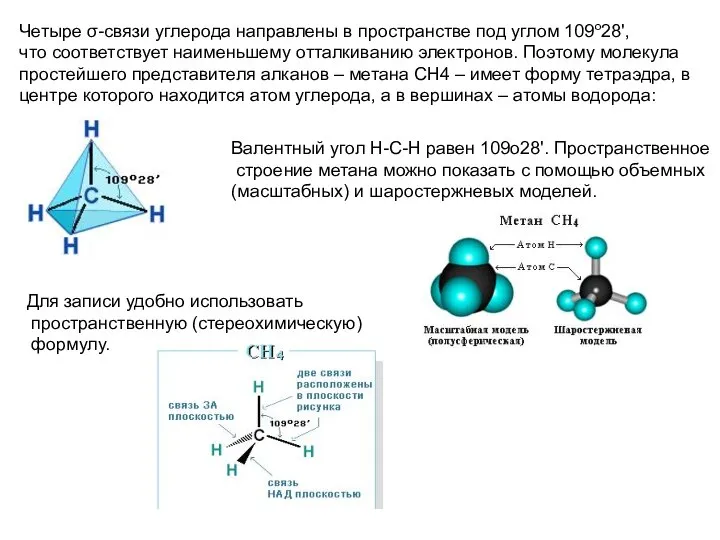
- 9. Четыре σ-связи углерода направлены в пространстве под углом 109о28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула
- 10. В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3-атома углерода образуют более сложную пространственную
- 11. Гомологический ряд алканов Алканы, имея общую формулу СnH2n+2, представляют собой ряд родственных соединений с однотипной структурой,
- 12. Гомологи отличаются молекулярной массой, и следовательно, физическими характеристиками. С увеличением числа углеродных атомов в молекуле алкана
- 13. Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве,
- 14. Номенклатура Номенклатура органических соединений – система правил, позволяющих дать однозначное название каждому индивидуальному веществу. В настоящее
- 15. Двухвалентный радикал получается, если удалить из молекулы 2 атома водорода. Например, из метана можно образовать двухвалентный
- 16. Радикалы подразделяются на первичные, вторичные и третичные в зависимости от того, у какого атома углерода (первичного,
- 17. Правила построения названий алканов по систематической международной номенклатуре ИЮПАК Для простейших алканов (С1-С4) приняты тpивиальные названия:
- 18. Порядок построения названия разветвленного алкана Выбрать в молекуле главную углеродную цепь. Во-первых, она должна быть самой
- 19. 3. Назвать все радикалы (заместители), указав впереди цифры, обозначающие их местоположение в главной цепи. Если есть
- 20. Химические свойства алканов Химические свойства любого соединения определяются его строением, т.е. природой входящих в его состав
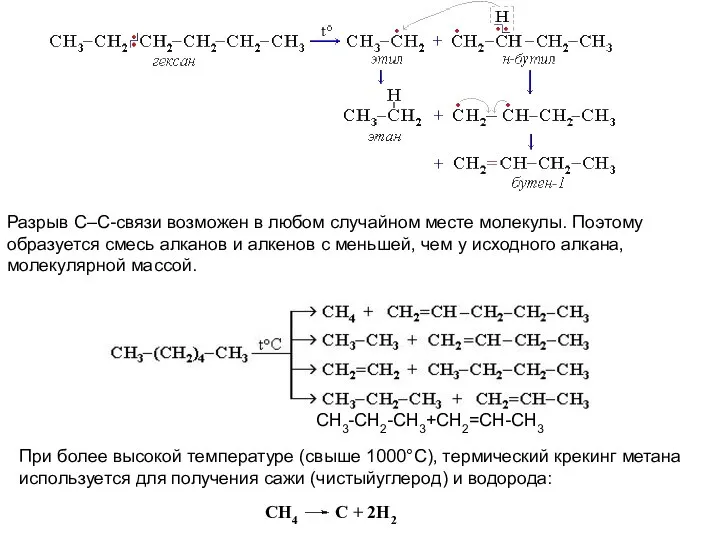
- 21. Крекинг алканов Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи
- 22. Разрыв С–С-связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей,
- 23. Изомеризация алканов Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы
- 26. Скачать презентацию



















 Количество вещества
Количество вещества Драгоценные камни
Драгоценные камни Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Классификация химических элементтов
Классификация химических элементтов Кристаллы и правильные многогранники. 11 класс
Кристаллы и правильные многогранники. 11 класс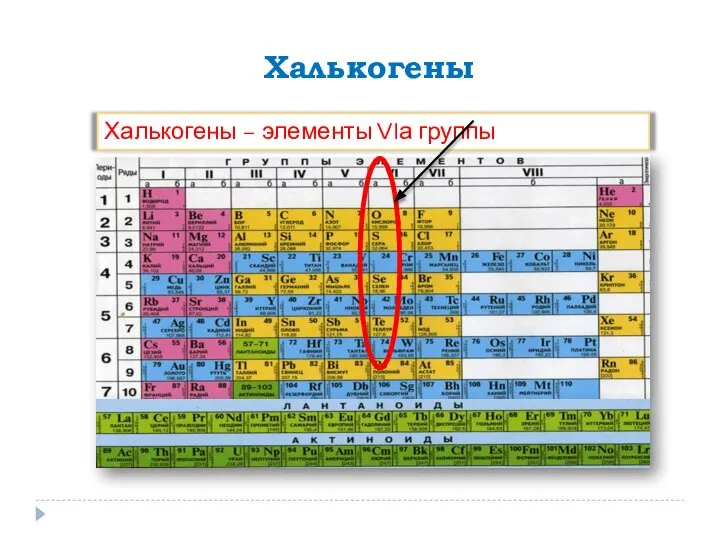 Кислород. Сера
Кислород. Сера Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна
Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна  Генетика клеточного цикла. Надклеточный контроль клеточного деления, роста и апоптоза. (Глава 5)
Генетика клеточного цикла. Надклеточный контроль клеточного деления, роста и апоптоза. (Глава 5) Амоніак
Амоніак  Atmospheric chemistry
Atmospheric chemistry Презентация по Химии "Презентация Металлы в организме человека" - скачать смотреть
Презентация по Химии "Презентация Металлы в организме человека" - скачать смотреть  ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнили: Патренкина Наталия, Иванова Кристина, ученицы 9«А» класса СОШ №6 Руководитель: Овсяникова Мар
ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнили: Патренкина Наталия, Иванова Кристина, ученицы 9«А» класса СОШ №6 Руководитель: Овсяникова Мар Дисциплина: Химия. Лекция 1. Растворы
Дисциплина: Химия. Лекция 1. Растворы Общие пути обмена аминокислот. (Лекция 11)
Общие пути обмена аминокислот. (Лекция 11) Коллоидные растворы
Коллоидные растворы Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Ионная химическая связь
Ионная химическая связь Углеводы: моносахариды, олиго- и полисахариды
Углеводы: моносахариды, олиго- и полисахариды Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2)
Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2) Металлы: общая характеристика
Металлы: общая характеристика Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Металлы и их активность
Металлы и их активность Химиялық элемент алюминий
Химиялық элемент алюминий Особенности химии, связанные с её физикализацией. Дифференциация и интеграция науки
Особенности химии, связанные с её физикализацией. Дифференциация и интеграция науки Ориентационная вытяжка полимеров
Ориентационная вытяжка полимеров Применение алканов Работа Гончаровой Натальи Ученицы 11 «А» класса Учитель: Попова И.В.
Применение алканов Работа Гончаровой Натальи Ученицы 11 «А» класса Учитель: Попова И.В. Углеводы. Моносахариды, олигосахариды (дисахариды)
Углеводы. Моносахариды, олигосахариды (дисахариды) Сера. Строение атома, аллотропия, свойства и применение серы
Сера. Строение атома, аллотропия, свойства и применение серы