Содержание
- 2. Одна легенда гласит: “Водяной царь сидит на троне, вокруг него танцуют русалки. Вдруг забрасываются сети, русалки
- 3. Тема урока: «Железо. Физические и химические свойства» Девиз урока: «Железо не только основа всего мира, самый
- 4. «Чтобы переваривать знания, надо поглощать их с аппетитом» Анатоль Франс Наши задачи: Продолжить учиться давать характеристику
- 5. Почему наш век называют железным?
- 6. Происхождение названия «Железо» произошло от санскритских слов «джальжа» - металл, руда или «жель» блистать, пылать «Ferrum»
- 7. Охарактеризуйте положение железа в периодической таблице химических элементов Д. И. Менделеева: Назовите координаты железа в ПСХЭ.
- 8. Положение в Периодической системе
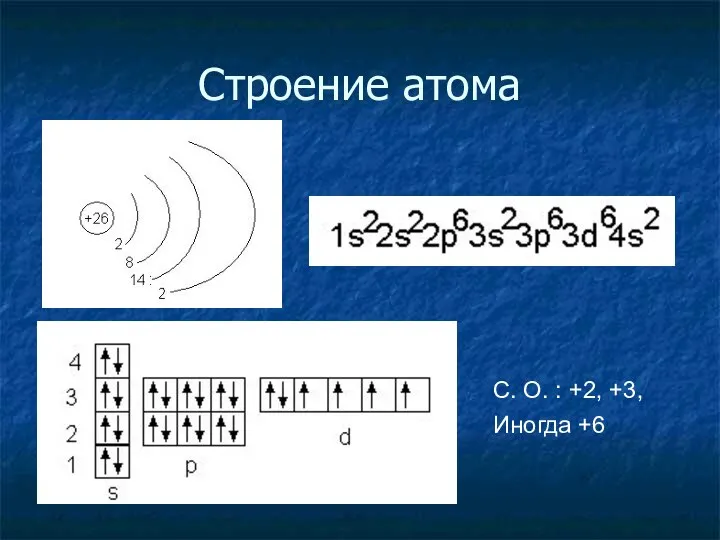
- 9. Строение атома С. О. : +2, +3, Иногда +6
- 10. Состав атома Протонов = 26 Электронов = 26 Нейтронов =56 – 26 =30
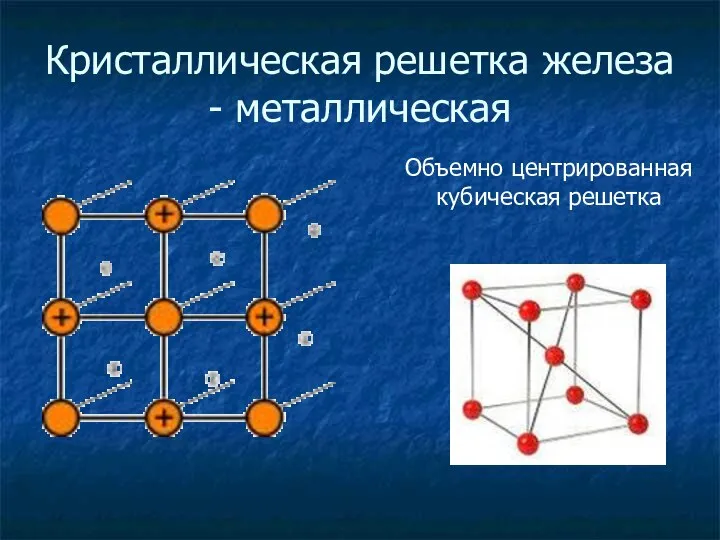
- 11. Кристаллическая решетка железа - металлическая Объемно центрированная кубическая решетка
- 12. Самостоятельная работа Определите степени окисления железа в соединениях: 1 ученик: FеСl3, FеSО4, Fе(ОН)2, 2 ученик: Fе(ОН)3,
- 13. Проверь себя! 1 ученик: FеСl3 (+3), FеSО4 (+2), Fе(ОН)2, (+2) 2 ученик: Fе(ОН)3 (+3), Fе2(SО4)3 (+3),
- 14. Простое вещество - железо
- 15. Пользуясь учебником Габриеляна О.С. Химия 9 класса опишите физические свойства железа по плану: Агрегатное состояние; Цвет;
- 16. Физические свойства железа Твердое Серо-серебристое Блестящее Хорошо проводит тепло и электрический ток Достаточно ковкое и пластичное
- 17. Нахождение в природе В каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа.
- 18. Нахождение в природе В земной коре железа – 5,1 %, (это 2 место среди металлов после
- 19. Химические свойства Вспомните общие свойства металлов и предположите, с какими веществами будет взаимодействовать железо? Восстановителем или
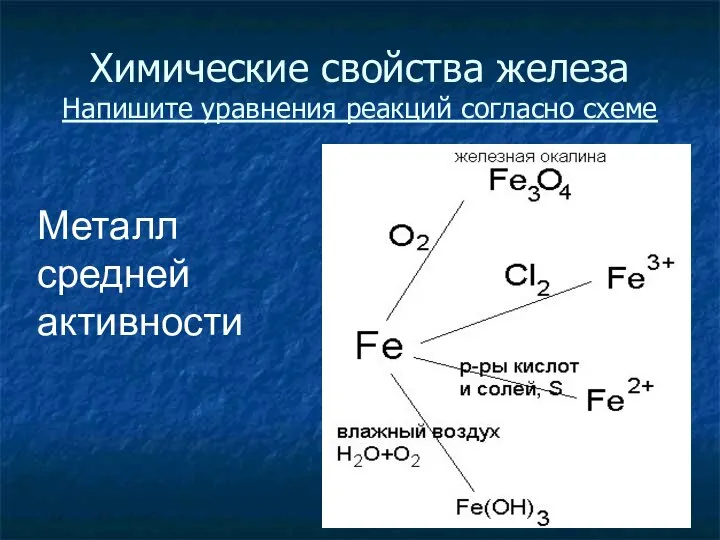
- 20. Химические свойства железа Напишите уравнения реакций согласно схеме Металл средней активности
- 21. Химические свойства железа 3Fe + 2O2 = Fe3O4 2Fe + 3Cl2 = 2FeCl3 Fe + 2HCl
- 22. Биологическая роль железа Какова биологическая роль железа и его соединений? В каких продуктах больше всего железа?
- 23. Биологическая роль железа и его соединений Железо – биогенный элемент. Входит в состав гемоглобина, миоглобина, ферментов
- 24. Основные источники железа Морская капуста - 16 мг Печень говяжья – 8,4 мг Фасоль – 6,4
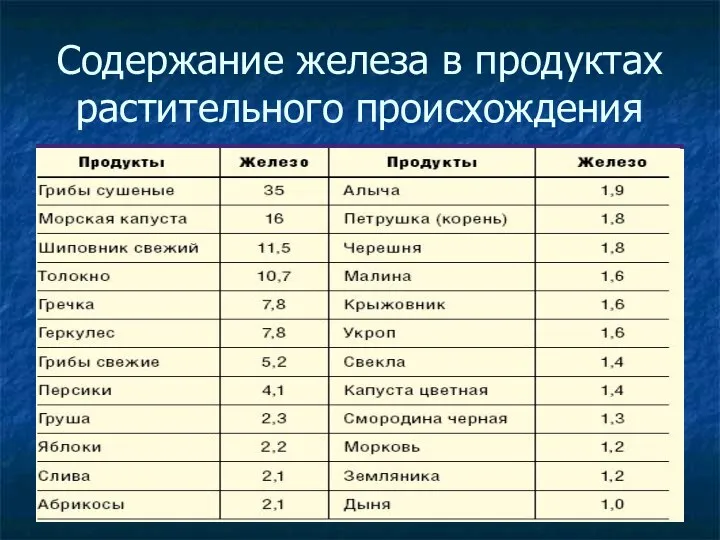
- 25. Содержание железа в продуктах растительного происхождения
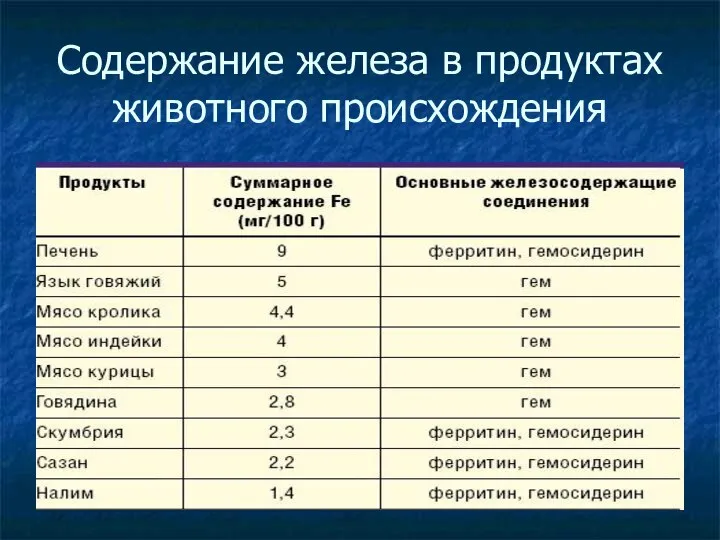
- 26. Содержание железа в продуктах животного происхождения
- 27. Порядок ли у вас с железом? Часто ли вы чувствуете усталость и подавленность? Произошли ли у
- 28. Промышленное значение железа Каково промышленное значение железа и где оно используется?
- 29. Железо в нашей жизни
- 30. Проверь себя! Выберите правильные ответы 1. Железо – это активный щелочной металл. 2. Железо легко куется.
- 31. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe ? FeCl2 ? Fe(OH)2 ?
- 32. Составьте электронный баланс: FeCl3 + H2S ? FeCl2 + S + HCl
- 33. Meталл я редкий в чистом виде, Пластичный и блестящий я, Богата рудами моими магнитогорская земля. Я
- 34. Рефлексия Задание: Написать вывод урока по образцу, закончив предложения: Сегодня я понял (а), что… Главным на
- 35. Домашнее задание §17,вопр 1,4,5* Сделать подборку текстовых материалов о соединениях железа из Интернет - источников.
- 37. Скачать презентацию





























 Основы органической химии
Основы органической химии Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Алкени
Алкени Fuziunea nucleara
Fuziunea nucleara Презентация по Химии "Вклад Д.И. Менделеева в развитие агрохимии. Значение его вклада в современном сельском хозяйстве" - скач
Презентация по Химии "Вклад Д.И. Менделеева в развитие агрохимии. Значение его вклада в современном сельском хозяйстве" - скач Поверхностные явления
Поверхностные явления Презентация по Химии "Амінокислоти" - скачать смотреть
Презентация по Химии "Амінокислоти" - скачать смотреть  Колообіг кальцію у природі Підготовила Йойна Юлія
Колообіг кальцію у природі Підготовила Йойна Юлія  Презентация по Химии "Химия табачного дыма" - скачать смотреть
Презентация по Химии "Химия табачного дыма" - скачать смотреть  Презентация “Исследование белков”.
Презентация “Исследование белков”.  Тема: Строение электронных оболочек атомов. Разработал: Учитель химии – биологии первой квалификационной категории Баженов Але
Тема: Строение электронных оболочек атомов. Разработал: Учитель химии – биологии первой квалификационной категории Баженов Але Organic Compounds
Organic Compounds Кремнийорганические модификаторы
Кремнийорганические модификаторы Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Строение атома Автор презентации: учитель МОУ СОШ пгт. Новокручининский Забайкальского края Журова О. В.
Строение атома Автор презентации: учитель МОУ СОШ пгт. Новокручининский Забайкальского края Журова О. В. Неметаллы IVA и IIIA групп Углерод, кремний , бор
Неметаллы IVA и IIIA групп Углерод, кремний , бор Циклоалканы и их применение
Циклоалканы и их применение Электронная формула атома магния
Электронная формула атома магния Неравновесные явления в растворах электролитов
Неравновесные явления в растворах электролитов ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ЯВИЩЕ АЛОТРОПІЇ, АЛОТРОПНІ ВИДОЗМІНИ ОКСИГЕНУ І
ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ЯВИЩЕ АЛОТРОПІЇ, АЛОТРОПНІ ВИДОЗМІНИ ОКСИГЕНУ І Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Производство серной кислоты
Производство серной кислоты Химический элемент. Неон
Химический элемент. Неон Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Александр Михайлович Бутлеров
Александр Михайлович Бутлеров Презентация по Химии "Основные классы неорганических соединений" - скачать смотреть
Презентация по Химии "Основные классы неорганических соединений" - скачать смотреть  Буферные растворы
Буферные растворы Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные
Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные