Содержание
- 2. План Дефицит А1АТ А1АТ Ген Белок Мутации Болезни Эмфизема Заболевания печени Диагностирование Лечение
- 3. Дефицит А1АТ Аутосомно-рецессивное заболевание, вызываемое нарушением синтеза альфа 1-антитрипсина Пониженная активность А1АТ в крови и в
- 4. Альфа-1-антитрипсин – белок, который вырабатывается печенью. Он помогает организму в инактивации ферментов, при этом основная его
- 5. Синтез альфа-1-антитрипсина регулируется двумя копиями гена протеазного ингибитора серпина-1. Это так называемый кодоминантный ген, то есть
- 6. А1АТ Представитель семейства серпинов Серпины являются ингибиторами сериновых протеаз Основная функция – ингибирование эластазы Эластаза -
- 7. А1АТ: ген SERPINA1 (или Pi) 14q32.1 12,2 kbp 7 экзонов (4 кодирующих, 3 некодирующих), 6 интронов
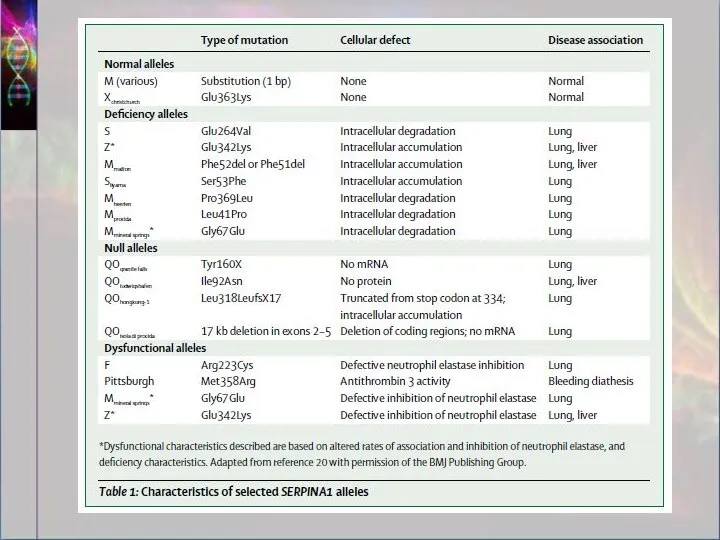
- 8. Количество производимого альфа-1-антитрипсина и его активность зависят от типа унаследованной мутации. Несмотря на то что ген
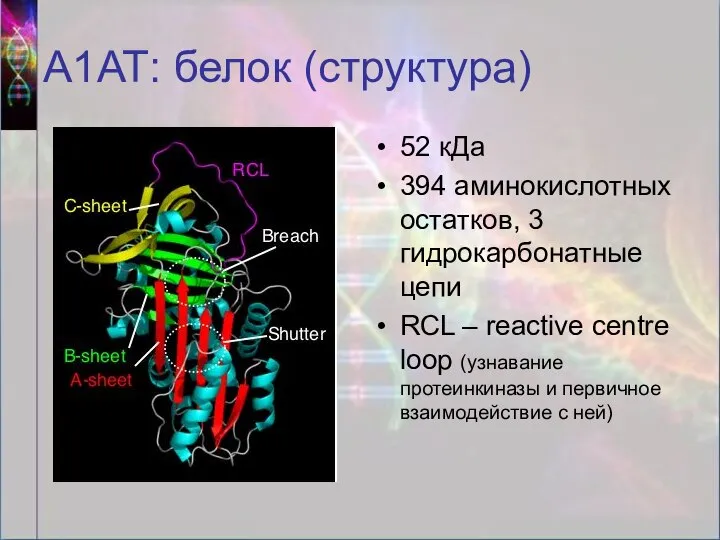
- 9. А1АТ: белок (структура) 52 кДа 394 аминокислотных остатков, 3 гидрокарбонатные цепи RCL – reactive centre loop
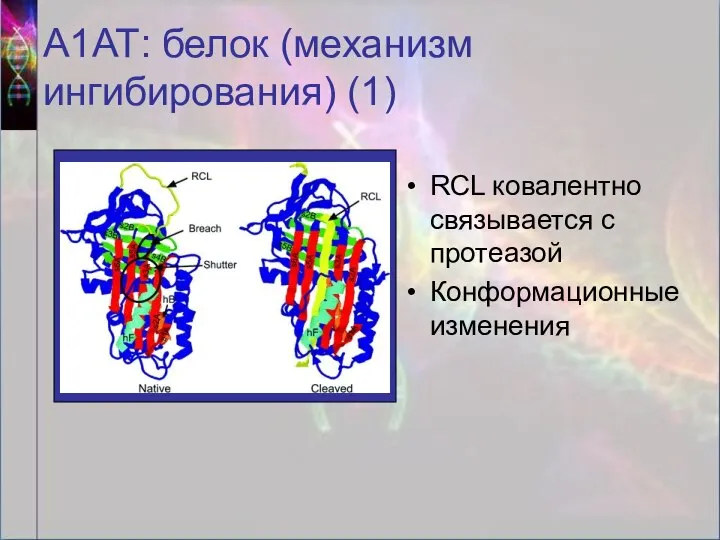
- 10. А1АТ: белок (механизм ингибирования) (1) RCL ковалентно связывается с протеазой Конформационные изменения
- 11. А1АТ: белок (механизм ингибирования) (2) Протеаза атакует RCL RCL встраивается в бета-лист А, образуя четвёртый бета-лист
- 12. А1АТ: мутации Приводят к неправильному фолдингу, полимеризации, связыванию двух А1АТ друг с другом Наиболее важные мутации
- 14. Подготовка пациента Не принимать пищу в течение 12 часов до сдачи крови. Исключить физическое и эмоциональное
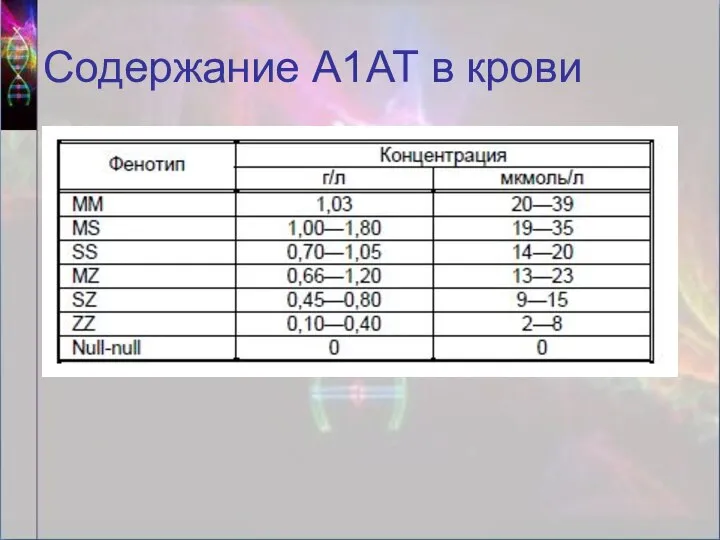
- 15. Содержание А1АТ в крови
- 16. Показания к опредению А1АТ: Если желтуха у новорождённого или малолетнего ребенка длится дольше 1-2 недель, при
- 17. Эмфизема Недостаток А1АТ (нормальное содержание – 1,5-3,5 г/л) => неконтролируемая активность протеаз, разрушение тканей лёгких (даже
- 18. Заболевания печени Z, Siiyama и Mmalton аллели (мутации в RCL) Полимеризация, внутриклеточное накопление (калнексин в ЭПР)
- 19. Диагностирование 95% случаев – не диагностировано Содержание А1АТ в сыворотке или плазме крови (не определить гетерозиготы)
- 20. Лечение Лечение симптомов Регулярное введение А1АТ (внутривенные инфузии из донорной плазмы крови, аэрозоли) Использование других ингибиторов
- 22. Скачать презентацию















 Атеросклероз. Этиология и патогенез
Атеросклероз. Этиология и патогенез Синдром бронхообструкции. Дифференцированное применение бронхолитиков
Синдром бронхообструкции. Дифференцированное применение бронхолитиков Иммунопрофилактика и иммунотерапия. Иммунобиологические препараты
Иммунопрофилактика и иммунотерапия. Иммунобиологические препараты Заразный узелковый дерматит
Заразный узелковый дерматит Туа пайда болған ұршық басының шығуы
Туа пайда болған ұршық басының шығуы Комплексное обследование при дислалии. Лекция 2
Комплексное обследование при дислалии. Лекция 2 Диффузные заболевания соединительной ткани. Дерматологические аспекты
Диффузные заболевания соединительной ткани. Дерматологические аспекты Некоторые вопросы диагностики анемий
Некоторые вопросы диагностики анемий Невропатология. Общие данные о патологии нервной системы
Невропатология. Общие данные о патологии нервной системы Система органов кроветворения и иммунной защиты
Система органов кроветворения и иммунной защиты Профилактика сердечно сосудистых заболеваний
Профилактика сердечно сосудистых заболеваний Основы психиатрии, часть 1 (для клинических психологов)
Основы психиатрии, часть 1 (для клинических психологов) Белая трость
Белая трость Гипоксия плода и акушерская тактика
Гипоксия плода и акушерская тактика Дезинфекционные технологии и оборудование для обеззараживания воздуха
Дезинфекционные технологии и оборудование для обеззараживания воздуха Информационные аспекты ТН ЛС
Информационные аспекты ТН ЛС Пластмассы, которые применяются в ортопедической стоматологии
Пластмассы, которые применяются в ортопедической стоматологии Малыш до года. Инструкция по применению
Малыш до года. Инструкция по применению Язвенная болезнь желудка и двенадцатиперстной кишки без кровотечения и прободения
Язвенная болезнь желудка и двенадцатиперстной кишки без кровотечения и прободения Антибиотики. Аминогликозиды для системного применения
Антибиотики. Аминогликозиды для системного применения Токсическое действие алкоголя на организм человека
Токсическое действие алкоголя на организм человека Артерии
Артерии Современные представления о функции репродуктивной системы (регуляция менструального цикла)
Современные представления о функции репродуктивной системы (регуляция менструального цикла) Гемолитикалық аурулар. Жаңа туған нәрестелердің гемолитикалық ауруы: ісіну түрі, анемиялық түрі, туа біткен сарғаю,
Гемолитикалық аурулар. Жаңа туған нәрестелердің гемолитикалық ауруы: ісіну түрі, анемиялық түрі, туа біткен сарғаю, Группа в социальной психологии
Группа в социальной психологии Счастливое детство без педикулёза
Счастливое детство без педикулёза Ортодонтиядағы инновациялық технология
Ортодонтиядағы инновациялық технология Предмет та завдання патофізіології. Методи патофізіологічних досліджень. Вчення про хворобу, етіологія і патогенез
Предмет та завдання патофізіології. Методи патофізіологічних досліджень. Вчення про хворобу, етіологія і патогенез