Содержание
- 2. ИЗМЕРЕНИЕ ПО КАЛИБРОВОЧНОЙ КРИВОЙ
- 3. Методы сравнения стандартного и опытного образца Анализируемая и стандартная проба обрабатываются в одинаковых условиях При больших
- 4. Методы определения без использования калибратора Фотометрические единицы (в случае отсутствия калибратора – средние молекулы, серомукоид) –
- 5. Методы определения без использования калибратора Определение концентрации по молярному показателю поглощения – применение закона Бургера С
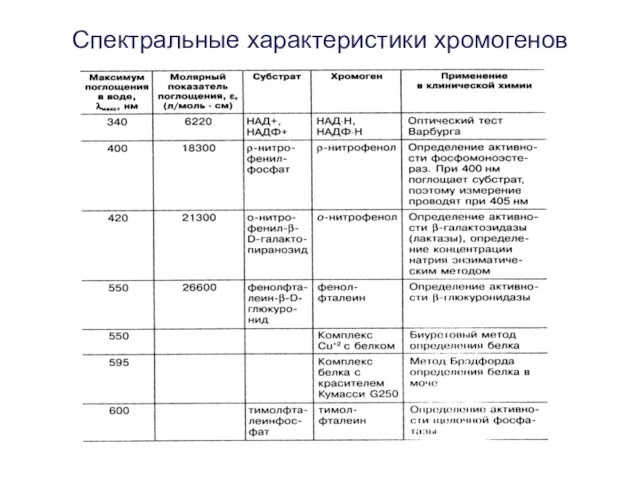
- 6. Спектральные характеристики хромогенов
- 7. Примеры: Определение концентрации НАДН на основе определения оптической плотности Молярный показатель НАДН при 340 нм 6,22х10
- 8. Измерение скорости изменения поглощения Фотометрические измерения проводят непосредственно при протекании реакции Потребление субстратов Повышение концентрации продуктов
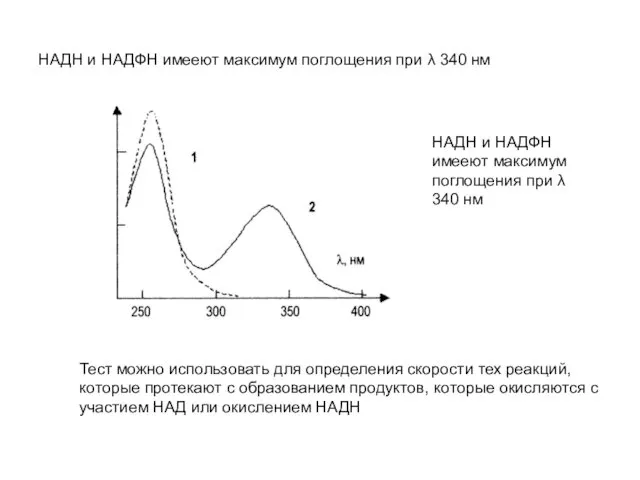
- 9. НАДН и НАДФН имееют максимум поглощения при λ 340 нм НАДН и НАДФН имееют максимум поглощения
- 10. Сопряженные реакции Аланин + α-КГ → Пируват + Глутамат Пируват + НАДН → Лактат + НАД
- 11. При кинетическом определении вычисляют изменение поглощения за 1 минуту F х А – активность фермента (МЕ,
- 12. Единицы активности ферментов Катал – количество фермента, превращающего 1 моль субстата за 1 сек МЕ -
- 13. Измерение по конечной точке Реакция развивается за некоторый период времени и достигает определенного конечного состояния (конечная
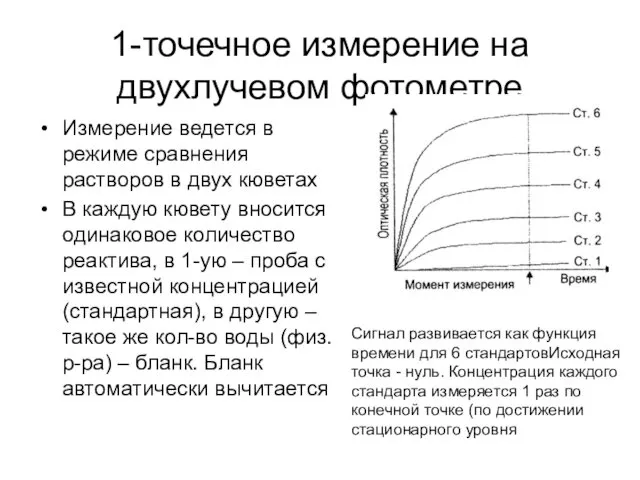
- 14. 1-точечное измерение на двухлучевом фотометре Измерение ведется в режиме сравнения растворов в двух кюветах В каждую
- 15. Измерение с бланком на однолучевом фотометре Для исключения систематического влияния (рабочий реактив, отражение от стенок кювет,
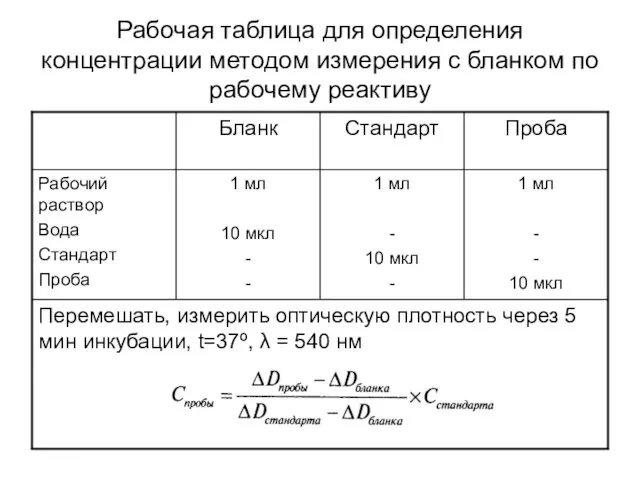
- 16. Рабочая таблица для определения концентрации методом измерения с бланком по рабочему реактиву
- 17. Измерение с прозоной Разновидность измерения с бланком Измерение в одной кювете, отсутствует кювета сравнения Проводят определение
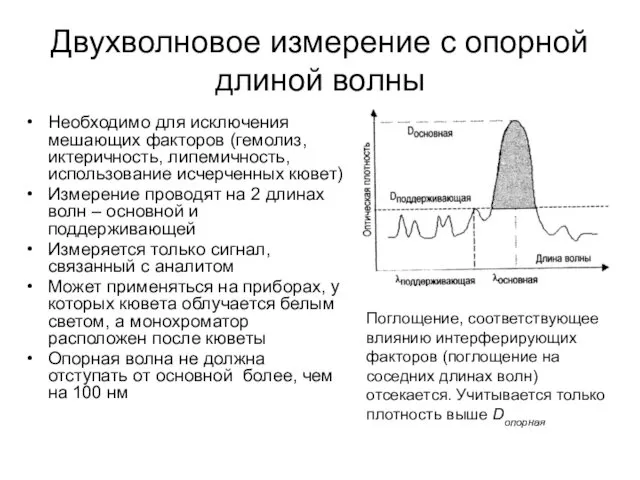
- 18. Двухволновое измерение с опорной длиной волны Необходимо для исключения мешающих факторов (гемолиз, иктеричность, липемичность, использование исчерченных
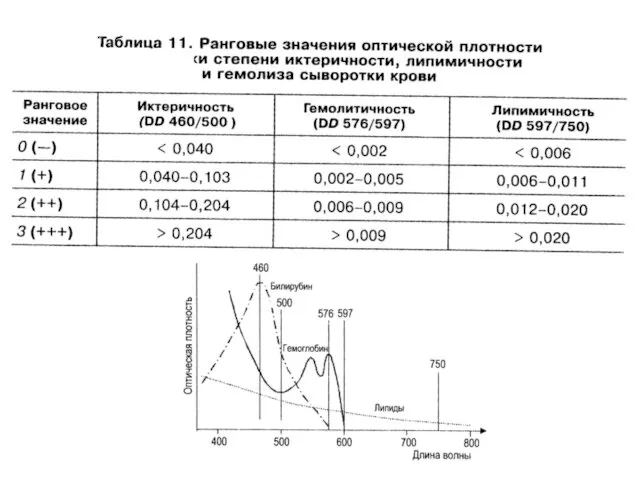
- 19. Принцип получения информации о степени иктеричности, липемичности и гемолиза сывортки 20 мкл сыворотки, смешать с 200
- 21. Кинетические измерения Определение меняющейся в ходе реакции оптической плотности Широко используется для определения активности ферментов Требует
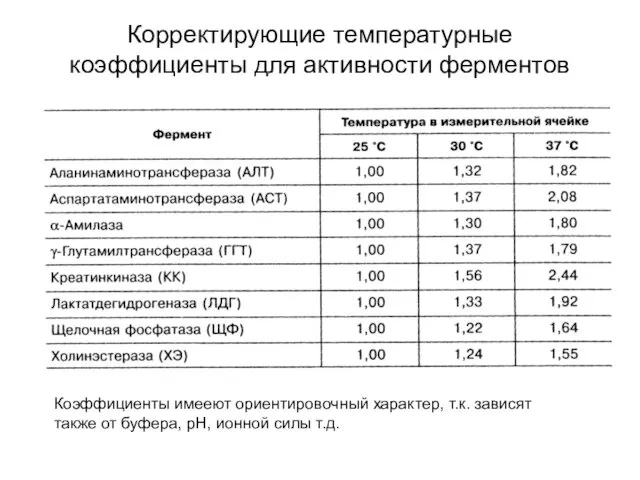
- 22. Корректирующие температурные коэффициенты для активности ферментов Коэффициенты имееют ориентировочный характер, т.к. зависят также от буфера, рН,
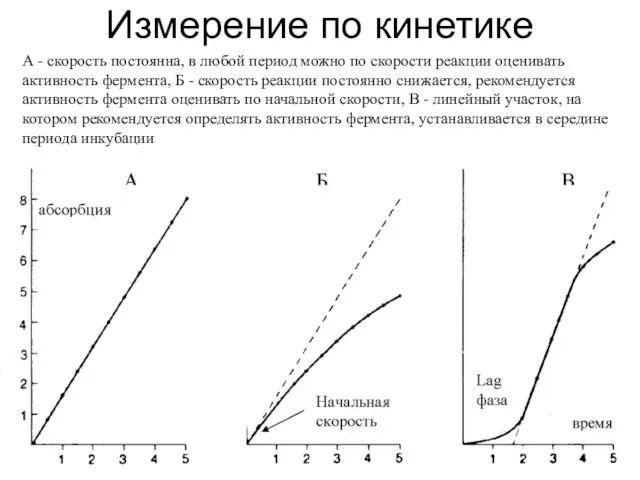
- 23. Измерение по кинетике А - скорость постоянна, в любой период можно по скорости реакции оценивать активность
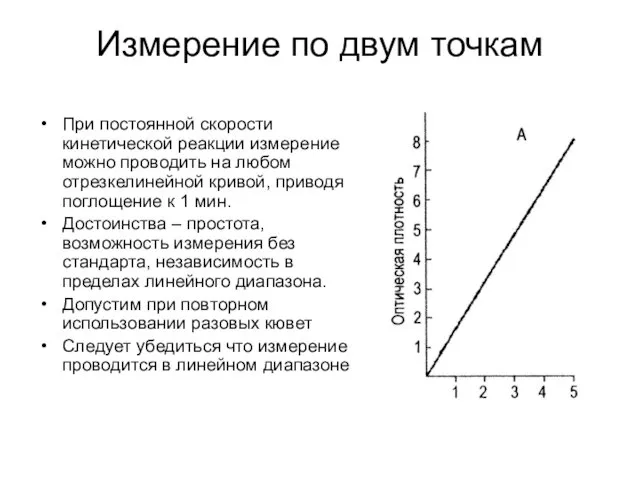
- 24. Измерение по двум точкам При постоянной скорости кинетической реакции измерение можно проводить на любом отрезкелинейной кривой,
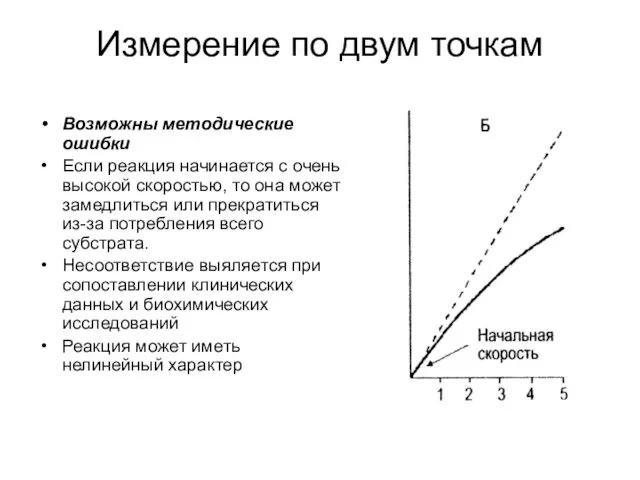
- 25. Измерение по двум точкам Возможны методические ошибки Если реакция начинается с очень высокой скоростью, то она
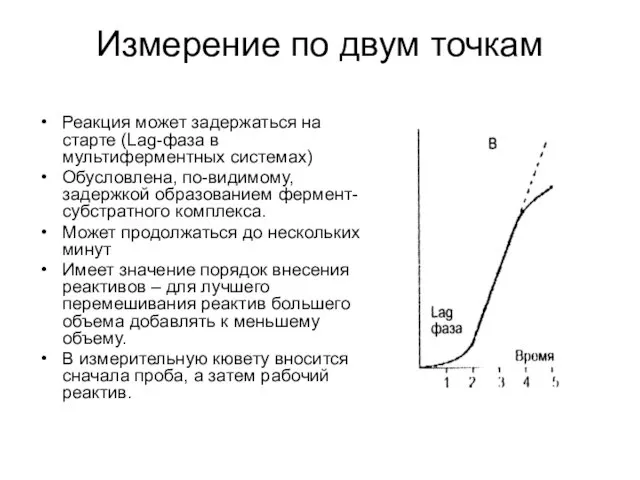
- 26. Измерение по двум точкам Реакция может задержаться на старте (Lag-фаза в мультиферментных системах) Обусловлена, по-видимому, задержкой
- 27. Многоточечное измерение Позволяет оценивать характер кинетики и выбирать для расчетов линейный участок Является наиболее точным методом
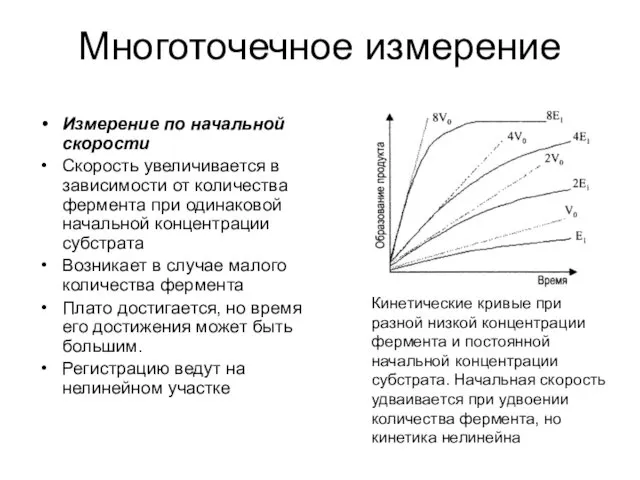
- 28. Многоточечное измерение Измерение по начальной скорости Скорость увеличивается в зависимости от количества фермента при одинаковой начальной
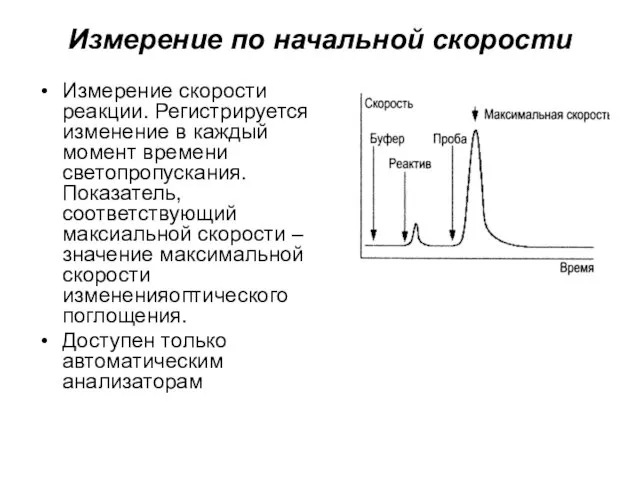
- 29. Измерение по начальной скорости Измерение скорости реакции. Регистрируется изменение в каждый момент времени светопропускания. Показатель, соответствующий
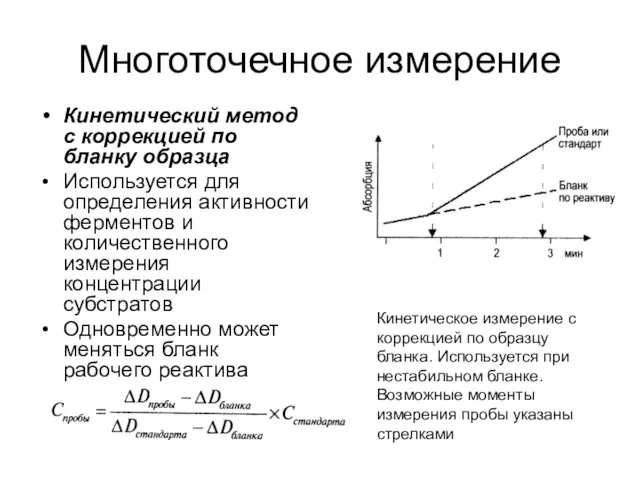
- 30. Многоточечное измерение Кинетический метод с коррекцией по бланку образца Используется для определения активности ферментов и количественного
- 31. Современные приборы способны определять и отслеживать избыток антигенов автоматически (регистрация ускорения реакции после добавления дополнительного количества
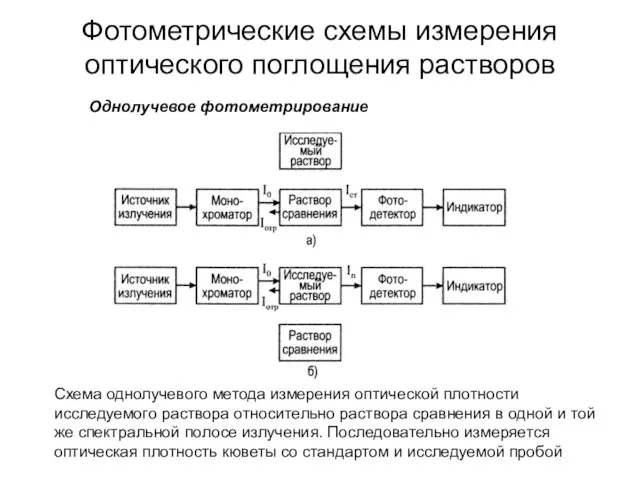
- 32. Фотометрические схемы измерения оптического поглощения растворов Схема однолучевого метода измерения оптической плотности исследуемого раствора относительно раствора
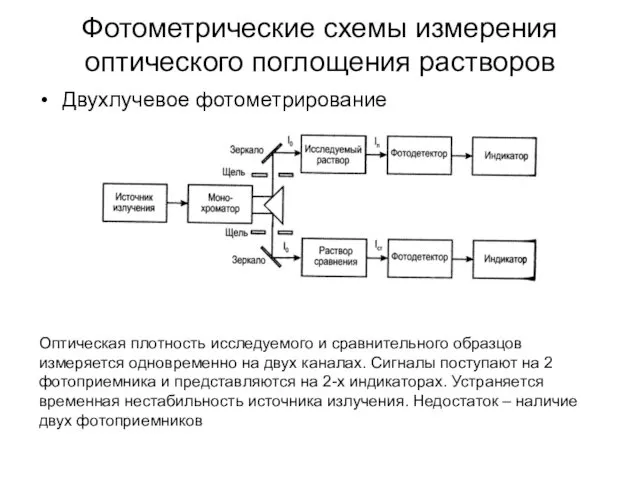
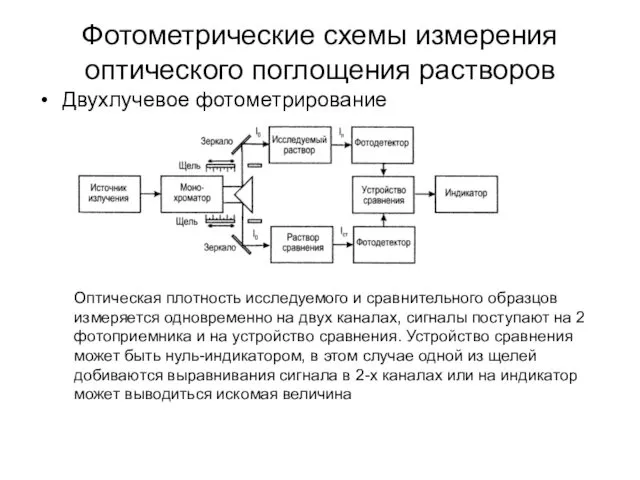
- 33. Фотометрические схемы измерения оптического поглощения растворов Двухлучевое фотометрирование Оптическая плотность исследуемого и сравнительного образцов измеряется одновременно
- 34. Фотометрические схемы измерения оптического поглощения растворов Двухлучевое фотометрирование Оптическая плотность исследуемого и сравнительного образцов измеряется одновременно
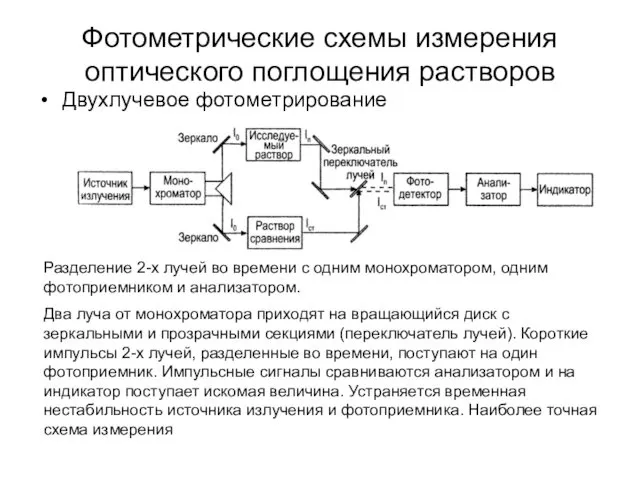
- 35. Двухлучевое фотометрирование Фотометрические схемы измерения оптического поглощения растворов Разделение 2-х лучей во времени с одним монохроматором,
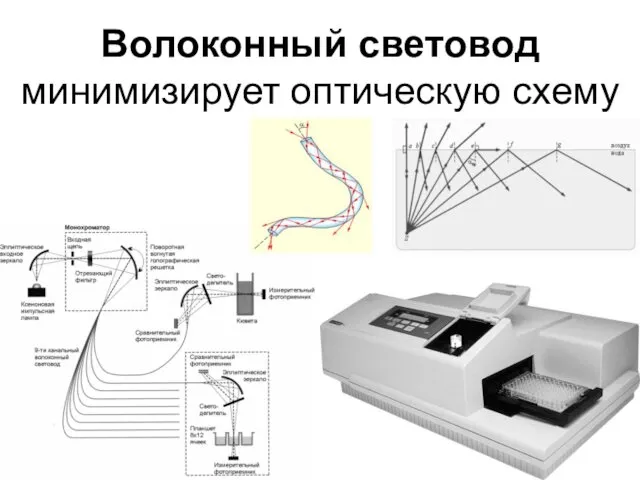
- 36. Волоконный световод минимизирует оптическую схему
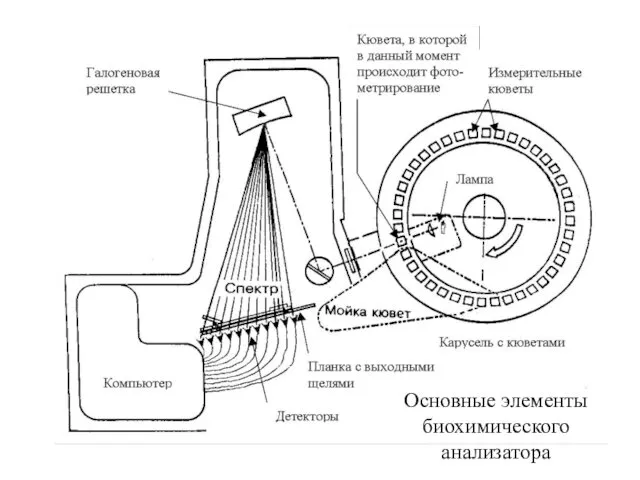
- 37. Основные элементы биохимического анализатора
- 38. Двухлучевое фотометрирование Фотометрические схемы измерения оптического поглощения растворов Разделение 2-х лучей во времени с одним монохроматором,
- 39. Рассеяние света Мутный раствор в кювете - поглощает свет (если окрашен) - частично проходит, не изменяя
- 40. Рассеяние света Трансмиссия и рассеивание зависят от - длины волны светового потока - частоты светового потока
- 41. Определение светорассеивания Зависит от длины волны (λ) Диаметра частиц, на которых происходит рассеивание Если размер частиц
- 42. Интенсивность потока, рассеиваемого небольшими частицами, подчиняется уравнению Релея Ir и I0 – интенсивность рассеянного и падающего
- 43. В основе рассеяния малых частиц лежит явление дифракции Рассеяние света каждой частицей не зависит друг от
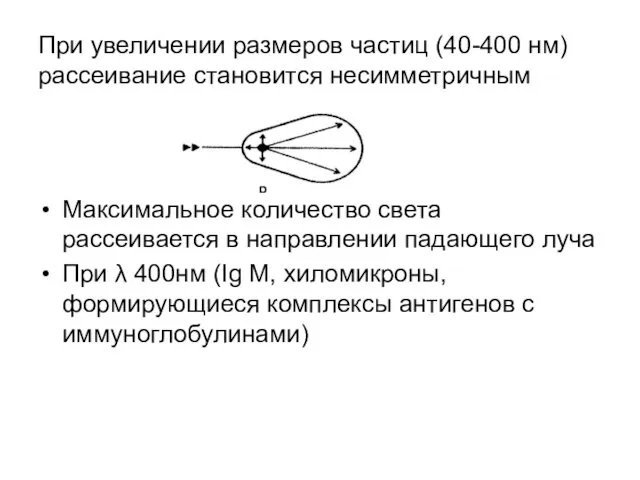
- 44. При увеличении размеров частиц (40-400 нм)рассеивание становится несимметричным Максимальное количество света рассеивается в направлении падающего луча
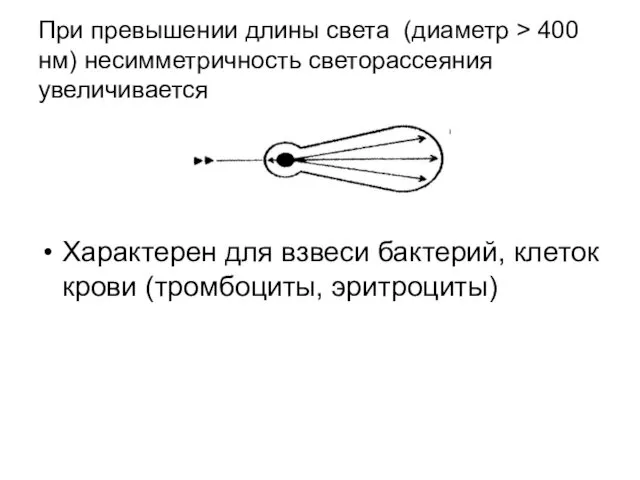
- 45. При превышении длины света (диаметр > 400 нм) несимметричность светорассеяния увеличивается Характерен для взвеси бактерий, клеток
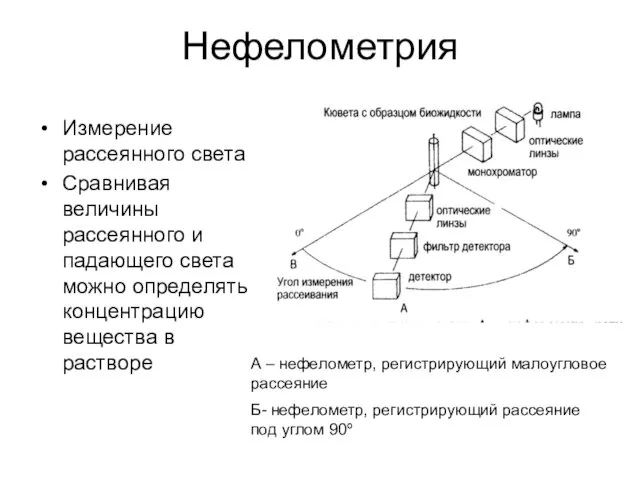
- 46. Нефелометрия Измерение рассеянного света Сравнивая величины рассеянного и падающего света можно определять концентрацию вещества в растворе
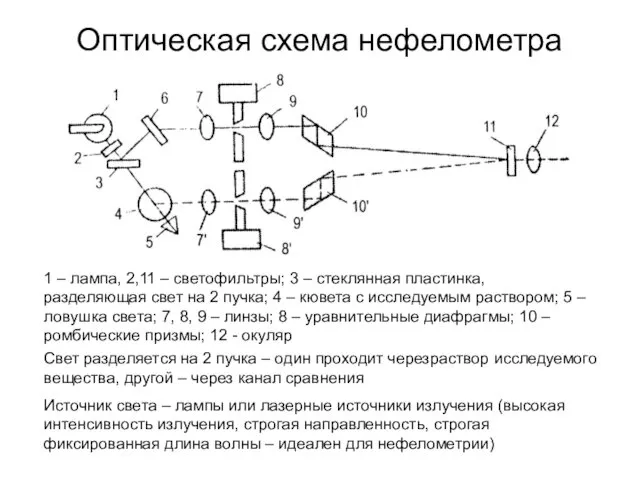
- 47. Оптическая схема нефелометра 1 – лампа, 2,11 – светофильтры; 3 – стеклянная пластинка, разделяющая свет на
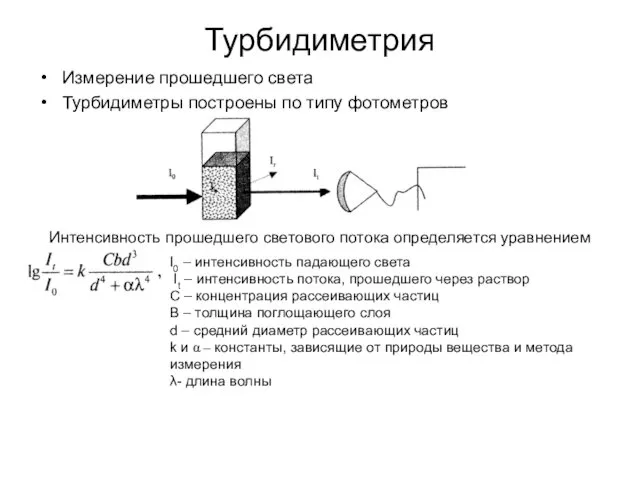
- 48. Турбидиметрия Измерение прошедшего света Турбидиметры построены по типу фотометров Интенсивность прошедшего светового потока определяется уравнением I0
- 49. Турбидиметрия Выражение, подобное закону Бугера-Ламберта для окрашенных растворов t – молярный коэффициент мутности раствора (турбидность) В
- 50. Турбидиметрия и нефелометрия Используются для определения индивидуальных белков Особенность – построение калибровочного графика с использованием не
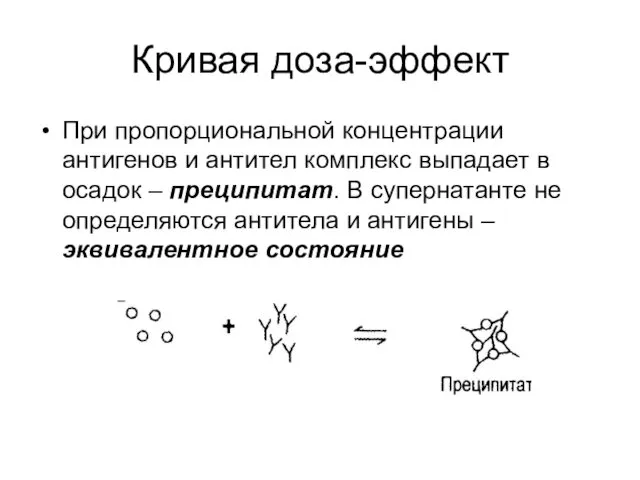
- 51. Кривая доза-эффект При взаимодействии антиген-антитело образуют агрегаты При постоянной концентрации антител при невысокой концентрации антигена все
- 52. При пропорциональной концентрации антигенов и антител комплекс выпадает в осадок – преципитат. В супернатанте не определяются
- 53. При увеличении концентрации антигенов количество антител недостаточно для полного связывания белка. Частицы иммунных комплексов становятся мелкими,
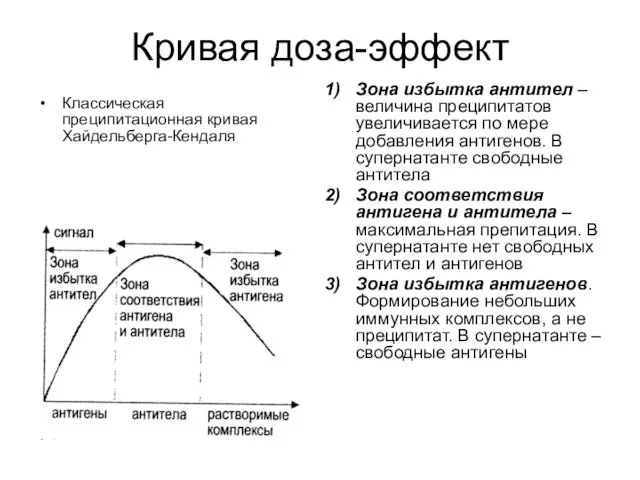
- 54. Кривая доза-эффект Классическая преципитационная кривая Хайдельберга-Кендаля Зона избытка антител – величина преципитатов увеличивается по мере добавления
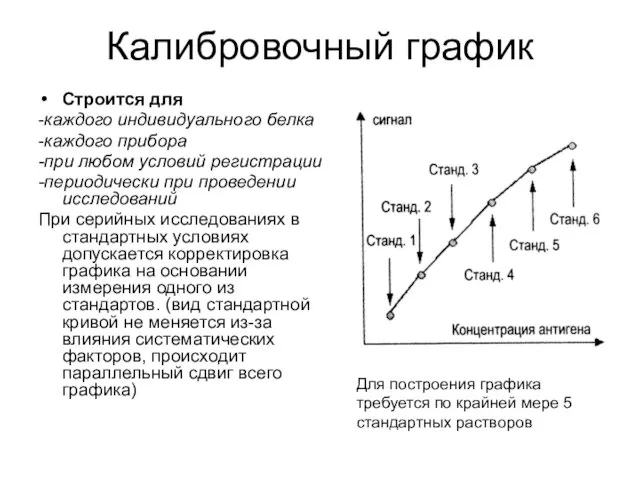
- 55. Калибровочный график Строится для -каждого индивидуального белка -каждого прибора -при любом условий регистрации -периодически при проведении
- 56. 1- если после добавления антигена реакция ускоряется, имеет место избыток антител (измерение проводится правильно) Состав реакционной
- 57. Современные приборы способны определять и отслеживать избыток антигенов автоматически (регистрация ускорения реакции после добавления дополнительного количества
- 58. Спасибо за внимание
- 59. КЛИНИЧЕСКИЙ СПЕКТРОФОТОМЕТР
- 60. Спектрофотометр без монохроматора
- 61. Кормей-мульти – программируемый фотометр с проточной кюветой
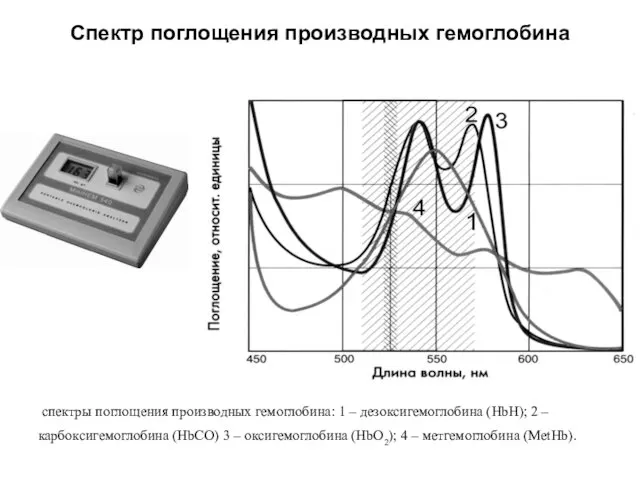
- 63. Спектр поглощения производных гемоглобина спектры поглощения производных гемоглобина: 1 – дезоксигемоглобина (HbH); 2 – карбоксигемоглобина (HbCO)
- 65. Скачать презентацию
































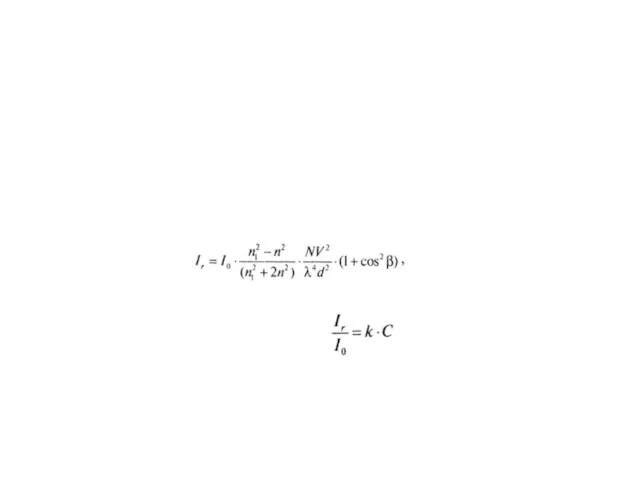
 Воспаление. Противовоспалительные средства
Воспаление. Противовоспалительные средства Дифференциальная диагностика аутоиммунных эндокринных заболеваний у детей
Дифференциальная диагностика аутоиммунных эндокринных заболеваний у детей Профессионализм как нравственная характеристика личности
Профессионализм как нравственная характеристика личности Печень. Поджелудочная железа. Гистология
Печень. Поджелудочная железа. Гистология Клонирование: за и против
Клонирование: за и против Смайлики. Личное понятие,
Смайлики. Личное понятие, Дети с ДЦП в инклюзивном образовании
Дети с ДЦП в инклюзивном образовании Агрессивные дети
Агрессивные дети Влияние неинвазивной стимуляции блуждающего нерва на частоте атаки с течением времени
Влияние неинвазивной стимуляции блуждающего нерва на частоте атаки с течением времени Профилактика бөлімінде жұмыс істеу скринингтік бағдарламалардың өткізу және ұйымдастыру
Профилактика бөлімінде жұмыс істеу скринингтік бағдарламалардың өткізу және ұйымдастыру Стомафил
Стомафил Cүйек-буын туберкулезі
Cүйек-буын туберкулезі Презентация Microsoft PowerPoint.pptx [Автосохраненный]
Презентация Microsoft PowerPoint.pptx [Автосохраненный] Инфаркт миокарда, патанатомия, осложнения, причины смерти. Взаимоотношение атеросклероза и ИБС
Инфаркт миокарда, патанатомия, осложнения, причины смерти. Взаимоотношение атеросклероза и ИБС Основы иммунотерапии
Основы иммунотерапии Лечебно-реабилитационный центр
Лечебно-реабилитационный центр Технологии, используемые в современной логопедической практике при нарушении тонуса мышц артикуляционного аппарата
Технологии, используемые в современной логопедической практике при нарушении тонуса мышц артикуляционного аппарата Балалардағы холецистит
Балалардағы холецистит Тромбоэмболия легочной артерии
Тромбоэмболия легочной артерии ОТМС Т-11 KZ
ОТМС Т-11 KZ Инфекциялық эндокардит
Инфекциялық эндокардит БПЭ прямой кишки. Эволюция метода
БПЭ прямой кишки. Эволюция метода Рисуночный тест Гилфорда «Социальный интеллект»
Рисуночный тест Гилфорда «Социальный интеллект» Анализ рынка медицинских услуг
Анализ рынка медицинских услуг Высшие мозговые функции и их расстройства
Высшие мозговые функции и их расстройства Острая вирусная ифекция - полиомиелит
Острая вирусная ифекция - полиомиелит Общий клинический анализ крови. Занятие 2
Общий клинический анализ крови. Занятие 2 Мониторинг врожденных пороков развития
Мониторинг врожденных пороков развития