Содержание
- 2. Молекулярно-генетическая диагностика Основные стадии молекулярно-генетического анализа: Выделение ДНК или РНК из клинического материала Амплификация анализируемых участков
- 3. Из какого материала приходится выделять ДНК и РНК при проведении биомедицинских исследований? Клеточные «суспензии» Ликвор, плазма
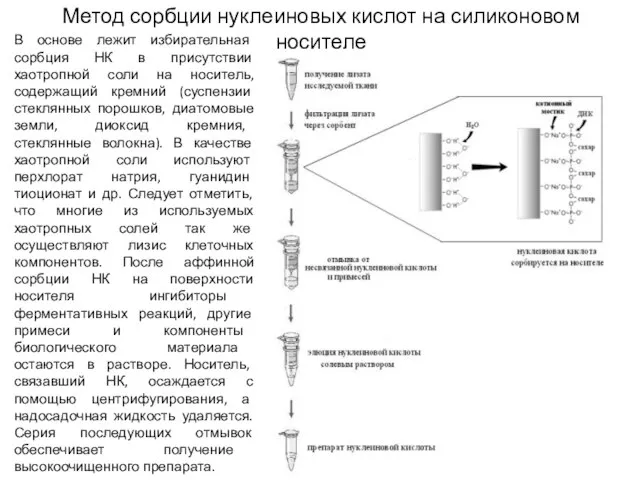
- 4. Метод сорбции нуклеиновых кислот на силиконовом носителе В основе лежит избирательная сорбция НК в присутствии хаотропной
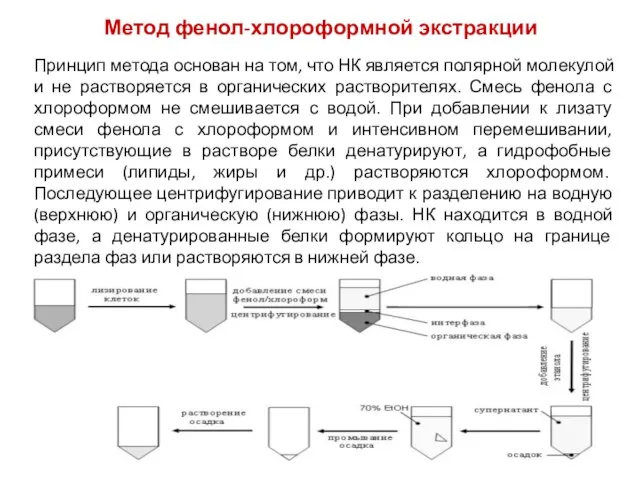
- 5. Метод фенол-хлороформной экстракции Принцип метода основан на том, что НК является полярной молекулой и не растворяется
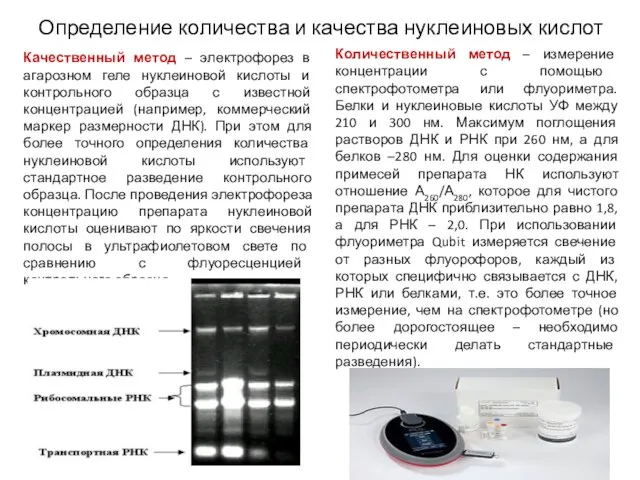
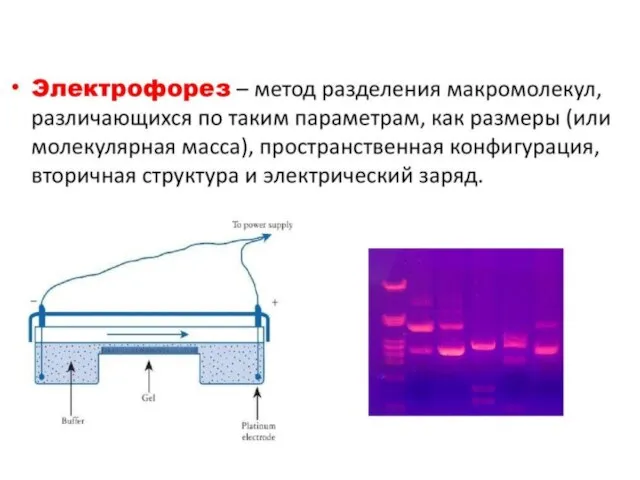
- 6. Определение количества и качества нуклеиновых кислот Качественный метод – электрофорез в агарозном геле нуклеиновой кислоты и
- 7. ПЦР – репликация ДНК in vitro В 1993 г. Kary B. Mullis стал лауреатом Нобелевской премии
- 8. Метод ПЦР – краткое напоминание
- 9. Компоненты ПЦР Буфер (Tris-HCl, pH 8.0-8.8, KCl) MgCl2 (1-3 mM) Праймеры (0.4 мкМоль каждого) dNTP (40-200
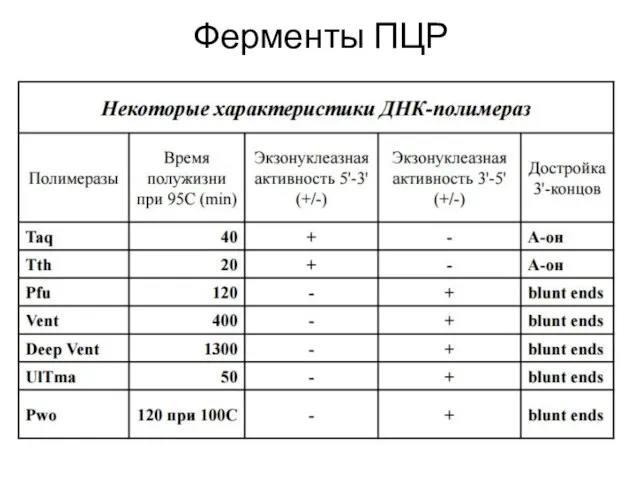
- 10. Ферменты ПЦР
- 11. Праймеры для ПЦР
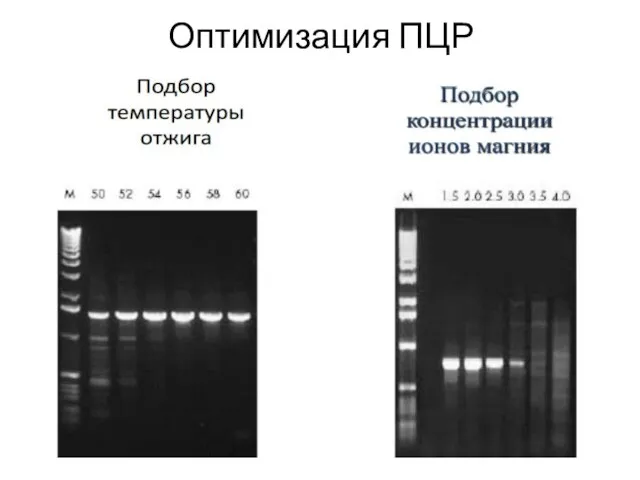
- 13. Оптимизация ПЦР
- 14. Оптимизация ПЦР
- 15. Вещества, улучшающие специфичность и/или выход ПЦР
- 16. Другие вещества, влияющие на ПЦР
- 17. Влияние красителей на на ПЦР
- 18. ПЦР: правила хорошего тона
- 19. Программируемые термоциклеры Что важно учитывать при выборе: Формат (стандартные 0,2 мл, или 0,1 мл, или 0,5
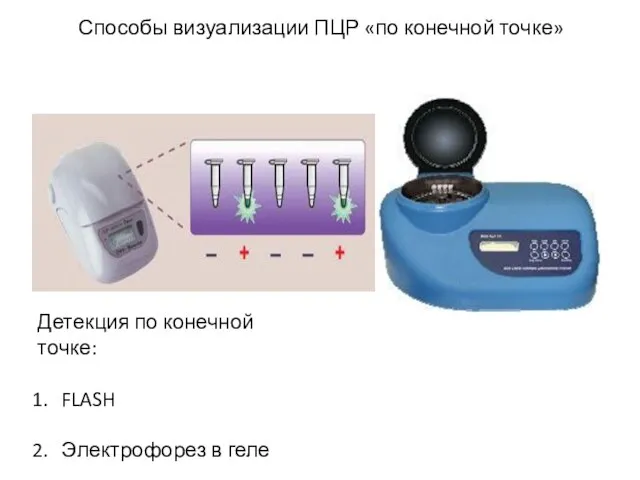
- 20. Способы визуализации ПЦР «по конечной точке» Детекция по конечной точке: FLASH Электрофорез в геле
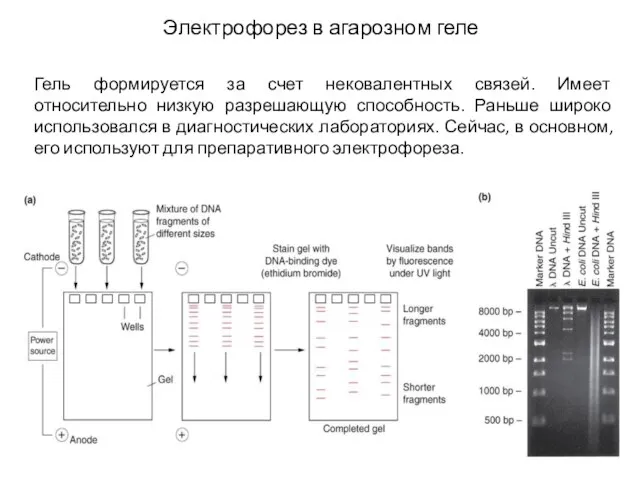
- 21. Электрофорез в агарозном геле Гель формируется за счет нековалентных связей. Имеет относительно низкую разрешающую способность. Раньше
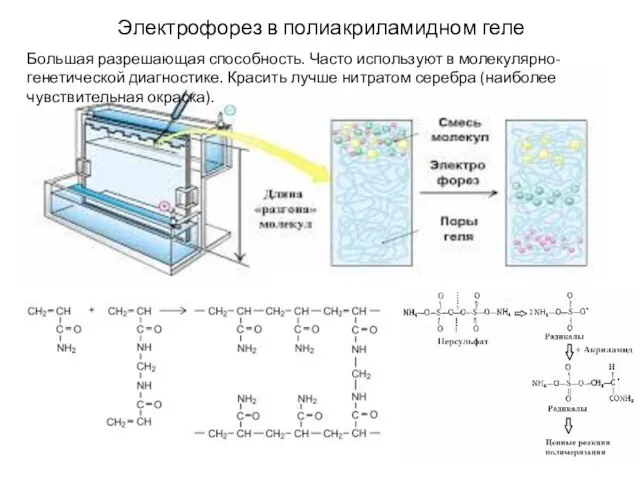
- 23. Электрофорез в полиакриламидном геле Большая разрешающая способность. Часто используют в молекулярно-генетической диагностике. Красить лучше нитратом серебра
- 24. Гетеродуплексный анализ Метод основан на том, что при ренатурации смеси нормальных и мутантных аллелей наряду с
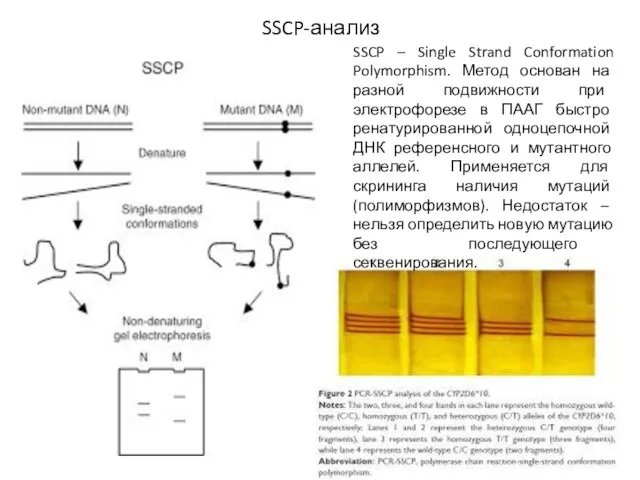
- 25. SSCP-анализ SSCP – Single Strand Conformation Polymorphism. Метод основан на разной подвижности при электрофорезе в ПААГ
- 26. Мультиплексная ПЦР При увеличении количества локусов в мультиплексной ПЦР, практически, экспоненциально растут затраты времени на отработку
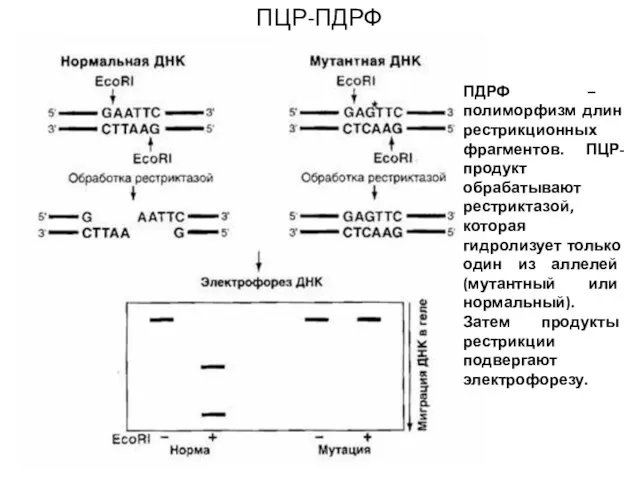
- 27. ПЦР-ПДРФ ПДРФ – полиморфизм длин рестрикционных фрагментов. ПЦР-продукт обрабатывают рестриктазой, которая гидролизует только один из аллелей
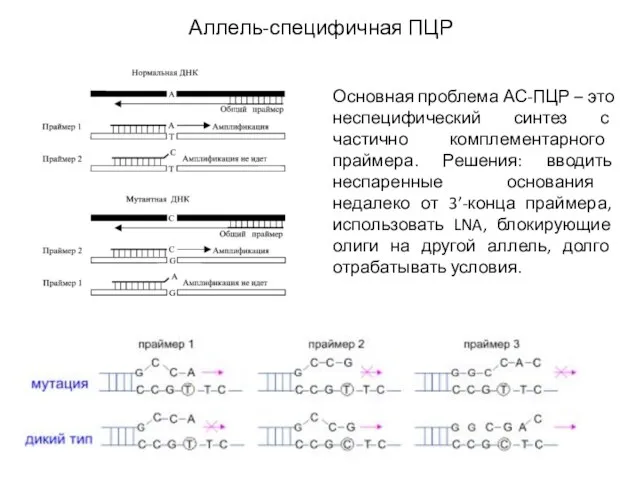
- 28. Аллель-специфичная ПЦР Основная проблема АС-ПЦР – это неспецифический синтез с частично комплементарного праймера. Решения: вводить неспаренные
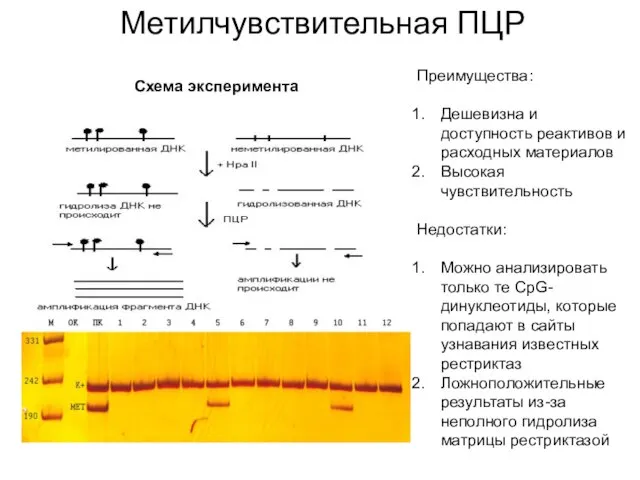
- 29. Метилчувствительная ПЦР Схема эксперимента Преимущества: Дешевизна и доступность реактивов и расходных материалов Высокая чувствительность Недостатки: Можно
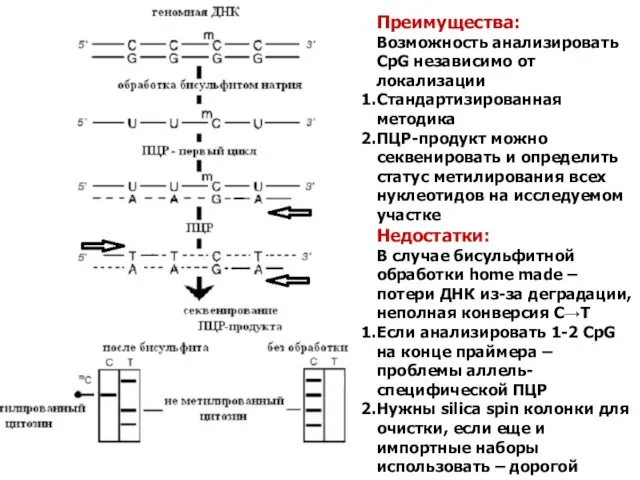
- 30. Преимущества: Возможность анализировать CpG независимо от локализации Стандартизированная методика ПЦР-продукт можно секвенировать и определить статус метилирования
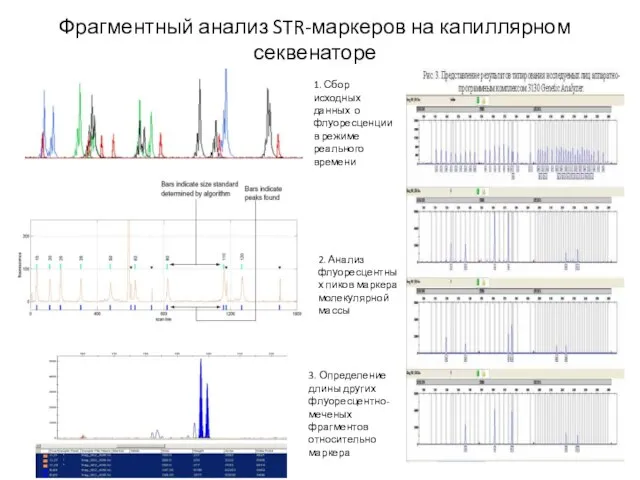
- 31. Фрагментный анализ STR-маркеров на капиллярном секвенаторе 1. Сбор исходных данных о флуоресценции в режиме реального времени
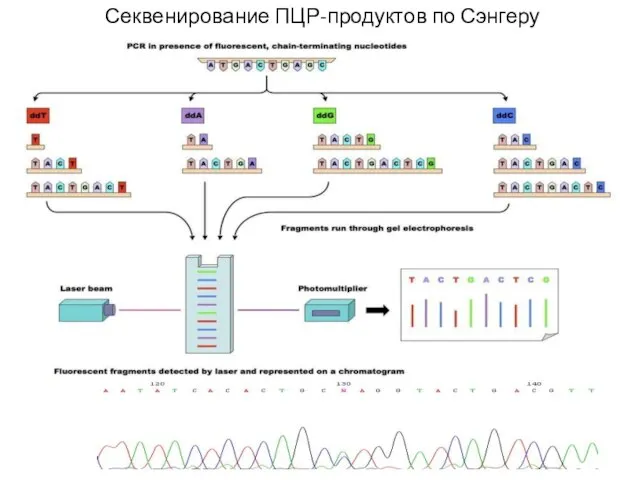
- 32. Секвенирование ПЦР-продуктов по Сэнгеру
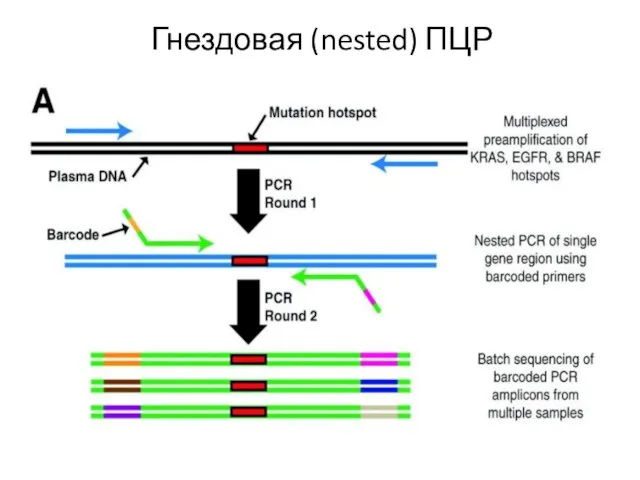
- 33. Гнездовая (nested) ПЦР
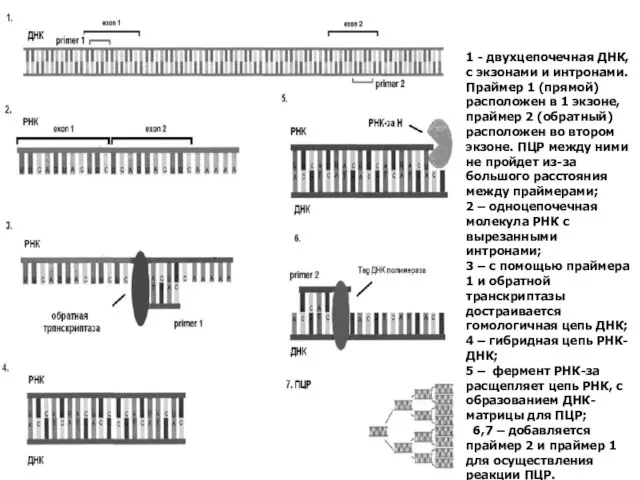
- 34. 1 - двухцепочечная ДНК, с экзонами и интронами. Праймер 1 (прямой) расположен в 1 экзоне, праймер
- 35. Hot-Start ПЦР
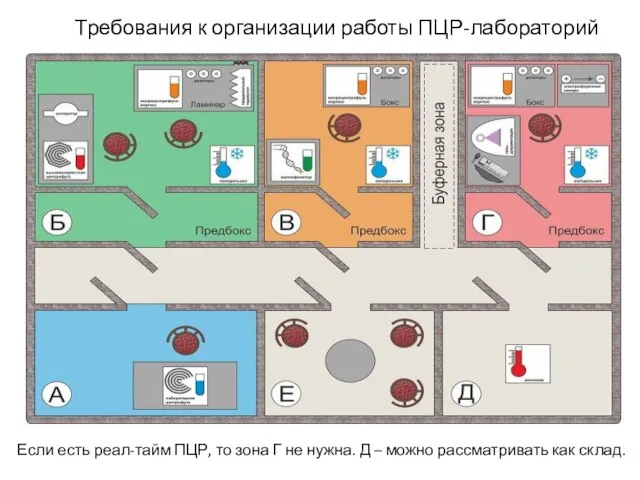
- 36. Требования к организации работы ПЦР-лабораторий Если есть реал-тайм ПЦР, то зона Г не нужна. Д –
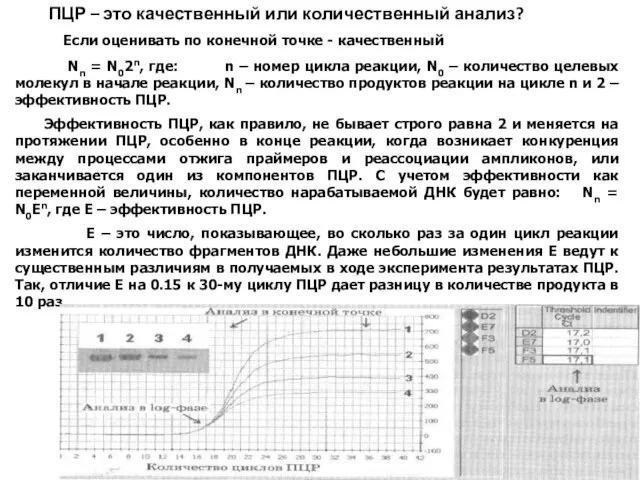
- 37. ПЦР – это качественный или количественный анализ? Если оценивать по конечной точке - качественный Nn =
- 38. ПЦР – это качественный или количественный анализ? (продолжение) Если измерять концентрации продуктов в log-фазе - количественный
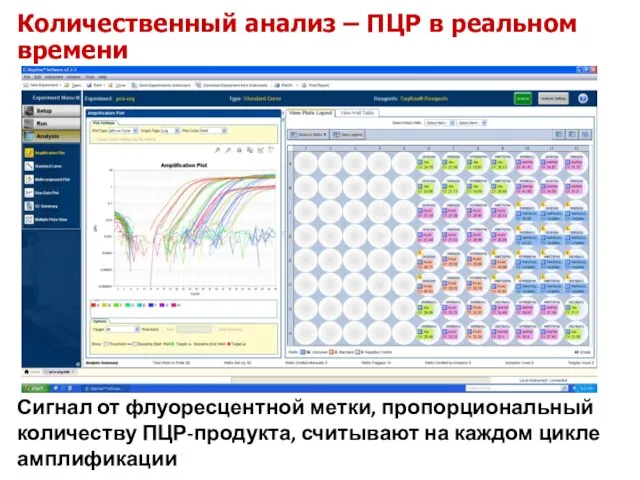
- 39. Количественный анализ – ПЦР в реальном времени Сигнал от флуоресцентной метки, пропорциональный количеству ПЦР-продукта, считывают на
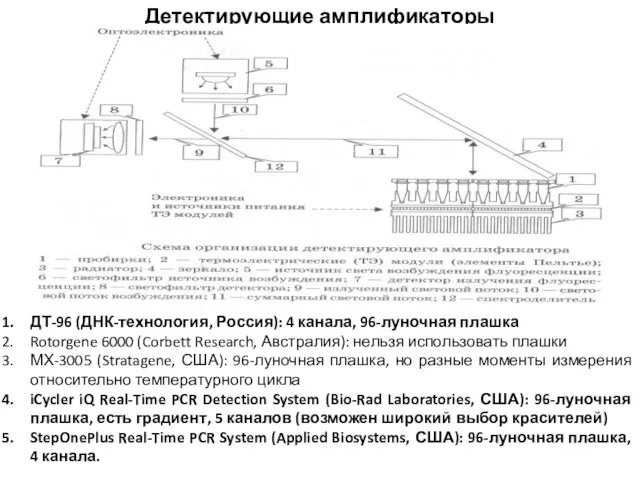
- 40. Детектирующие амплификаторы ДТ-96 (ДНК-технология, Россия): 4 канала, 96-луночная плашка Rotorgene 6000 (Corbett Research, Австралия): нельзя использовать
- 41. ПЦР в реальном времени (ПЦР-РВ) Детектирующий амплификатор определяет количество ПЦР-продукта на каждом цикле, но не молекулы
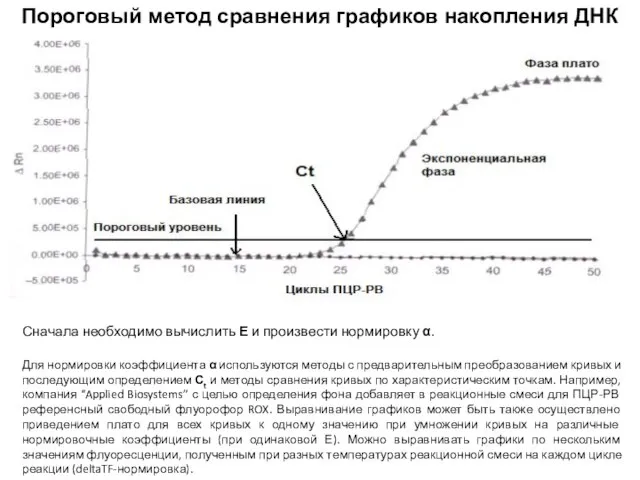
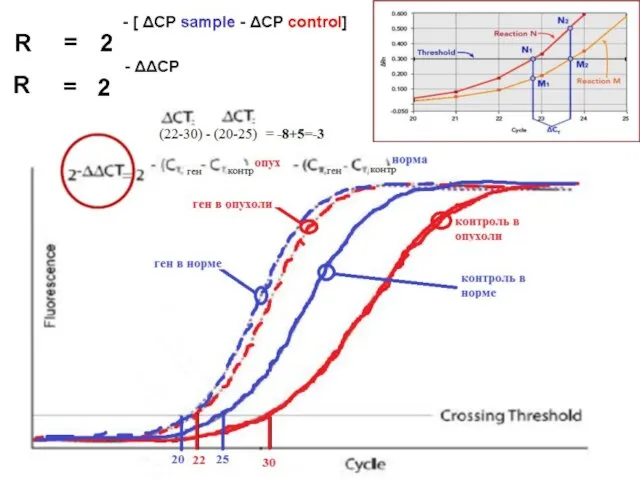
- 42. Пороговый метод сравнения графиков накопления ДНК Суть порогового метода заключается в том, чтобы определить момент Ct,
- 43. Пороговый метод сравнения графиков накопления ДНК Сначала необходимо вычислить Е и произвести нормировку α. Для нормировки
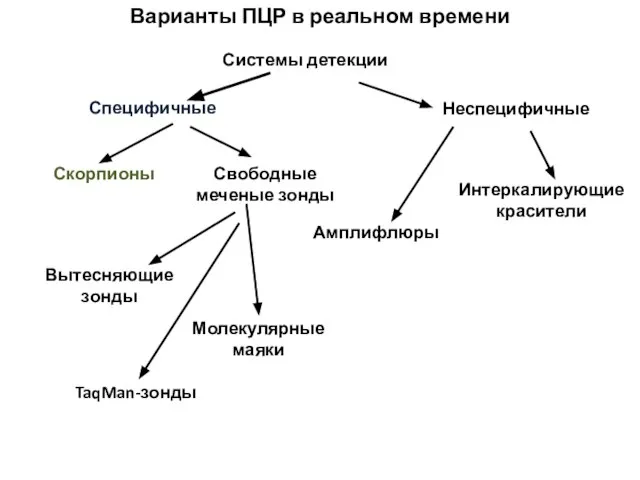
- 44. Варианты ПЦР в реальном времени Системы детекции Специфичные Неспецифичные Интеркалирующие красители Амплифлюры Скорпионы Свободные меченые зонды
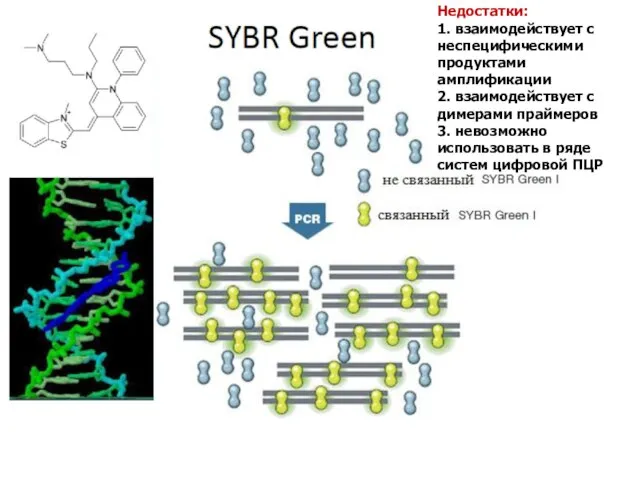
- 45. Недостатки: 1. взаимодействует с неспецифическими продуктами амплификации 2. взаимодействует с димерами праймеров 3. невозможно использовать в
- 46. Амплифлюры
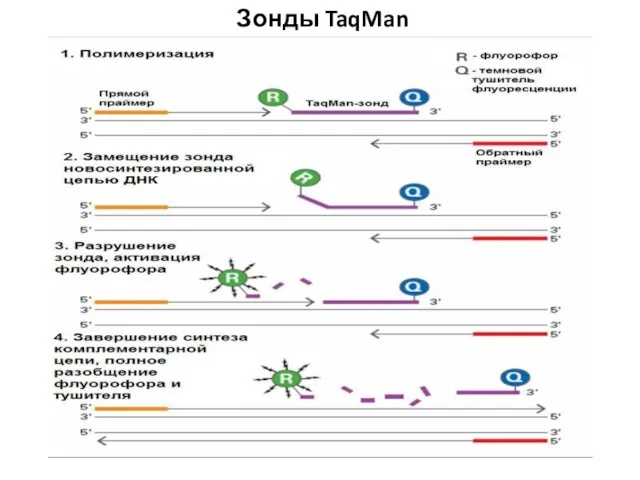
- 47. Зонды TaqMan
- 48. Молекулярный маяк представляет собой меченый красителем олигонуклеотид (25-40 нуклеотидов), который образует шпилечную структуру со стеблем и
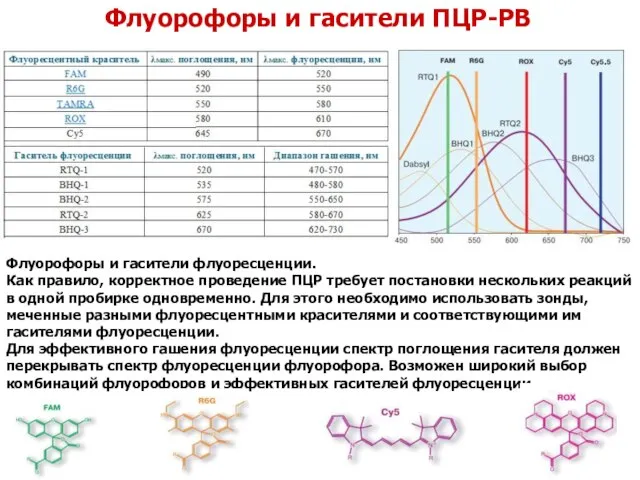
- 49. Флуорофоры и гасители ПЦР-РВ Флуорофоры и гасители флуоресценции. Как правило, корректное проведение ПЦР требует постановки нескольких
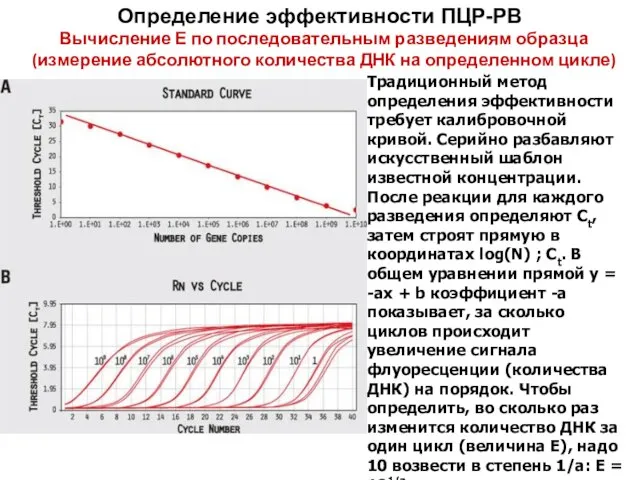
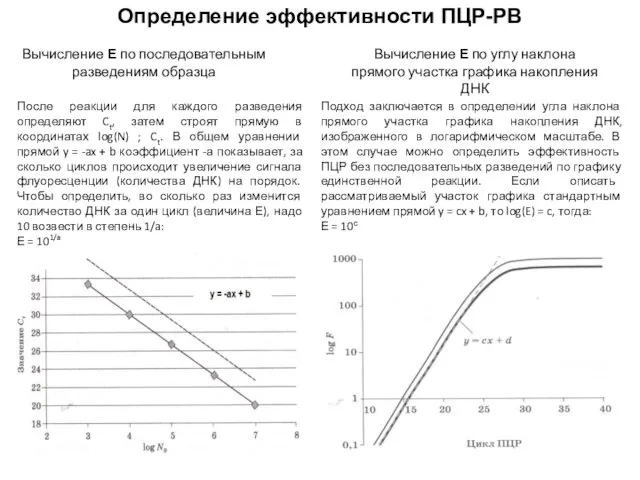
- 50. Определение эффективности ПЦР-РВ Вычисление Е по последовательным разведениям образца (измерение абсолютного количества ДНК на определенном цикле)
- 51. Определение эффективности ПЦР-РВ Вычисление Е по последовательным разведениям образца Вычисление Е по углу наклона прямого участка
- 52. Абсолютное и относительное определение количества исходной ДНК Формула N0 = N0rE(Ctr – Ct) необходима тогда, когда
- 53. Абсолютное и относительное определение количества исходной ДНК (продолжение) Предполагая, что условия ПЦР-РВ оптимизированы и эффективности реакции
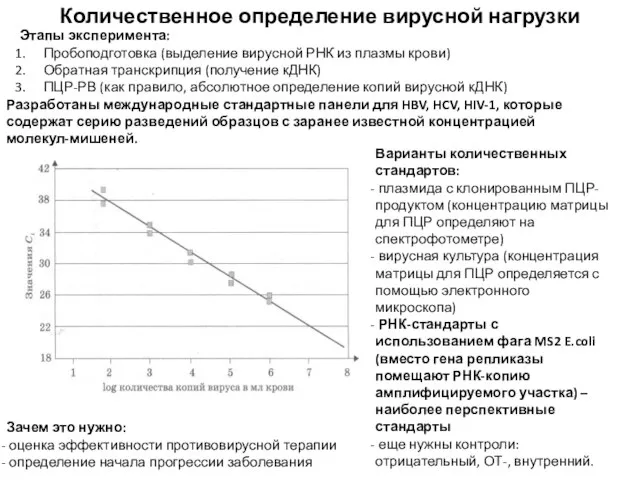
- 54. Количественное определение вирусной нагрузки Этапы эксперимента: Пробоподготовка (выделение вирусной РНК из плазмы крови) Обратная транскрипция (получение
- 55. ДНК-диагностика онкогематологических заболеваний Полная ремиссия: отсутствие клинических симптомов болезни (клиническая ремиссия) и присутствие в миелограмме менее
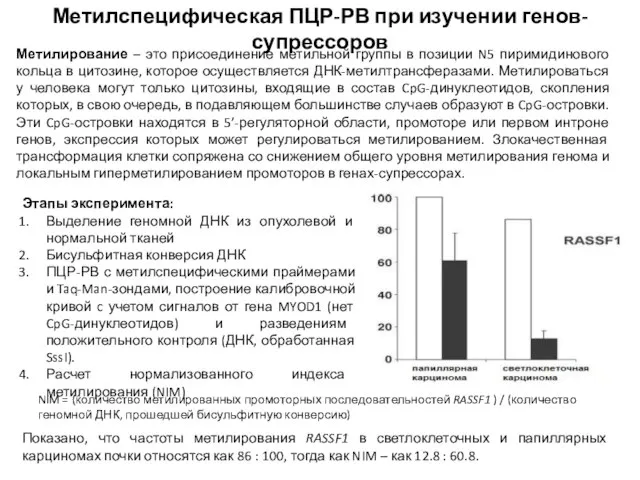
- 56. Метилспецифическая ПЦР-РВ при изучении генов-супрессоров Метилирование – это присоединение метильной группы в позиции N5 пиримидинового кольца
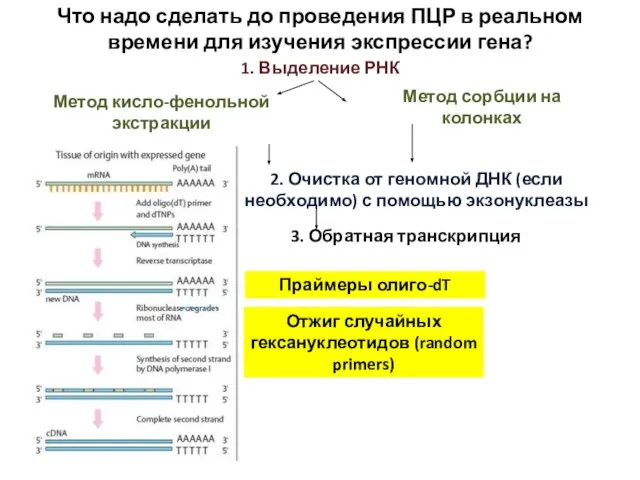
- 57. Что надо сделать до проведения ПЦР в реальном времени для изучения экспрессии гена? Метод кисло-фенольной экстракции
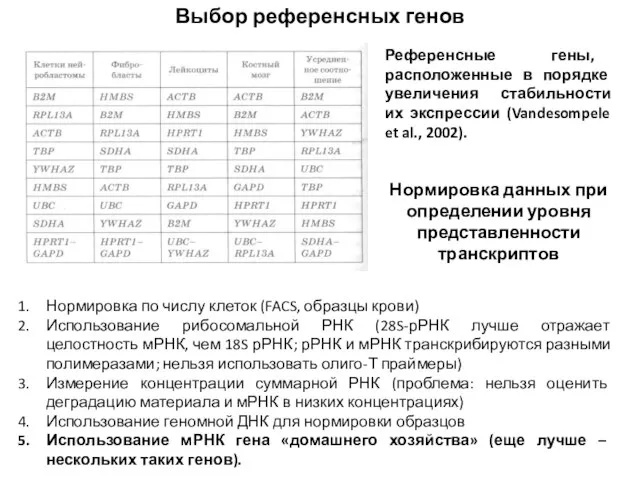
- 58. Выбор референсных генов Референсные гены, расположенные в порядке увеличения стабильности их экспрессии (Vandesompele et al., 2002).
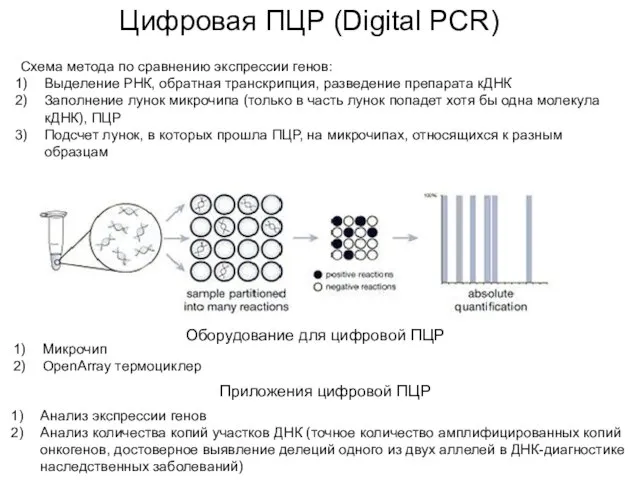
- 60. Цифровая ПЦР (Digital PCR) Схема метода по сравнению экспрессии генов: Выделение РНК, обратная транскрипция, разведение препарата
- 61. Выходящий тестовый контроль 1. Увеличение количества ПЦР-продуктов при эффективности ПЦР, равной 2, происходит: линейно логарифмически стохастически
- 64. Скачать презентацию


























 Глобальная проблема коронавируса и его последствия
Глобальная проблема коронавируса и его последствия Перитонит. Клиническая картина и диагностика
Перитонит. Клиническая картина и диагностика Введение в клиническую биохимию. Биологические маркеры
Введение в клиническую биохимию. Биологические маркеры Покровные протезы
Покровные протезы Trypanosoma Brucei
Trypanosoma Brucei Общество православных студентов-медиков СГМУ
Общество православных студентов-медиков СГМУ АО ННМЦ Кетамин
АО ННМЦ Кетамин Токсическое действие алкоголя на организм человека
Токсическое действие алкоголя на организм человека Основы реабилитации пациентов. Тема 1
Основы реабилитации пациентов. Тема 1 SARS-CoV-2. Тяжёлый острый респираторный синдром – коронавирус 2 COVID – 19
SARS-CoV-2. Тяжёлый острый респираторный синдром – коронавирус 2 COVID – 19 Врожденная непроходимость желудочно-кишечного тракта
Врожденная непроходимость желудочно-кишечного тракта Гистология
Гистология Атеросклероз. Этиологисы
Атеросклероз. Этиологисы Парапроктит и свищи прямой кишки
Парапроктит и свищи прямой кишки Дифференциальная диагностика: патопсихологические симптомокомплексы
Дифференциальная диагностика: патопсихологические симптомокомплексы Аллергия. Типы гиперчувствительности
Аллергия. Типы гиперчувствительности Штифт или вкладка: что лучше выбрать под зубную коронку
Штифт или вкладка: что лучше выбрать под зубную коронку Черепно-мозговые нервы III - V. Методика исследования. Симптомы поражения. Альтернирующие синдромы. (Занятие 4)
Черепно-мозговые нервы III - V. Методика исследования. Симптомы поражения. Альтернирующие синдромы. (Занятие 4) Жедел пневмониялар: бронхопневмония, крупозды, аралық. Морфологиялық сипаттамасы, нәтижелері және асқынулары
Жедел пневмониялар: бронхопневмония, крупозды, аралық. Морфологиялық сипаттамасы, нәтижелері және асқынулары Мімічна мускулатура
Мімічна мускулатура Спинномозговые нервы
Спинномозговые нервы Основы физиотерапии. Тема 3
Основы физиотерапии. Тема 3 Ембріотехнології. Виникнення ембріотехнологій
Ембріотехнології. Виникнення ембріотехнологій Ритмокардиография в спорте
Ритмокардиография в спорте Антиредукционизм в отечественной психологии и в работах В.П. Зинченко
Антиредукционизм в отечественной психологии и в работах В.П. Зинченко Воспаления среднего уха у новорожденных и грудных детей
Воспаления среднего уха у новорожденных и грудных детей Точечный массаж
Точечный массаж Использование углерода в медицине
Использование углерода в медицине