Содержание
- 2. Зміст Фармаконагляд в Україні Нормативні документи, що регламентують фармаконагляд в Україні Поняття про НППІ Класифікація НППІ
- 3. Як додати вакцину до календаря щеплень? Національна технічна група експертів з імунопрофілактики НТГЕІ група експертів в
- 4. Рекомендації НТГЕІ Наскільки безпечна вакцина при її введенні в певних вікових групах? Як добре працює вакцина
- 5. Фармаконагляд – наукова галузь та практична діяльність, що пов'язана з виявленням, оцінкою, розумінням та профілактикою несприятливих
- 6. ДП «Державний експертний центр Міністерства охорони здоров’я України» у фармацевтичній галузі заявники у сфері охорони здоров’я
- 7. Типи систем нагляду за безпекою імунізації усі спонтанні повідомлення про НППІ переваги: раннє виявлення невідомих серйозних
- 8. Дві послідовні одна за одною події можуть здаватися пов’язаними, але, тим не менш, можуть бути незалежні
- 9. Це сталося одразу після 2-ого щеплення Призерша ВИНАГОРОДА за вакцинацію в новинах Приз в лото після
- 10. …Якщо вакцинацію пов’язують з чимось «негативним», то це одразу розглядається, як цілком можлива подія – навіть
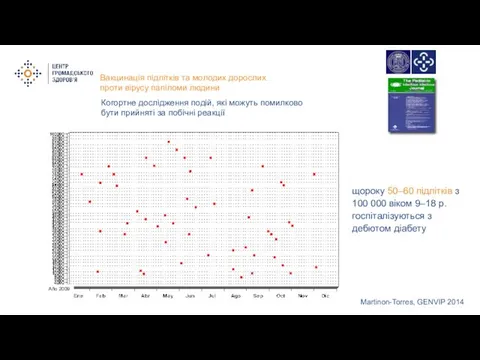
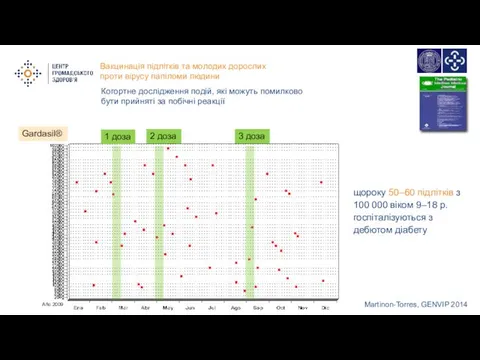
- 11. Martinon-Torres, GENVIP 2014 щороку 50–60 підлітків з 100 000 віком 9–18 р. госпіталізуються з дебютом діабету
- 12. 1 доза 2 доза 3 доза Gardasil® щороку 50–60 підлітків з 100 000 віком 9–18 р.
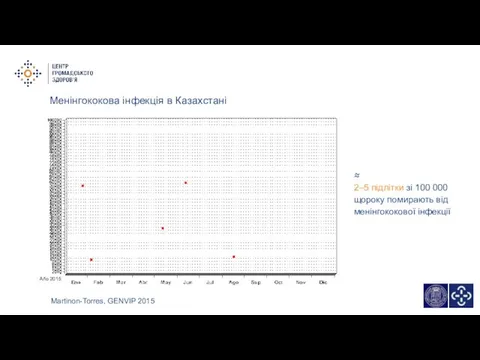
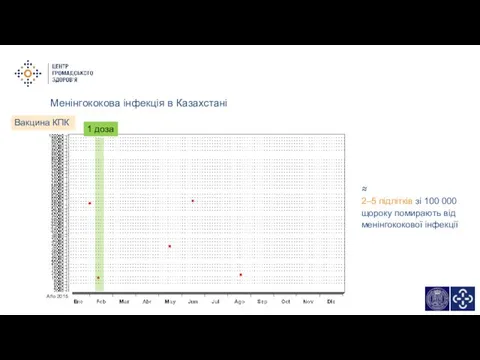
- 13. Менінгококова інфекція в Казахстані Martinon-Torres, GENVIP 2015 ≈ 2–5 підлітки зі 100 000 щороку помирають від
- 14. 1 доза Вакцина КПК Менінгококова інфекція в Казахстані ≈ 2–5 підлітків зі 100 000 щороку помирають
- 15. Компоненти глобальної системи моніторингу безпеки вакцин, розслідування та прийняття відповідних заходів Глобальні консультації та відповідні заходи
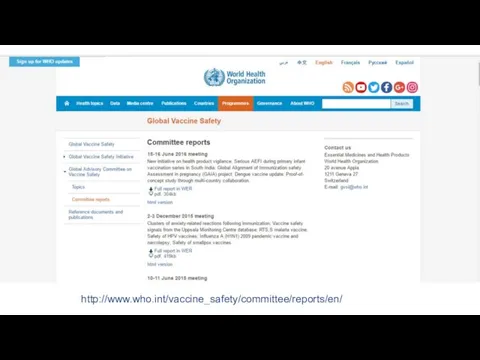
- 16. http://www.who.int/vaccine_safety/committee/reports/en/
- 19. Побічна реакція – будь-яка ненавмисна і шкідлива реакція на лікарський засіб; будь-яка ненавмисна і шкідлива реакція
- 20. Серйозна побічна реакція – будь-яка побічна реакція, що призводить до смерті, становить загрозу для життя, вимагає
- 21. передбачена побічна реакція непередбачена побічна реакція УЗГОДЖУЮТЬСЯ НЕ УЗГОДЖУЮТЬСЯ УЗГОДЖУЮТЬСЯ побічна реакція, характер або тяжкість проявів
- 22. Незафіксована побічна реакція лікарського засобу, вакцини, туберкуліну – побічна реакція, характер або тяжкість проявів якої не
- 23. Несприятлива подія після імунізації/туберкулінодіагностики – будь-яка несприятлива з медичної точки зору подія, що спостерігається після імунізації/туберкулінодіагностики
- 24. Причинно-наслідковий зв’язок між клінічними проявами будь-якої побічної реакції/несприятливої події після імунізації/туберкулінодіагностики та застосуванням лікарського засобу, вакцини,
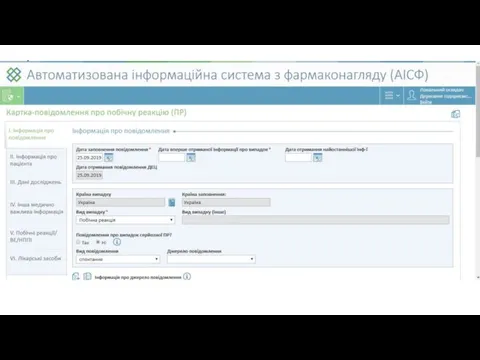
- 25. Карта-повідомлення про побічну реакцію лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятливу подію
- 28. Медичний працівник Пацієнт Заявник надання картки-повідомлення ПР/ВЕ ЛЗ* Аналіз Оприлюднення узагальнених даних на офіційному сайті ДЕЦ
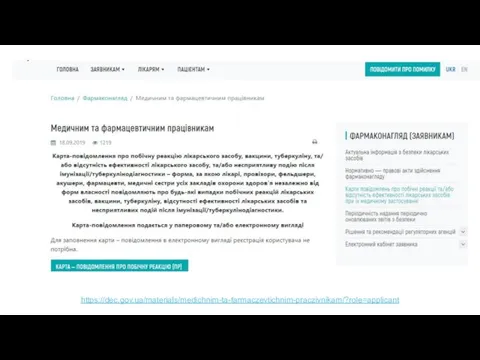
- 29. https://dec.gov.ua/materials/medichnim-ta-farmaczevtichnim-praczivnikam/?role=applicant
- 31. https://dec.gov.ua/materials/paczi-ntam-abo-h-predstavnikam-rekomendaczi-do-zapovnennya-karti-povidomlennya/?role=patient
- 32. Класифікація несприятливих подій після імунізації/туберкулінодіагностики НППІ
- 33. https://www.who.int/vaccine_safety/publications/gvs_aefi/en/
- 34. ПРОТОКОЛ розслідування та встановлення причинно-наслідкового зв’язку між серйозними та/або груповими НППІ/туберкулінодіагностики й застосуванням вакцини, туберкуліну https://dec.gov.ua//wp-content/uploads/farmakonaglyad/regulatory-documents/protokol.pdf
- 35. Розслідування НППІ 4 етапи Збір інформації, що стосується розвитку серйозних та/або групових несприятливих подій після імунізації
- 36. 3 етап Алгоритм визначення причинно-наслідкового зв’язку між серйозними та/або груповими НППІ та застосуванням вакцини, туберкуліну С.
- 37. 4 етап Категорії причинно-наслідкового зв’язку між серйозними та/або груповими НППІ та застосуванням вакцини, туберкуліну Наявна достатня
- 38. Причинно-наслідковий зв’язок між клінічними проявами будь-якої побічної реакції/несприятливої події після імунізації/туберкулінодіагностики та застосуванням лікарського засобу, вакцини,
- 39. Дівчина, 14 років померла через кілька годин після введення вакцини проти ВПЛ: на розтині виявлено велику
- 40. http://vaccine-safety-training.org/
- 42. Скачать презентацию






























 М-система. Программа лояльности для фармацевтической отрасли
М-система. Программа лояльности для фармацевтической отрасли Семиотика. Практическое задание по психопатологии
Семиотика. Практическое задание по психопатологии Безопасность использования в медицинских целях листьев подорожника, произрастающего в антропогенно нарушенных местообитаниях
Безопасность использования в медицинских целях листьев подорожника, произрастающего в антропогенно нарушенных местообитаниях Преэклампсия. Этиопатогенез
Преэклампсия. Этиопатогенез Клименко
Клименко Будова та розвиток скелету
Будова та розвиток скелету Острые коронарные синдромы. Инфаркт миокарда и нестабильная стенокардия
Острые коронарные синдромы. Инфаркт миокарда и нестабильная стенокардия Организация оказания анестезиолого - реанимационной помощи взрослому населению в Российской Федерации
Организация оказания анестезиолого - реанимационной помощи взрослому населению в Российской Федерации Изучение стабильности и сроков годности спиртосодержащих жидких лекарственных форм аптечного изготовления
Изучение стабильности и сроков годности спиртосодержащих жидких лекарственных форм аптечного изготовления Гипертоническая болезнь
Гипертоническая болезнь Воздушно-капельные инфекции
Воздушно-капельные инфекции Определение групп крови
Определение групп крови Группа низшие черви. Тип плоские
Группа низшие черви. Тип плоские Трансмиссивті инфекциялардың қоздырғыштары
Трансмиссивті инфекциялардың қоздырғыштары Хронические гепатиты
Хронические гепатиты Структура приемного покоя детского стационара
Структура приемного покоя детского стационара Лимфатическая система человека
Лимфатическая система человека Аллергический ринит
Аллергический ринит Проблема ВИЧ-инфекции
Проблема ВИЧ-инфекции Paura kauls os parietale
Paura kauls os parietale Эпидемии (игра)
Эпидемии (игра) Здоровый образ жизни
Здоровый образ жизни Стадии кариеса: меловое пятно, пигментированное, поверхностный кариес
Стадии кариеса: меловое пятно, пигментированное, поверхностный кариес Метаболический синдром
Метаболический синдром Основы медицинской статистики
Основы медицинской статистики Гепесвирусные инфекции у детей
Гепесвирусные инфекции у детей Оптимизация терапии Helicobacter pylori-ассоциированной патологии верхних отделов желудочно-кишечного тракта у детей
Оптимизация терапии Helicobacter pylori-ассоциированной патологии верхних отделов желудочно-кишечного тракта у детей Тест: Темперамент
Тест: Темперамент