Содержание
- 2. ОНКОГЕНЕТИКА направление генетики, изучающее причины и законы возникновения и функционирования опухоли.
- 3. ОПУХОЛИ Доброкачественные: Экспансивный медленный рост; Не прорастают в окружающие ткани; Имеют капсулу, отграничивающую опухоль от окружающих
- 4. ОПУХОЛЬ Новообразование, неоплазма - патологическое образование, характеризующееся неконтролируемым размножением клеток с нарушением их роста и дифференцировки,
- 5. Опухоли Саркомы (опухоль возникает в мезенхимальной ткани, например в костях, мышцах, соединительной ткани или в тканях
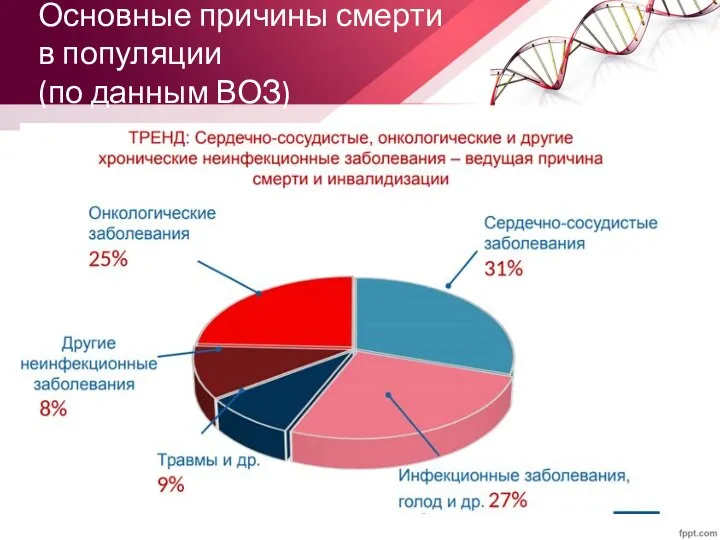
- 6. Основные причины смерти в популяции (по данным ВОЗ)
- 7. КАНЦЕРОГЕНЫ физические ультрафиолетовое и ионизирующее излучение; химические асбест, компоненты табачного дыма, афлатоксины (загрязнители пищевых продуктов) мышьяк
- 8. КАНЦЕРОГЕНЕЗ Канцерогенез — сложный патофизиологический процесс зарождения и развития опухоли. (син. онкогенез). Канцерогенез — сложный многоэтапный
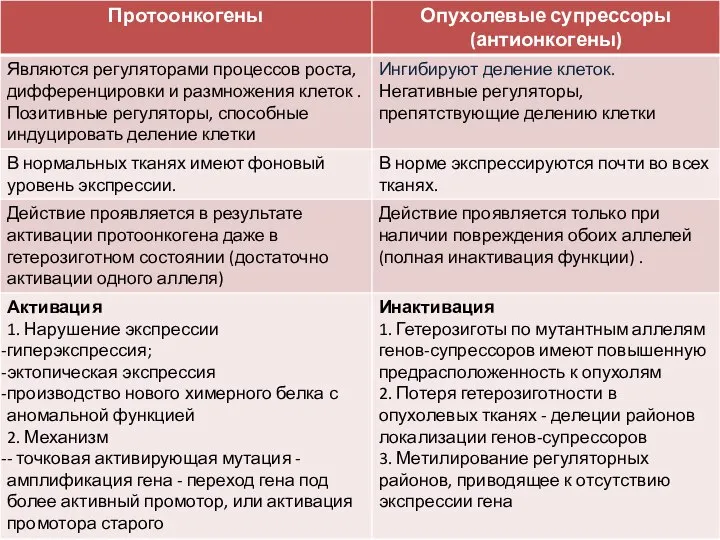
- 9. Генетические аспекты канцерогенеза Генетический аппарат клеток обладает сложной системой контроля деления, роста и дифференцировки клеток Протоонкогены
- 10. Гены-супрессоры опухолей Функции генов-супрессоров противоположны функциям протоонкогенов. Гены-супрессоры оказывают тормозящее влияние на процессы клеточного деления и
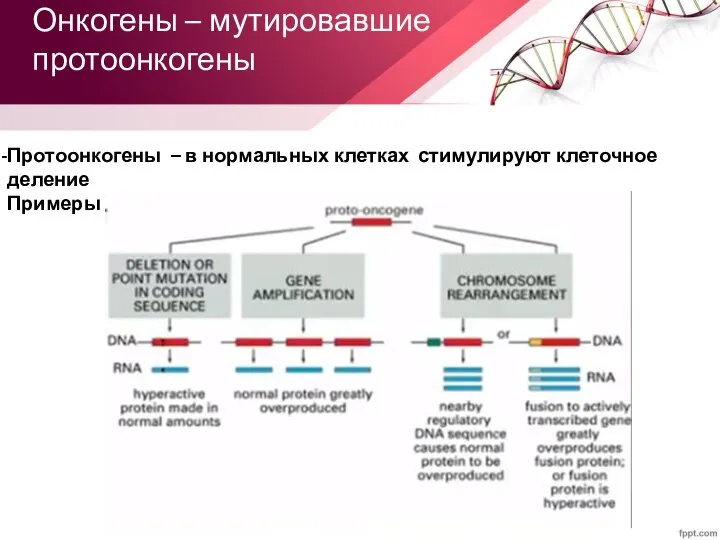
- 11. Онкогены – мутировавшие протоонкогены Протоонкогены – в нормальных клетках стимулируют клеточное деление Примеры (EGFR, KRAS, MET,
- 12. .
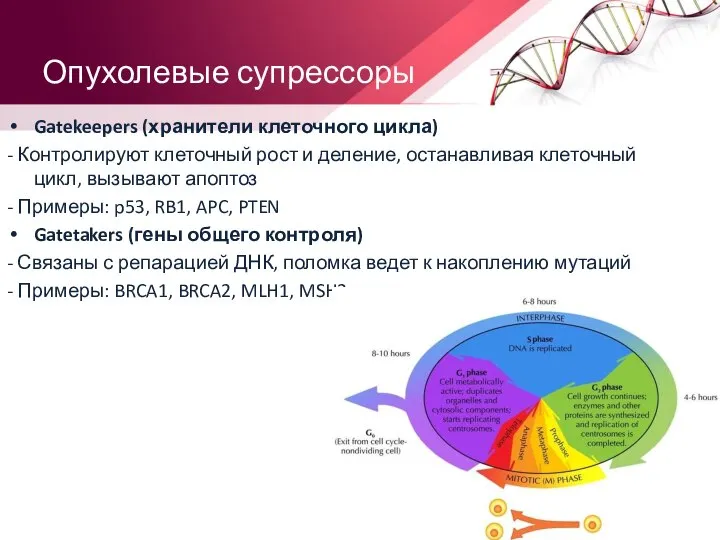
- 13. Опухолевые супрессоры Gatekeepers (хранители клеточного цикла) - Контролируют клеточный рост и деление, останавливая клеточный цикл, вызывают
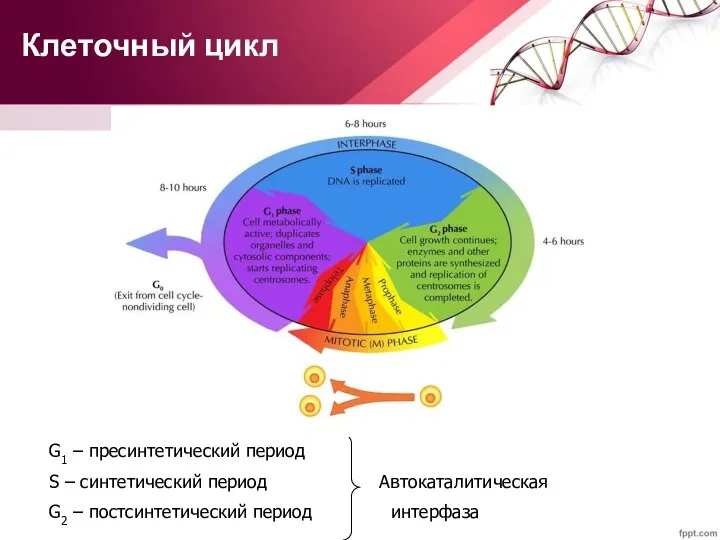
- 14. Клеточный цикл G1 – пресинтетический период S – синтетический период Автокаталитическая G2 – постсинтетический период интерфаза
- 15. Митотическая активность клеток различных тканей Постоянно делящиеся в обновляющихся тканях (клетки базального слоя покровного эпителия, в
- 16. АПОПТОЗ генетически запрограммированная гибель клеток многоклеточного организма. Роль апоптоза: необходим для нормального формирования органов в онтогенезе,
- 17. В норме апоптоз начинается с активации так называемых «рецепторов смерти» на поверхности мембраны клетки путем присоединения
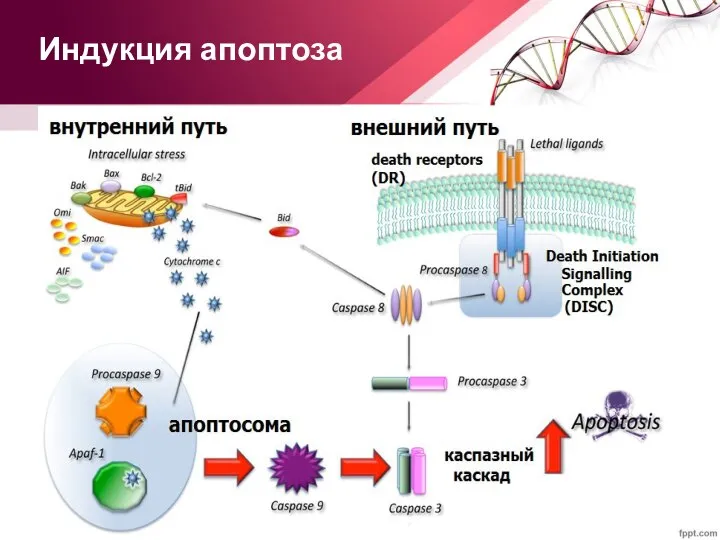
- 18. Индукция апоптоза
- 19. Внешний путь активации апоптоза Внешний путь начинается со связывания CD95 со своим лигандом, CD95L. В результате
- 20. Внутренний путь активации апоптоза Внутренний путь апоптоза запускается различными воздействиями (отсутствие ростовых факторов, стресс и повреждение).
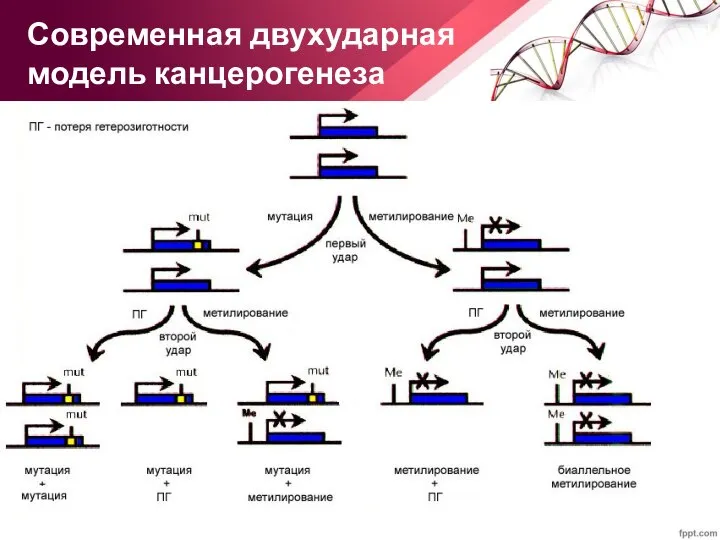
- 22. Современная двухударная модель канцерогенеза
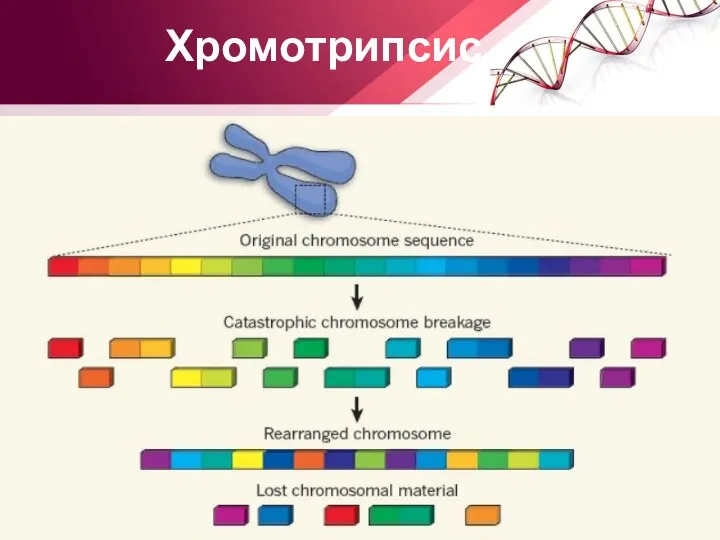
- 23. Хромотрипсис
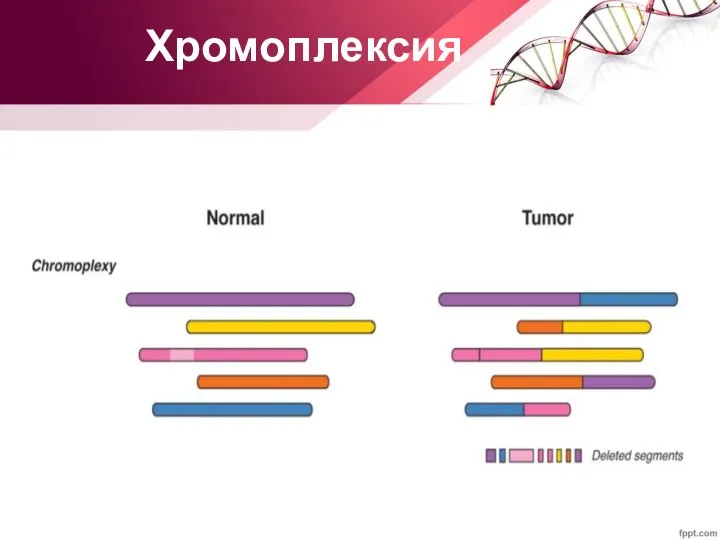
- 24. Хромоплексия
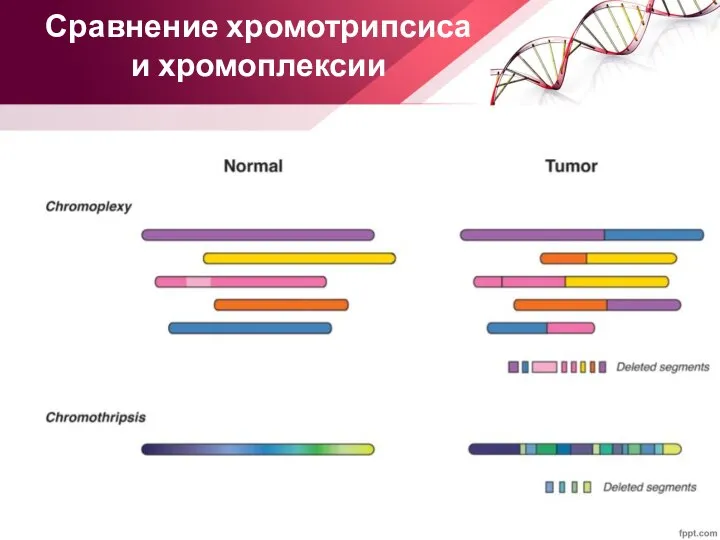
- 25. Сравнение хромотрипсиса и хромоплексии
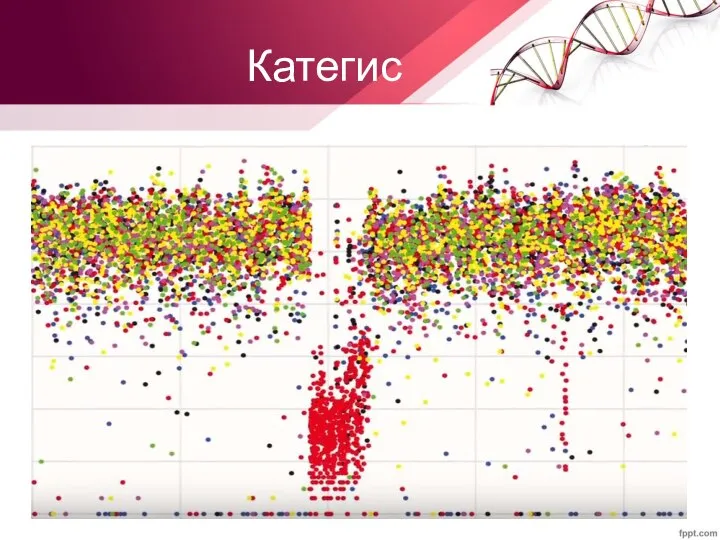
- 26. Категис
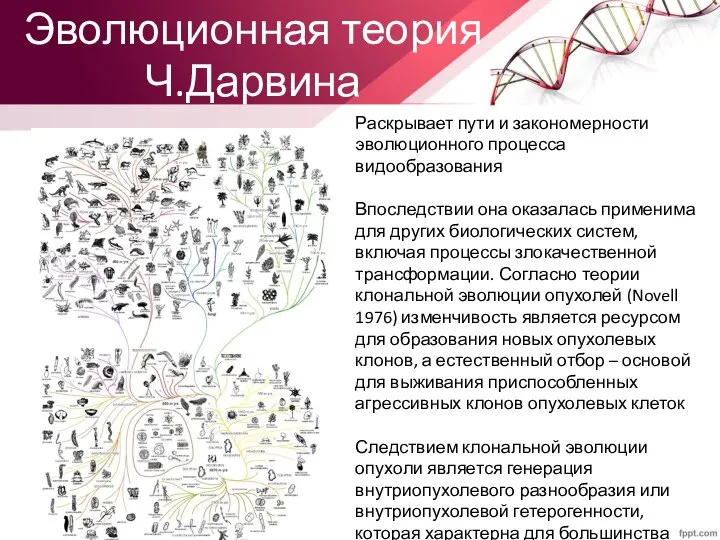
- 27. Эволюционная теория Ч.Дарвина Раскрывает пути и закономерности эволюционного процесса видообразования Впоследствии она оказалась применима для других
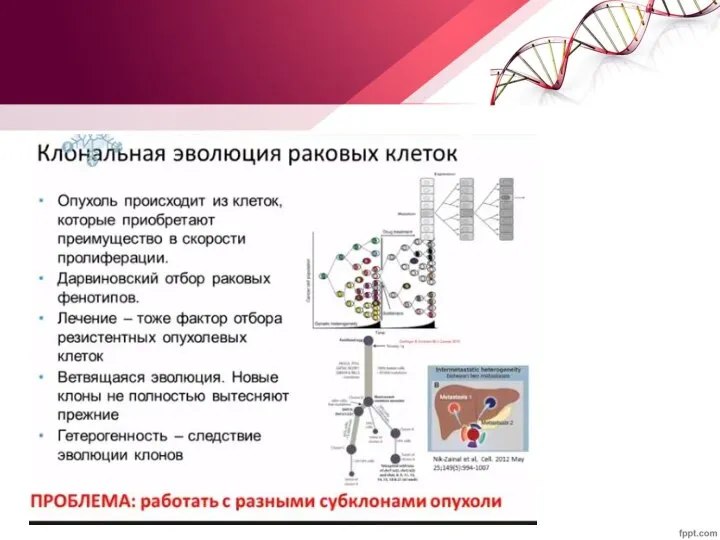
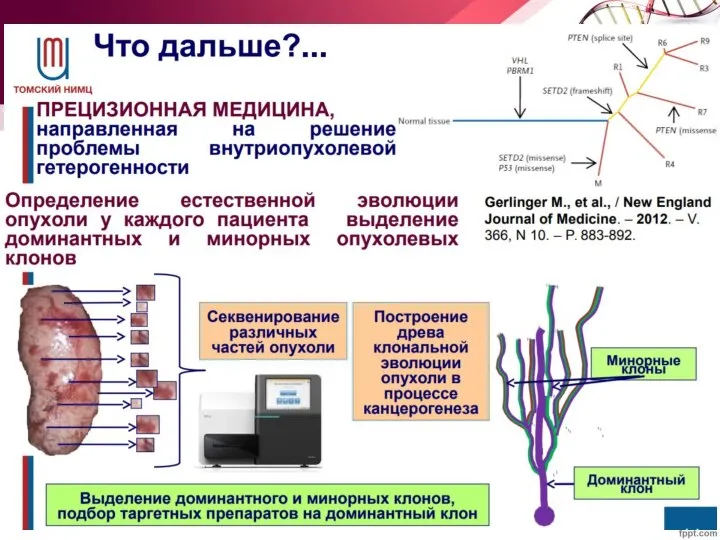
- 28. Гетерогенность опухолевых клеток Существуют две основные гипотезы происхождения гетерогенности опухолевых клеток: различные субклоны опухолевых клеток возникают
- 29. Гетерогенность опухолевых клеток Естественная клональная эволюция происходит за счет внутренних механизмов и определяется драйверными мутациями (возникающими
- 30. Прогрессирование рака
- 31. Прогрессирование рака Constant population
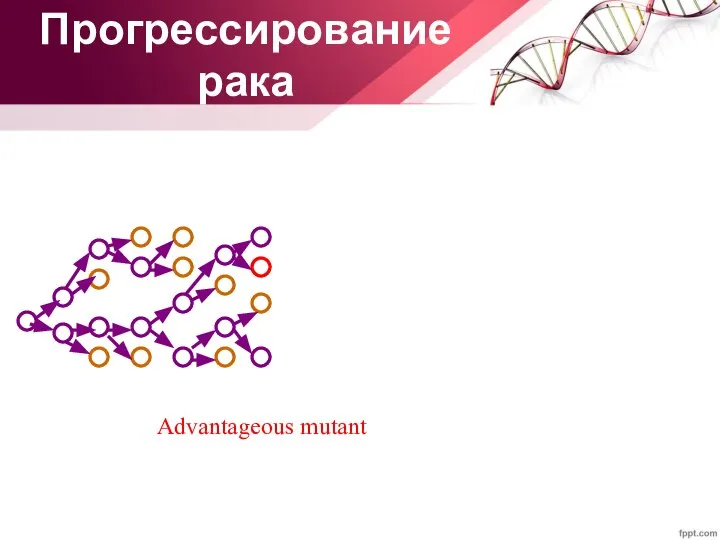
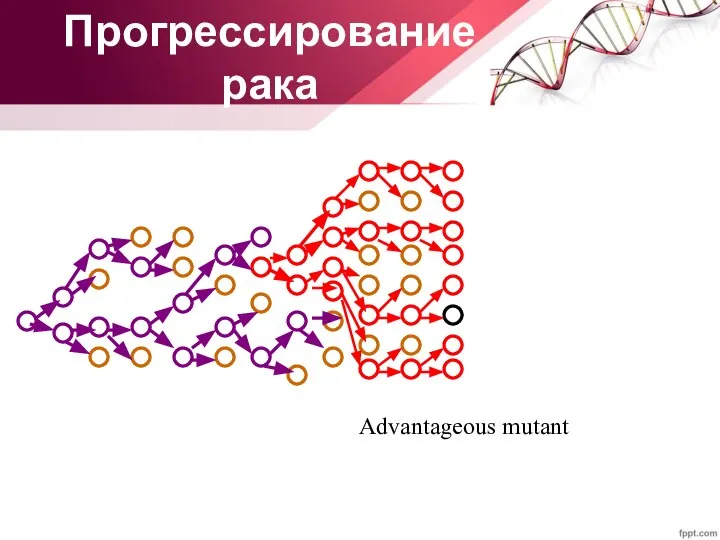
- 32. Прогрессирование рака Advantageous mutant
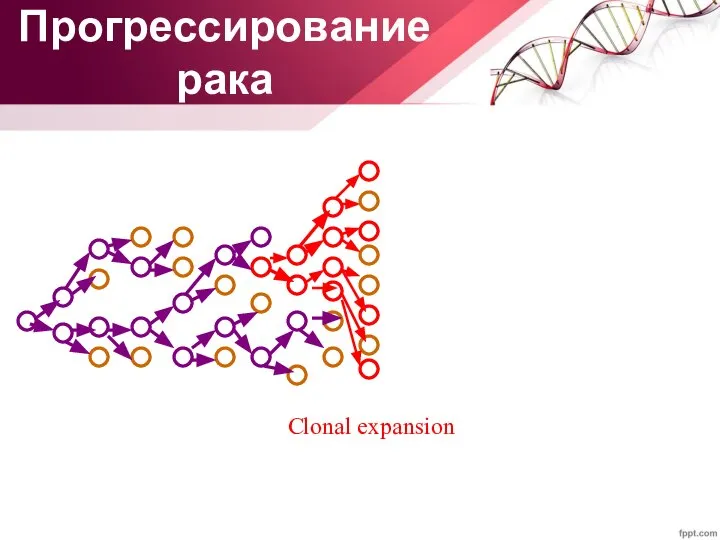
- 33. Clonal expansion Прогрессирование рака
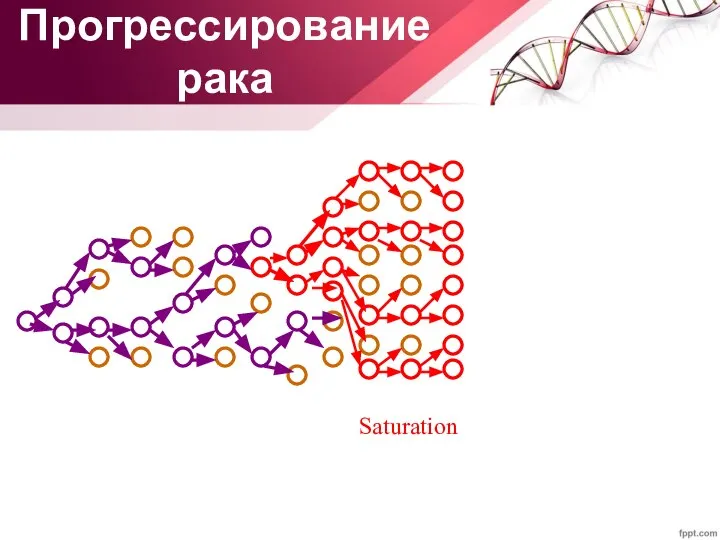
- 34. Saturation Прогрессирование рака
- 35. Advantageous mutant Прогрессирование рака
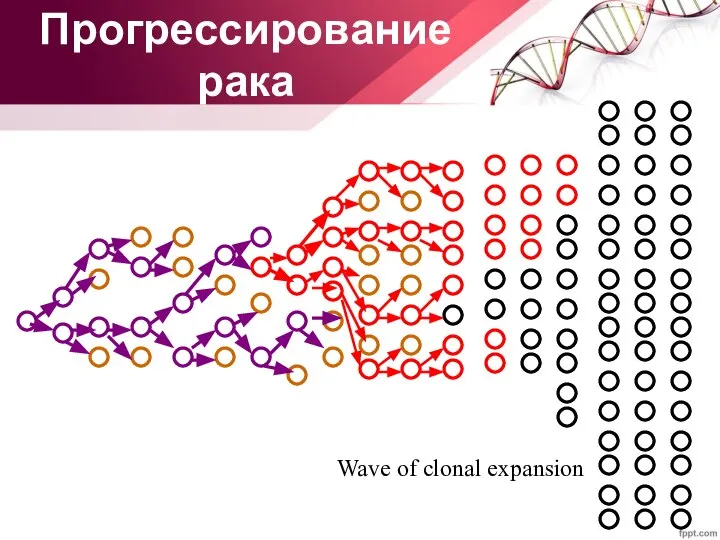
- 36. Wave of clonal expansion Прогрессирование рака
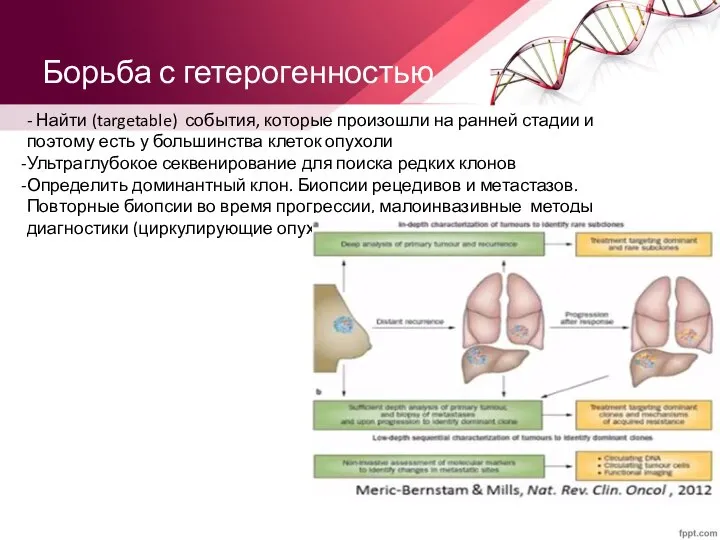
- 38. Борьба с гетерогенностью - Найти (targetable) события, которые произошли на ранней стадии и поэтому есть у
- 39. Мутации драйверы и мутации пассажиры
- 40. Возникающие генетические изменения в опухолевых клетках не всегда приводят к функциональным последствиям, часть из них нейтральны.
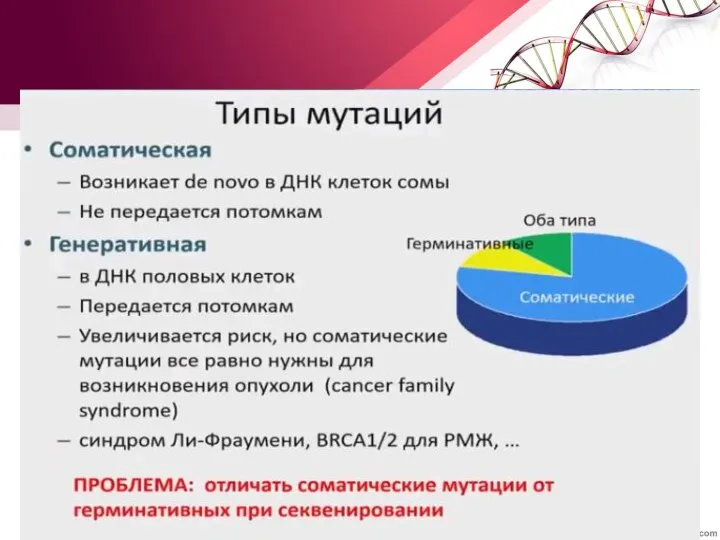
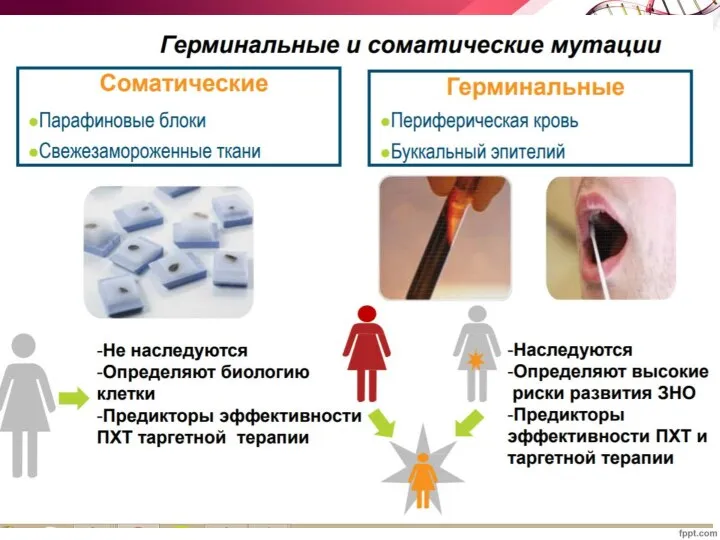
- 43. Генетические нарушения Делеции целых хромосомных районов, содержащих гены супрессоры опухолевого роста (потеря гетерозиготности); Дупликации или амплификации
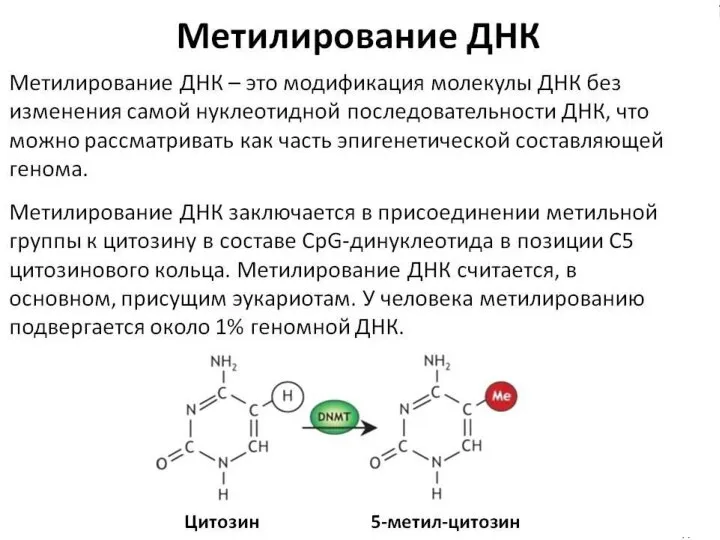
- 44. ЭПИГЕНЕТИЧЕСКИЕ ФАКТОРЫ наследственные и ненаследственные изменения в экспрессии конкретного гена без каких-либо соответствующих структурных изменений в
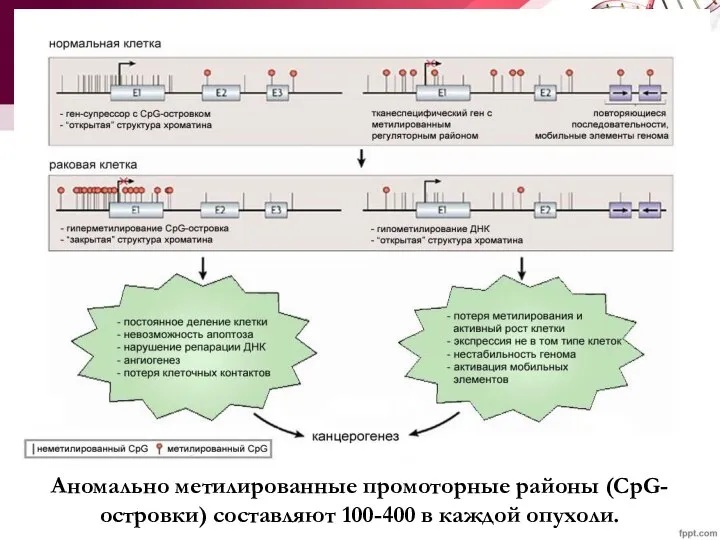
- 46. Аномально метилированные промоторные районы (CpG-островки) составляют 100-400 в каждой опухоли.
- 47. Метилирование ДНК является ценным биомаркером для диагностики рака 1. Целый ряд генов, прямо или косвенно вовлеченных
- 48. Частоты метилирования генов-супрессоров при раке почки В опухолях метилирование VHL определено в 14.2%, RASSF1 – 52.8%,
- 49. Методы анализа метилирования 1. Метилчувствительная ПЦР (NotI, EagI, SacII, HpaII, HhaI) аналитическая чувствительность - 1: 2000
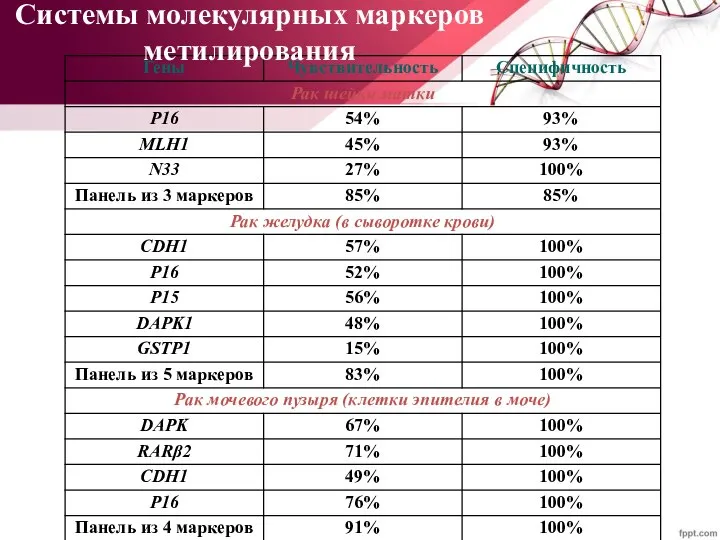
- 50. Системы молекулярных маркеров метилирования
- 51. Метилирование промоторных районов генов RASSF и р16 достоверно чаще происходит в клетках уротелиальных карцином с инвазией
- 52. Метилирование позволяет предсказать поведение опухоли (эффективность терапии, метастазирование): - метилирование WIT1 коррелирует с хеморезистентностью при ОМЛ;
- 53. Метилирование ДНК, как диагностический маркер онкологического заболевания, имеет ряд преимуществ перед другими маркерами Мы определяем положительный
- 54. Молекулярные маркеры, определяемые на ранних стадиях канцерогенеза.
- 55. Метилирование позволяет более точно классифицировать типы и подтипы опухолей: - гиперметилирование BRCA1 обнаружено при раке молочной
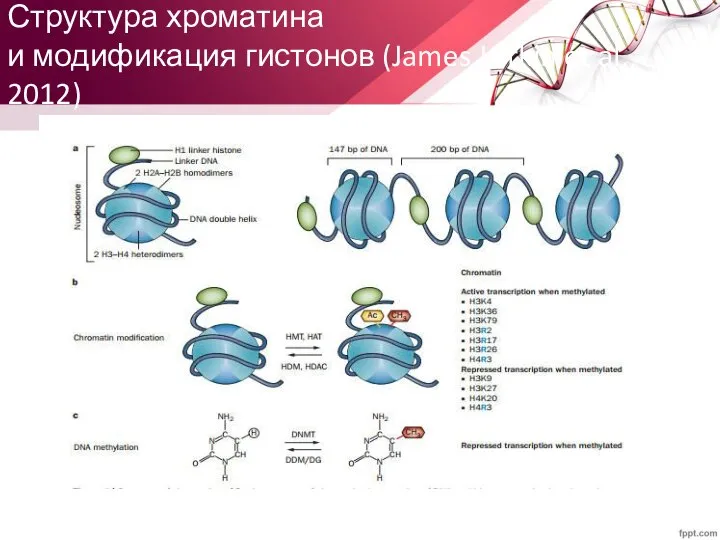
- 56. Структура хроматина и модификация гистонов (James Larkin et al., 2012)
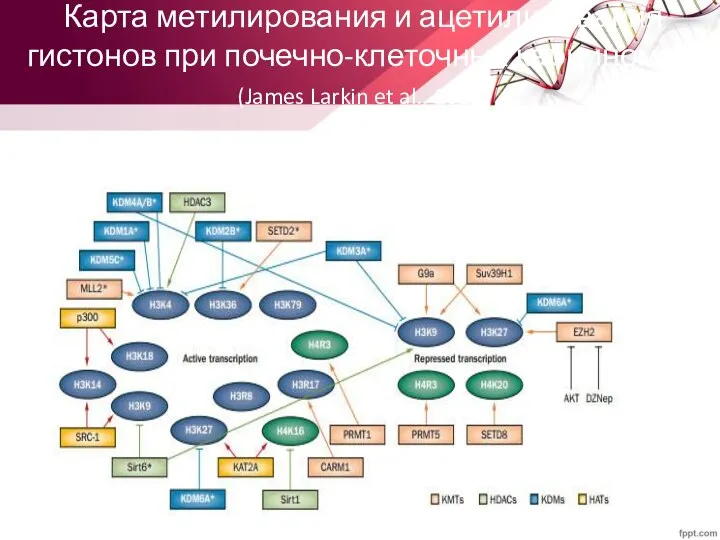
- 57. Карта метилирования и ацетилирования гистонов при почечно-клеточных карциномах (James Larkin et al., 2012)
- 58. РНК-интерференция: процесс подавления экспрессии гена на стадии транскрипции, трансляции, деаденилирования ил деградации мРНК при помощи малых
- 59. МикроРНК - некодирующие РНК, состоящие из 18-24 нуклеотидов и регулирующие экспрессиюдо 30% генов человека. Микро РНК
- 60. Чиповые технологии для высокопроизводительного генотипирования Affymetrix Agilent technologies Genepix Asper Biotech Perkin Elmer Illumina
- 61. Белок р53 Фактор апоптоза p53 определяет повреждения ДНК останавливает синтез ДНК до тех пор, пока не
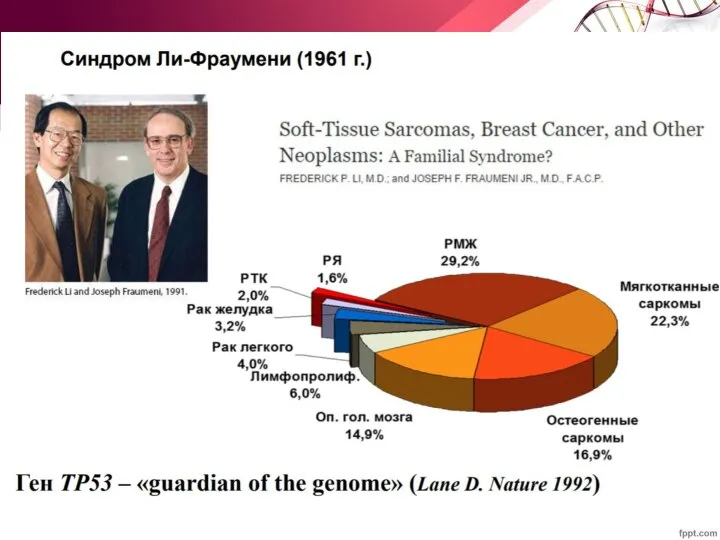
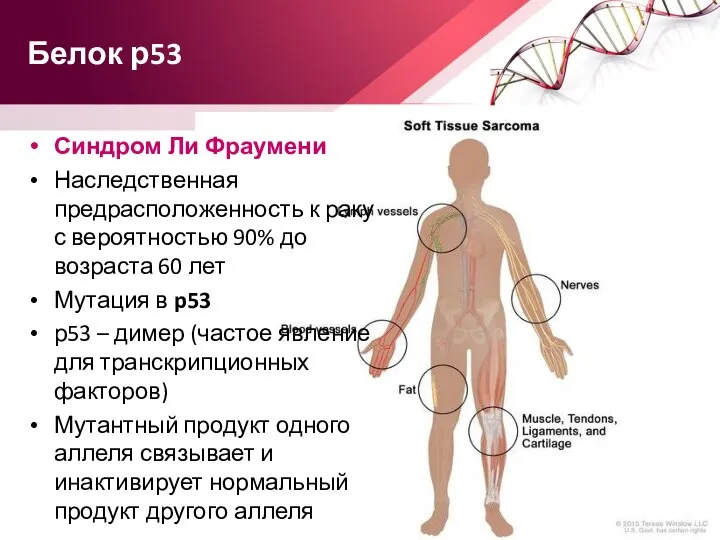
- 63. Белок р53 Синдром Ли Фраумени Наследственная предрасположенность к раку с вероятностью 90% до возраста 60 лет
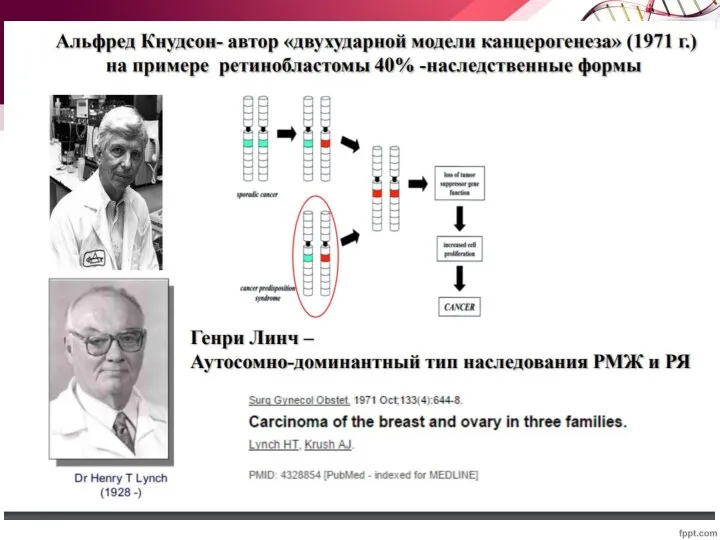
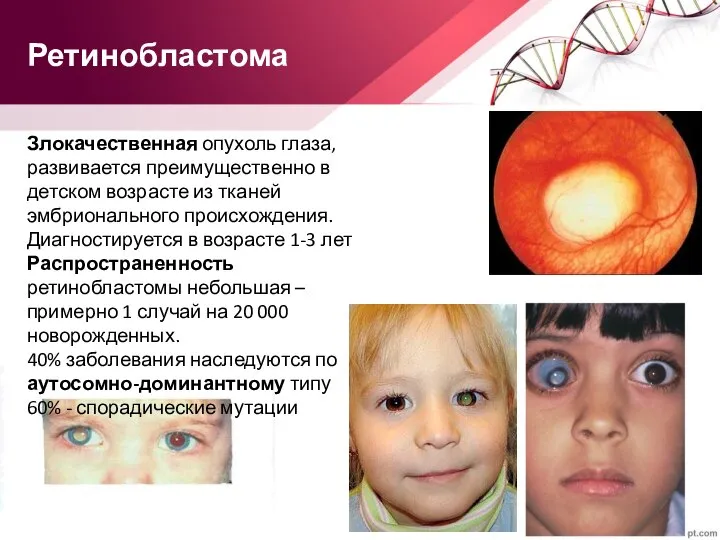
- 64. Ретинобластома Злокачественная опухоль глаза, развивается преимущественно в детском возрасте из тканей эмбрионального происхождения. Диагностируется в возрасте
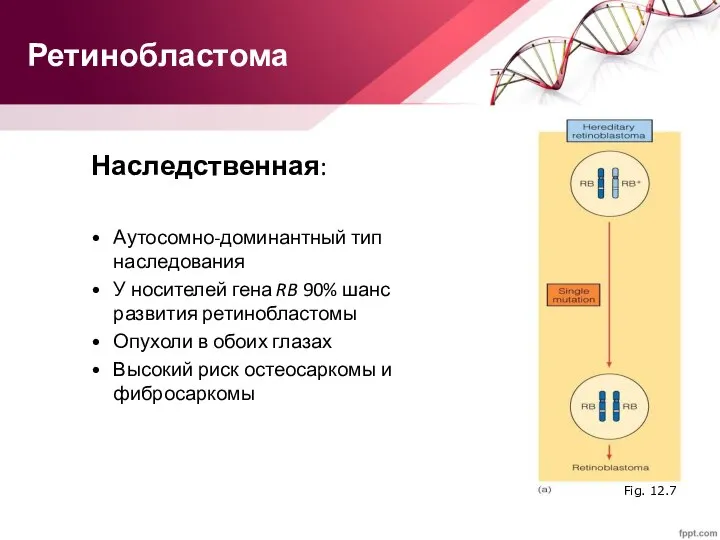
- 65. Ретинобластома Наследственная: Аутосомно-доминантный тип наследования У носителей гена RB 90% шанс развития ретинобластомы Опухоли в обоих
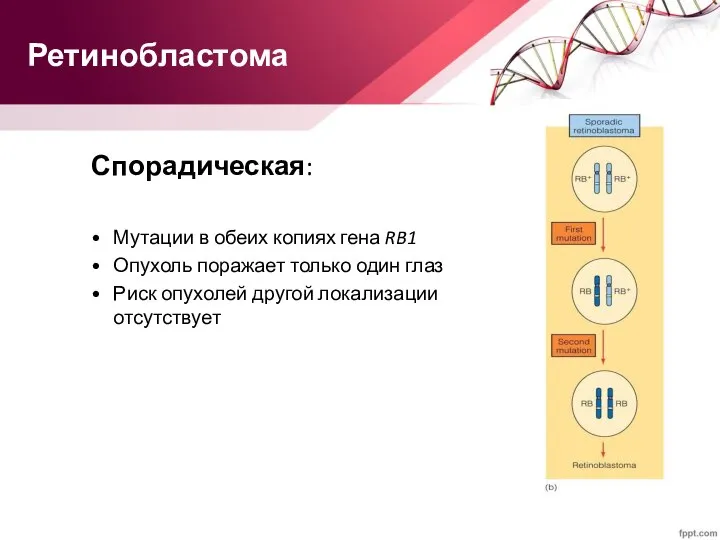
- 66. Ретинобластома Спорадическая: Мутации в обеих копиях гена RB1 Опухоль поражает только один глаз Риск опухолей другой
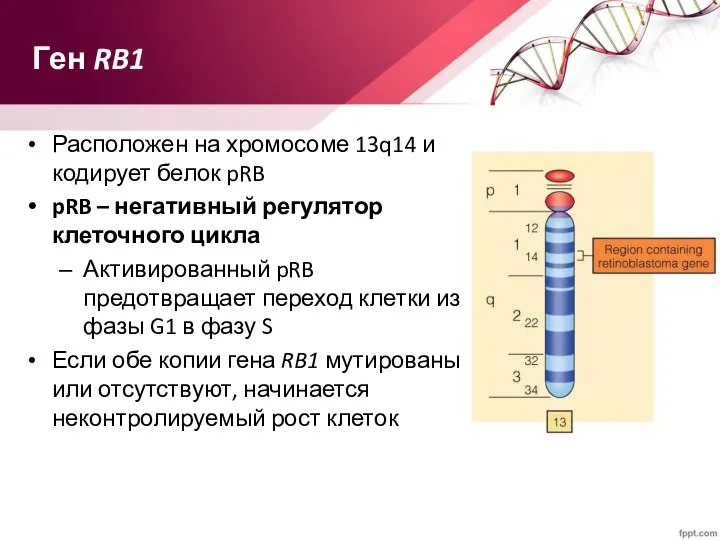
- 67. Ген RB1 Расположен на хромосоме 13q14 и кодирует белок pRB pRB – негативный регулятор клеточного цикла
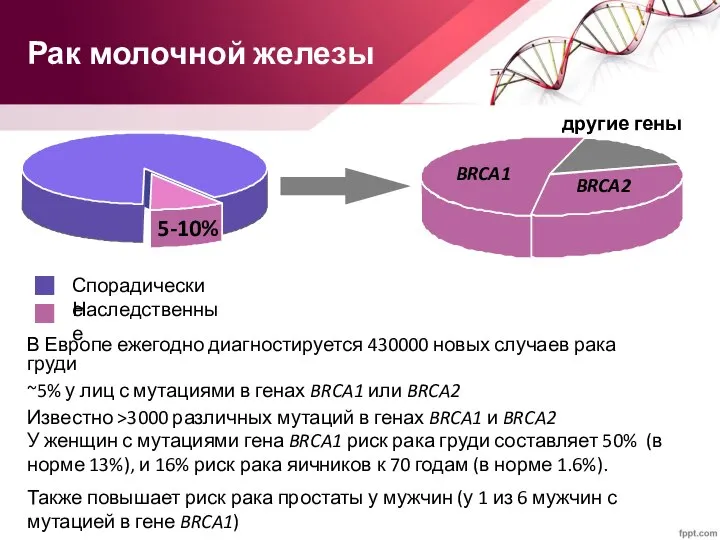
- 68. Рак молочной железы В Европе ежегодно диагностируется 430000 новых случаев рака груди ~5% у лиц с
- 69. Критерии для постановки диагноза наследственного рака молодой возраст возникновения онкологического заболевания; Наследственный анамнез (наличие в семье
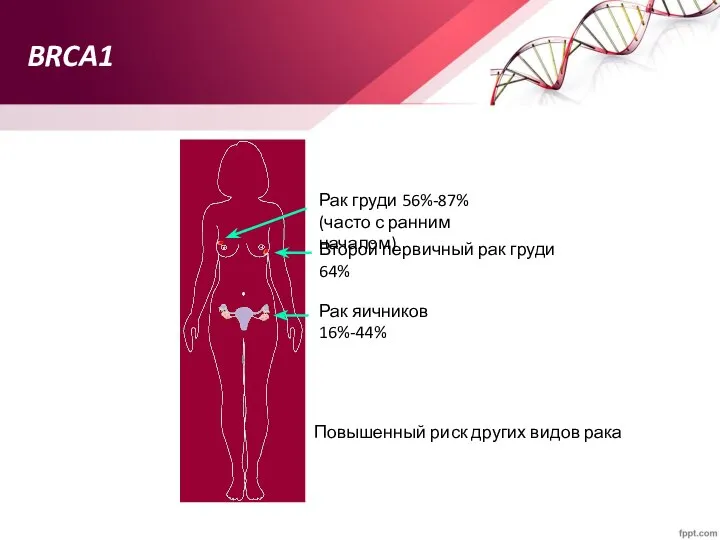
- 70. BRCA1 Повышенный риск других видов рака Рак груди 56%-87% (часто с ранним началом) Второй первичный рак
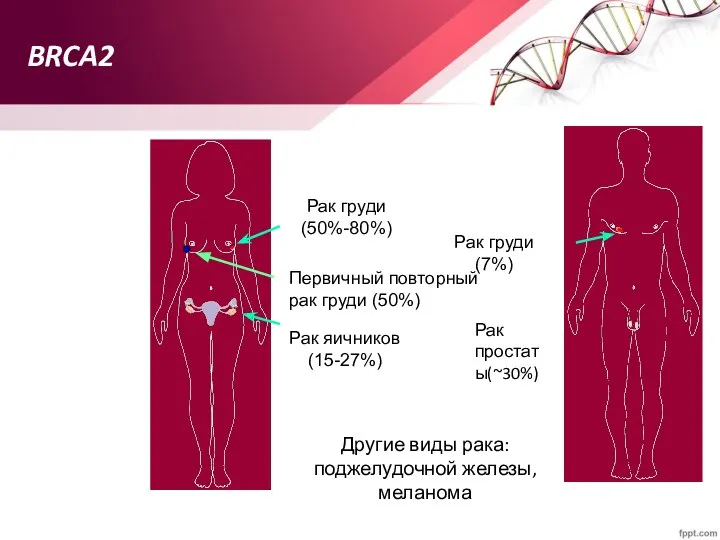
- 71. BRCA2 Другие виды рака: поджелудочной железы, меланома Рак груди (50%-80%) Рак яичников (15-27%) Рак груди (7%)
- 72. Экспрессия повышена в точке перехода из фазы G1 в фазу S и в течение фазы S
- 73. Скрининговые обследования: Маммография/МРТ Профилактическая мастэктомия ~90% снижение риска Профилактическая двусторонняя сальпингооофория ~96-98% снижение риска рака яичников
- 75. Показания: 2 родственников первой или второй степени с раком груди в возрасте до 50 лет 3
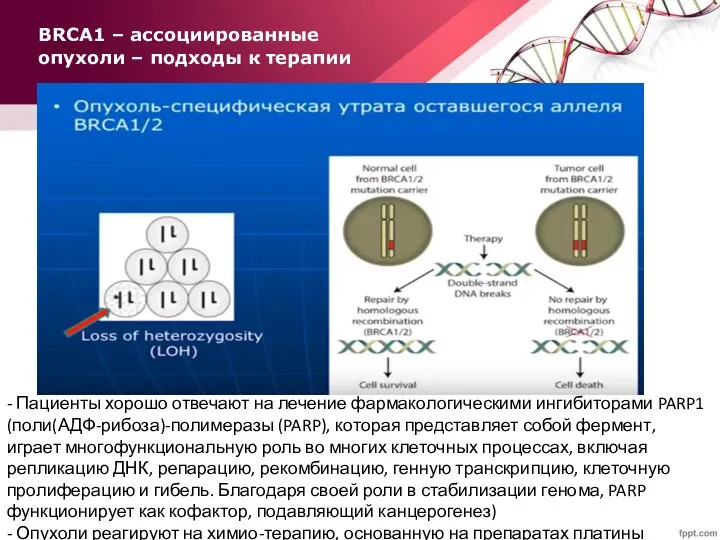
- 76. BRCA1 – ассоциированные опухоли – подходы к терапии - Пациенты хорошо отвечают на лечение фармакологическими ингибиторами
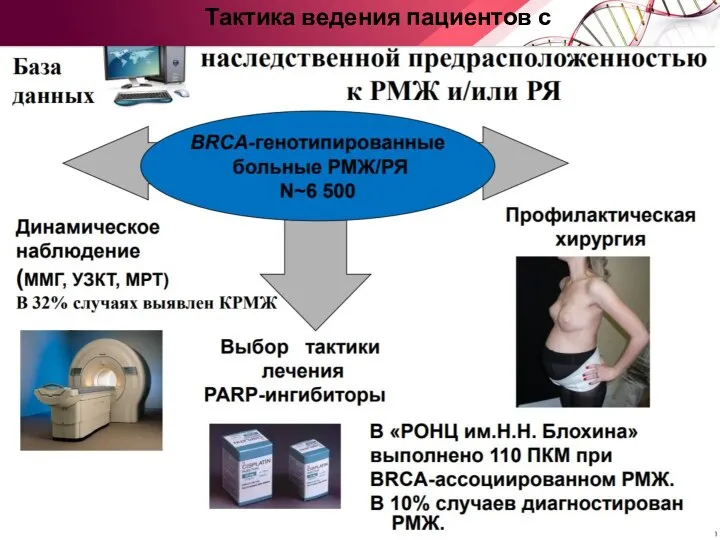
- 77. Тактика ведения пациентов с
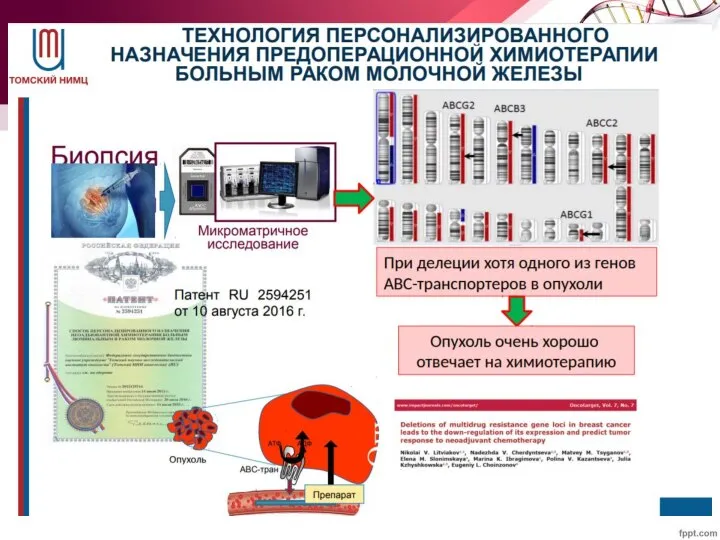
- 79. Наследственный рак предстательной железы
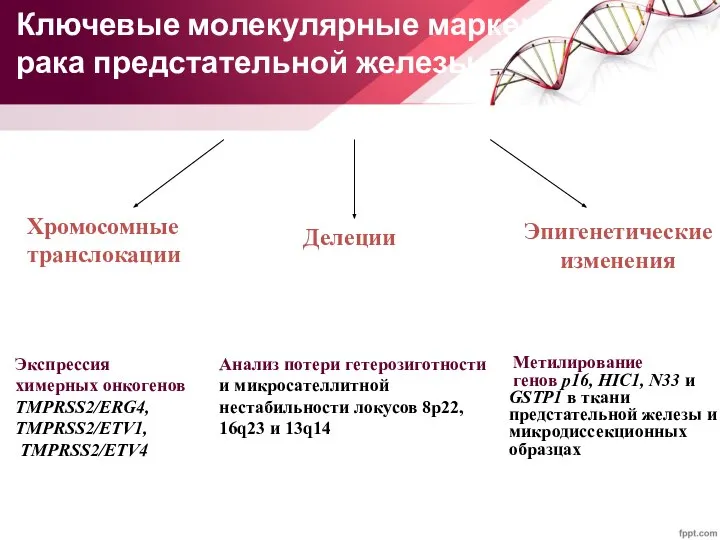
- 80. Ключевые молекулярные маркеры рака предстательной железы Эпигенетические изменения Метилирование генов p16, HIC1, N33 и GSTP1 в
- 84. Скачать презентацию








































 Первичные иммунодефициты
Первичные иммунодефициты Системы регуляции жизнедеятельности
Системы регуляции жизнедеятельности Қан тобын анықтау
Қан тобын анықтау Концентрированные растворы
Концентрированные растворы Классификация методов психологического исследования
Классификация методов психологического исследования Лечебная физкультура при нарушениях осанки
Лечебная физкультура при нарушениях осанки Понятие о психике и ее эволюция
Понятие о психике и ее эволюция Роль медицинской сестры в профилактике инфекций, связанных с оказанием медицинской помощи
Роль медицинской сестры в профилактике инфекций, связанных с оказанием медицинской помощи Нарушения ритма сердца и проводимости
Нарушения ритма сердца и проводимости Врожденные формы автоматического поведения. (3)
Врожденные формы автоматического поведения. (3) ПЦР. Enzymatic amplification of beta-globin genomic sequences
ПЦР. Enzymatic amplification of beta-globin genomic sequences Жедел коронарлы синдромның асқынуы. Ауруханаға дейінгі этапта емдеу алгоритмы
Жедел коронарлы синдромның асқынуы. Ауруханаға дейінгі этапта емдеу алгоритмы Босанудан кейінгі акушерлік қан кету
Босанудан кейінгі акушерлік қан кету Профилактика гриппа и другие ОРВИ
Профилактика гриппа и другие ОРВИ Гигиена дыхания
Гигиена дыхания Слайд-лекция №3. Взаимодействие лекарственных средств
Слайд-лекция №3. Взаимодействие лекарственных средств Анафилактический шок у детей: этиология, патогенез, неотложная помощь, интенсивная терапия
Анафилактический шок у детей: этиология, патогенез, неотложная помощь, интенсивная терапия Профессия ветеринар
Профессия ветеринар Рациональная фармакотерапия острых респираторных вирусных инфекций
Рациональная фармакотерапия острых респираторных вирусных инфекций Что надо знать о коронавирусе
Что надо знать о коронавирусе Индивидуальный подход. Неврозы
Индивидуальный подход. Неврозы Нарушения водно-электролитного баланса, кровотечение
Нарушения водно-электролитного баланса, кровотечение Почечная колика
Почечная колика Язвенная болезнь желудка и двенадцатиперстной кишки
Язвенная болезнь желудка и двенадцатиперстной кишки Миофункциональный подход к профилактике и раннему лечению зубочелюстных аномалий
Миофункциональный подход к профилактике и раннему лечению зубочелюстных аномалий Денсаулық сақтаудағы тағам өнімдері
Денсаулық сақтаудағы тағам өнімдері Результаты мониторинга оказания медицинской помощи пациентам с онкологическими заболеваниями
Результаты мониторинга оказания медицинской помощи пациентам с онкологическими заболеваниями Современные лабораторные маркеры аутоиммунных заболеваний (СКВ, РА, склеродермия, дерматомиозит)
Современные лабораторные маркеры аутоиммунных заболеваний (СКВ, РА, склеродермия, дерматомиозит)