Содержание
- 2. Теоретические вопросы: Обеспечение качества ЛС как международная проблема Современная концепция обеспечения качества ЛС Система обеспечения качества
- 3. Литература : Організація фармацевтичного забезпечення населення: навч. посіб. для студ. вищ. навч. закл. /А.С. Немченко, В.М.
- 4. Обеспечение качества ЛС как международная проблема
- 5. ОБРАЗОВАНИЕ ГОС. РЕГУЛИРОВАНИЕ ВРАЧИ ПРОВИЗОРЫ
- 6. Качество – это совокупность свойств, которые предоставляют ЛС способность удовлетворять нужды потребителей соответственно своему назначению и
- 7. Основные понятия и термины Некачественные (субстандартные) ЛС – ЛС, качество которых не отвечает требованиям нормативных документов.
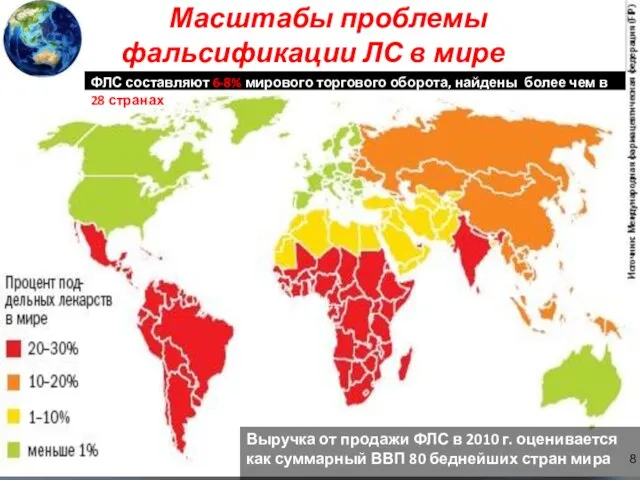
- 8. Масштабы проблемы фальсификации ЛС в мире Выручка от продажи ФЛС в 2010 г. оценивается как суммарный
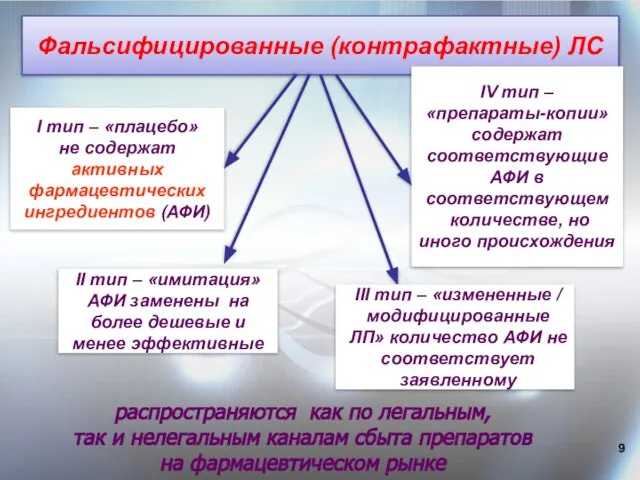
- 9. Фальсифицированные (контрафактные) ЛС І тип – «плацебо» не содержат активных фармацевтических ингредиентов (АФИ) ІV тип –
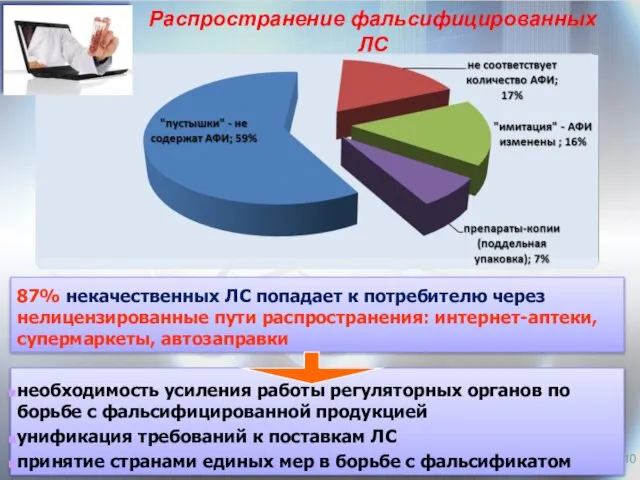
- 10. необходимость усиления работы регуляторных органов по борьбе с фальсифицированной продукцией унификация требований к поставкам ЛС принятие
- 11. Факторы, способствующие фальсификации ЛС
- 12. Программа помощи национальным системам здравоохранения в борьбе с некачественными и фальсифицированными ЛС (ВОЗ, 1995)
- 13. Международная целевая группа противодействия фальсификации медицинской продукции (IMPACT) (создана в 2006 г.) представители более чем 80
- 14. Система сотрудничества по фармацевтическим инспекциям PIC/S Украина является участницей PIC/S с 2011 года Конвенция о взаимном
- 15. PIC/S является соглашением не на уровне правительств, а на уровне регуляторных органов, деятельность которых связана с
- 16. МЕЖДУНАРОДНАЯ СИСТЕМА СОТРУДНИЧЕСТВА ФАРМАЦЕВТИЧЕСКИХ ИНСПЕКЦИЙ PІС/S СТРАНЫ ЕС - ЕДИНОЕ ПРАВОВОЕ ПОЛЕ Межгосударственная комиссия стран СНГ
- 17. В США за подделку лекарств сажают в тюрьму на 15 лет, в Европе – в среднем
- 18. Современная концепция обеспечения качества ЛС
- 19. Обеспечение качества – это концепция, которая охватывает гарантирование качества ЛС, начиная с этапа их разработки и
- 20. Обеспечение качества ЛС
- 21. Надлежащая лабораторная практика (GLP) – совокупность правил и требований к организации процесса и условий планирования, проведения,
- 22. Международная стандартизация проводится на международном уровне, участие в ней открыто для соответствующих органов всех стран; международные
- 23. ISО 9000 - Управление качеством ИСО 9001:2008 -требования к системе менеджмента качества ИСО 9000 - основные
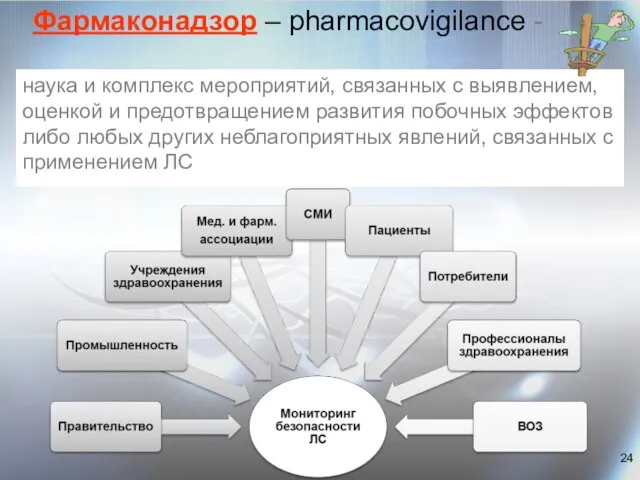
- 24. Фармаконадзор – pharmacovigilance - наука и комплекс мероприятий, связанных с выявлением, оценкой и предотвращением развития побочных
- 25. Международная программа по мониторингу ЛС (WHO Programme on International Drug Monitoring) действует с 1968 г. глобальная
- 26. Система обеспечения качества ЛС в Украине
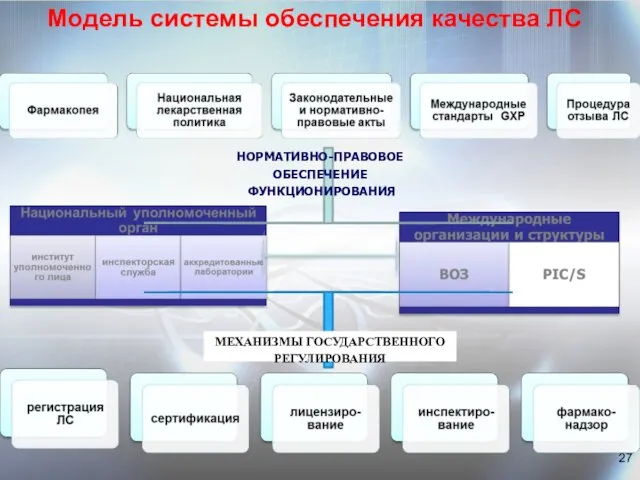
- 27. Модель системы обеспечения качества ЛС НОРМАТИВНО-ПРАВОВОЕ ОБЕСПЕЧЕНИЕ ФУНКЦИОНИРОВАНИЯ МЕХАНИЗМЫ ГОСУДАРСТВЕННОГО РЕГУЛИРОВАНИЯ
- 28. ГП «Государственный экспертный центр» Ряд лабораторий, аккредитованных на проведение государственного контроля качества лекарств Государственная служба Украины
- 29. Организационная структура системы контроля качества ЛС в Украине (продолжение)
- 30. Украина относится ВОЗ к странам с жесткой регуляторной политикой в сфере обращения ЛС, количество фальсифицированных, некачественных,
- 31. Украина – 38-й член Европейской Фармакопеи 16 октября 2012 г. принят ЗАКОН УКРАИНЫ «О присоединении Украины
- 32. в 2011 г. Украина одной из первых подписала Конвенцию Совета Европы о подделке медицинской продукции и
- 33. Лицензирование, регистрация и сертификация как инструменты обеспечения качества ЛС
- 34. Регистрация ЛС
- 35. Минздрав Украины может принять решение о полном или временном запрете применения ЛС в таких случаях:
- 36. В странах ЕС для размещения на рынке ЛС необходимо получить торговую лицензию, которая выдается компетентными уполномоченными
- 37. Сертификация на соответствие GMP и GDP – обязательное условие лицензирования производства и оптовой торговли ЛС в
- 38. Резолюция по применению Системы сертификации ВОЗ (Ассамблея ВОЗ, май 1992 г. WHA 45/29) Меры по сертификации:
- 39. Порядок сертификации ЛС для международной торговли Предполагает получение:
- 40. Обеспечение качества ЛС во время оптовой и розничной торговли
- 41. Теоретические вопросы: Организация входного контроля ЛС. Обязанности Уполномоченного лица Запрет (временный запрет) обращения ЛС Организация инспектирования
- 42. Литература : Організація фармацевтичного забезпечення населення: навч. посіб. для студ. вищ. навч. закл. /А.С. Немченко, В.М.
- 43. Во время оптовой и розничной реализации ЛС и ИМН осуществляется: входной контроль – проводит уполномоченное лицо
- 44. Организация входного контроля ЛС. Обязанности уполномоченного лица
- 45. Уполномоченное лицо (Authorized Person) в аптеках и оптовых фирмах – специалист с высшим фарм. образованием и
- 46. Обязанности Уполномоченного лица проведение входного контроля качества ЛС и оформление вывода (допуск к реализации ЛС); ведение
- 47. Входной контроль ЛС с помощью визуальных методов проверяют: сопроводительные документы, сертификаты качества и анализа, № серии,
- 48. Алгоритм проведения входного контроля
- 49. Запрет (временный запрет) обращения ЛС Приказ МЗ Украины № 809 от 22.11.2011 «Об утверждении Порядка установления
- 50. Государственный контроль качества ЛС К ПОТРЕБИТЕЛЮ НЕ ДОПУЩЕНО 2009 – 230 тыс. упаковок на сумму 0,3
- 51. Классы несоответствий ЛС:
- 52. Действия Гослекслужбы при выявлении некачественных ЛС распоряжение об установлении запрета обращения ЛС информирует владельца рег. удостоверения
- 53. Основания для временного запрета обращения ЛС:
- 54. Основания для установления запрета обращения ЛС:
- 55. Организация инспектирования аптечных учреждений
- 56. Проверки соблюдения лицензиатами Лицензионных условий Приказ МЗУ от 31.10.2011 N 724 «Об утверждении Порядка контроля за
- 57. Объекты проверки учредительные документы; документы, подтверждающие право собственности или пользования помещением; соответствие материально-технической базы; оригинал и
- 58. Современные технологии в обеспечении качества ЛС
- 59. Система отслеживания в обороте лекарственных средств Директива № 2011/62/EU - направлена на предотвращение попадания фальсифицированных ЛС
- 60. Указанные изменения в законодательстве ЕС сделают невозможным обращение фальсифицированных ЛС и потенциально приведут к выталкиванию таких
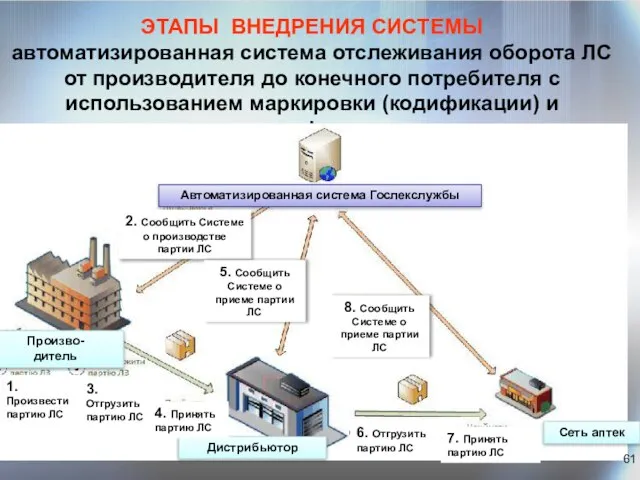
- 61. ЭТАПЫ ВНЕДРЕНИЯ СИСТЕМЫ автоматизированная система отслеживания оборота ЛС от производителя до конечного потребителя с использованием маркировки
- 62. В 2013 г. в Украине стартовал пилотный проект по внедрению индивидуальной маркировки производителем внешней упаковки ЛС,
- 63. Внедрение инновационных технологий в практику аптек
- 64. ЛИЦЕНЗИРОВАНИЕ ИМПОРТА ЛС. ПОРЯДОК ВВОЗА ЛС В УКРАИНУ
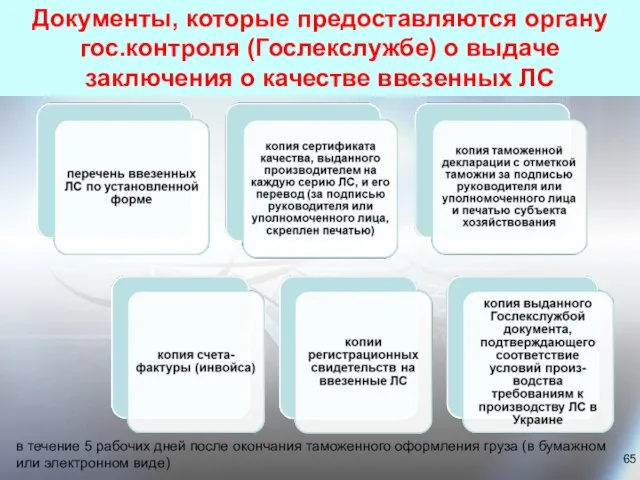
- 65. Документы, которые предоставляются органу гос.контроля (Гослекслужбе) о выдаче заключения о качестве ввезенных ЛС в течение 5
- 66. На время осуществления гос. контроля груз с ЛС размещают отдельно в специально отведенной зоне (помещении) с
- 67. Межведомственная база данных "Лекарственные средства, зарегистрированные в Украине" содержит сведения о зарегистрированных в Украине ЛС, ведется
- 68. Проведение внутриаптечных видов контроля качества экстемпоральных ЛС (для самостоятельного изучения)
- 69. Совокупность правил по розничной торговле ЛС, их хранению, контролю качества, изготовлению в условиях аптеки, отпуска, соблюдение
- 70. ТЕСТ № 2 Кто отвечает за проведение входного контроля качества в аптеке? А) заведующий аптекой Б)
- 71. ТЕСТ № 3 Какой стаж трудовой деятельности должен быть у уполномоченного лица, отвечающего за входной контроль
- 73. Скачать презентацию































































 Химия в медицине
Химия в медицине Особенности первичной позитивной профилактики аддиктивного поведения в образовательных учреждениях
Особенности первичной позитивной профилактики аддиктивного поведения в образовательных учреждениях Синдром желтухи у детей
Синдром желтухи у детей Пневмония
Пневмония Научные исследования в здравоохранении
Научные исследования в здравоохранении Ауыз қуысы гигиенасының негізгі құралдары Тіс щеткалары
Ауыз қуысы гигиенасының негізгі құралдары Тіс щеткалары Жүрек-өкпе реанимациясы. Мәйітпен жұмыс жасау ережелері
Жүрек-өкпе реанимациясы. Мәйітпен жұмыс жасау ережелері גישה למטופלת צעירה עם שלפוחית שתן רגיזה
גישה למטופלת צעירה עם שלפוחית שתן רגיזה Социальная работа в условиях модернизации российского общества
Социальная работа в условиях модернизации российского общества L-HOPITAL
L-HOPITAL Сестринский процесс при заболеваниях и повреждениях брюшной полости
Сестринский процесс при заболеваниях и повреждениях брюшной полости Неотложные состояния требующие немедленного медицинского вмешательства
Неотложные состояния требующие немедленного медицинского вмешательства Качественная полноценность пищевого рациона. Макронутриентный состав пищи
Качественная полноценность пищевого рациона. Макронутриентный состав пищи Особенности патологии организма в пожилом и старческом возрасте
Особенности патологии организма в пожилом и старческом возрасте Мітохондріальні хвороби. Загальна характеристика мітохондріальної патології. Клініка, діагностика, лікування
Мітохондріальні хвороби. Загальна характеристика мітохондріальної патології. Клініка, діагностика, лікування Вегетативна нервова система. Синдроми ураження різних відділів вегетативної нервової системи
Вегетативна нервова система. Синдроми ураження різних відділів вегетативної нервової системи Страх, как социальное явление
Страх, как социальное явление Применение иммуномодулятора Галавит в онкологической практике
Применение иммуномодулятора Галавит в онкологической практике Мәдениеттану мен медицинаның байланысы
Мәдениеттану мен медицинаның байланысы Микрохирургиялық эндодонтия. Түбір өзектерін термопластикалы иньекциялы техникамен обтурациялау
Микрохирургиялық эндодонтия. Түбір өзектерін термопластикалы иньекциялы техникамен обтурациялау Причины и механизмы развитие иммунодефицитных состояний у сельскохозяйственных животных
Причины и механизмы развитие иммунодефицитных состояний у сельскохозяйственных животных Переломы бедренной кости и их лечение
Переломы бедренной кости и их лечение Плазменные факторы свертывания крови (плазменные прокоагулянты). Геморрагические диатезы
Плазменные факторы свертывания крови (плазменные прокоагулянты). Геморрагические диатезы Грип
Грип Электрокардиография (часть 1)
Электрокардиография (часть 1) Роль глюкагоноподобного пептида 1 (GLP-1) в лечении наркозависимости
Роль глюкагоноподобного пептида 1 (GLP-1) в лечении наркозависимости AGREE құралымен, БМСК қолданылуындағы БКХ бағасы
AGREE құралымен, БМСК қолданылуындағы БКХ бағасы Мутационная изменчивость. Предупреждение наследственных болезней человека
Мутационная изменчивость. Предупреждение наследственных болезней человека