Содержание
- 2. Хронический миелолейкоз – 40-80% Острый нелимфобластный лейкоз - 40-70% Острый лимфобластный лейкоз - 40-80% Апластическая анемия
- 3. Ближайшие перспективы применения стволовых клеток Рассеянный склероз Болезнь Паркинсона Повреждение головного и спинного мозга Инсульт Болезнь
- 4. Этапы развития науки о стволовых клетках и клеточной терапии 1908 Александр Максимов предлагает концепцию стволовой клетки
- 5. 1970-е Первая аутологичная трансплантация костного мозга больному лимфомой 1980-е Первая трансплантация стволовых клеток, полученных из периферической
- 6. 2000-е - дифференцированное применение различных видов стволовых клеток (гемопоэтических, мезенхимных, предшественников эндотелиоцитов/ангиобластов); использование генотерапии
- 7. Стволовые клетки – клетки, способные к самообновлению (самоподдержанию) и дифференцировке в один или более типов зрелых
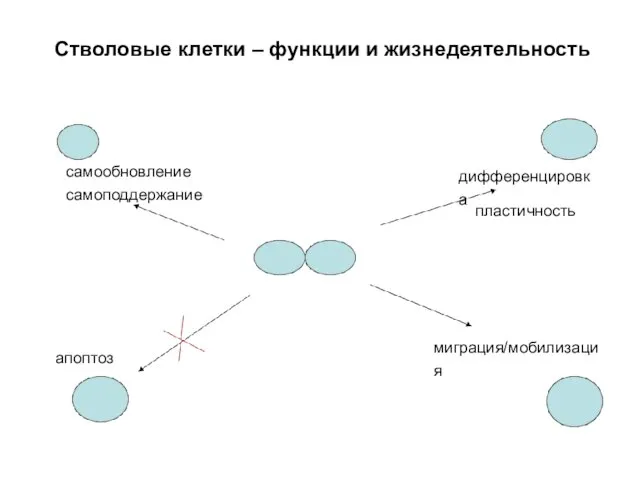
- 8. Стволовые клетки – функции и жизнедеятельность самообновление самоподдержание дифференцировка миграция/мобилизация апоптоз пластичность
- 9. Тотипотентные стволовые клетки Плюрипотентные стволовые клетки Полипотентные стволовые клетки Унипотентные стволовые клетки
- 10. Тотипотентные стволовые клетки источник – бластоциста, которая формируется к 5 дню оплодотворения способны дифференцироваться во все
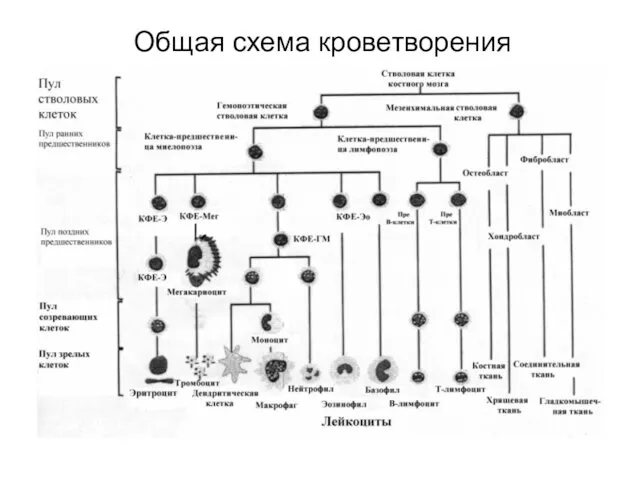
- 11. Общая схема кроветворения
- 12. ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ КОСТНЫЙ МОЗГ гемопоэтические стволовые клетки мезенхимные стволовые клетки эндотелиальные предшественники ПЕРИФЕРИЧЕСКАЯ КРОВЬ -гемопоэтические
- 13. В клинической практике используются: Неселективные СК КМ Неселективные СК ПК (мобилизация СК ростовыми факторами) Селективные СК
- 14. Иммунофенотип стволовых клеток. Иммуноселекция Гемопоэтические стволовые клетки (CD133+, CD34+, CD45+ ) Мезенхимные стволовые клетки ( CD105+,
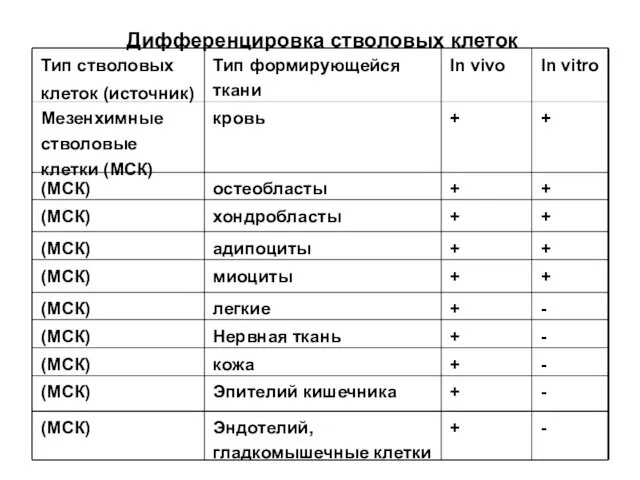
- 15. Дифференцировка стволовых клеток Тип стволовых клеток (источник) Тип формирующейся ткани In vivo In vitro ГСК Костный
- 16. Дифференцировка стволовых клеток Тип стволовых клеток (источник) Тип формирующейся ткани In vivo In vitro ГСК ПК
- 17. Дифференцировка стволовых клеток Тип стволовых клеток (источник) Тип формирующейся ткани In vivo In vitro Мезенхимные стволовые
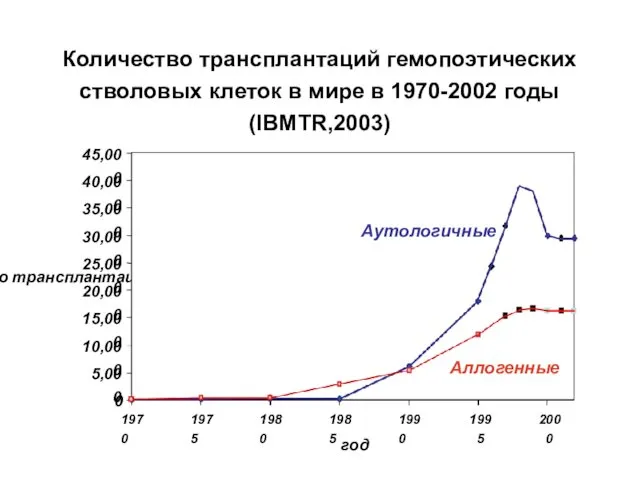
- 18. Количество трансплантаций гемопоэтических стволовых клеток в мире в 1970-2002 годы (IBMTR,2003) число трансплантаций год 1970 1975
- 19. 1). ТРАНСПЛАНТАЦИЯ АЛЛОГЕННЫХ СТВОЛОВЫХ КЛЕТОК - Трансплантация аллогенного костного мозга - Трансплантация аллогенных периферических стволовых клеток
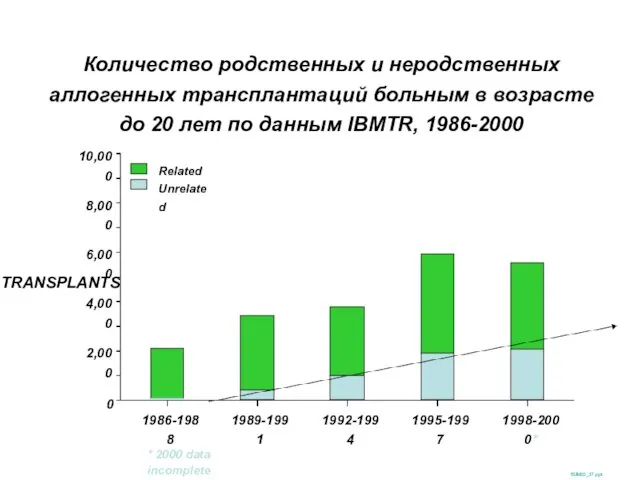
- 20. Количество родственных и неродственных аллогенных трансплантаций больным в возрасте до 20 лет по данным IBMTR, 1986-2000
- 21. Трансплантация ex vivo модифицированных клеток находит клиническое применение при решении следующих задач: культивирование аутологичных стволовых клеток
- 22. Трансплантация аллогенных стволовых клеток используется для Замещения дефектного гемопоэза после высокодозной химио/лучевой терапии онкогематологических заболеваний Замещения
- 23. Методология аллогенной трансплантации гемопоэтических стволовых клеток Основные этапы выполнения аллогенной трансплантации стволовых клеток крови или костного
- 24. Предтрансплантационная подготовка больного к аллогенной трансплантации стволовых клеток Достижение полной клинико-гематологической ремиссии при острых лейкозах Достижение
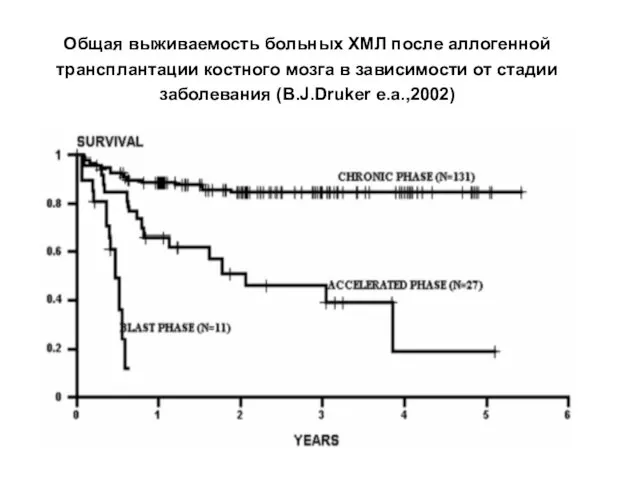
- 25. Общая выживаемость больных ХМЛ после аллогенной трансплантации костного мозга в зависимости от стадии заболевания (B.J.Druker e.a.,2002)
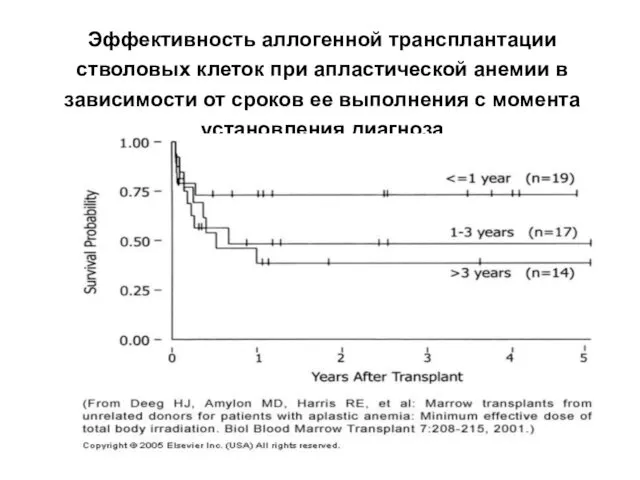
- 26. Эффективность аллогенной трансплантации стволовых клеток при апластической анемии в зависимости от сроков ее выполнения с момента
- 27. Подбор/поиск HLA-совместимого донора Этапность подбора донора Этапность обследования HLA-совместимый сиблинг или донор-родственник HLA-совместимый неродственный донор (запрос
- 28. Заготовка клеток пуповинной крови не менее 3х107/кг веса больного мононуклеарных клеток, не менее 1,2 х 105/кг
- 29. Обязательным компонентом трансплантации аллогенных гемопоэтических клеток является проведение химиолучевой подготовки или кондиционирования больного к трансплантации, обеспечивающего
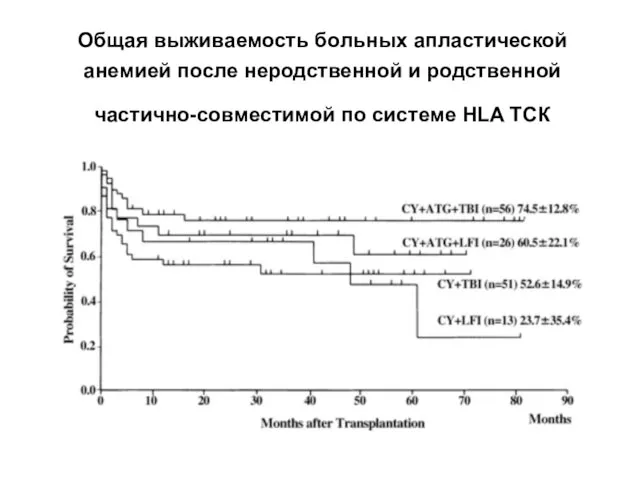
- 32. Общая выживаемость больных апластической анемией после неродственной и родственной частично-совместимой по системе HLA ТСК
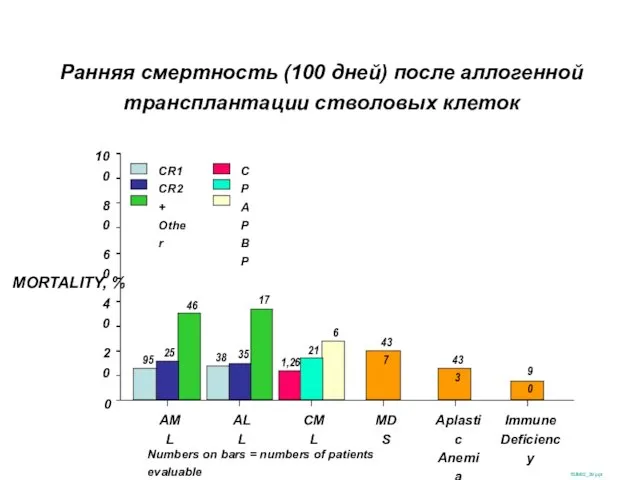
- 33. Ранняя смертность (100 дней) после аллогенной трансплантации стволовых клеток SUM02_39.ppt MORTALITY, % 100 0 20 40
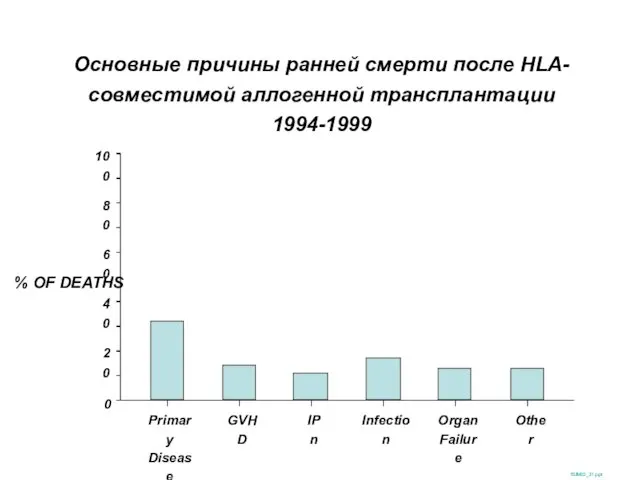
- 34. Основные причины ранней смерти после HLA-совместимой аллогенной трансплантации 1994-1999 SUM02_31.ppt % OF DEATHS 100 0 20
- 35. Профилактика РТПХ циклоспорин А 3-12,5 мг/кг с -1 дня до +100-й день с уменьшением дозы на
- 36. Профилактика токсических и инфекционных осложнений Форсированный диурез Аллопуринол Дифенин Гепарин Деконтаминация кишечника Ацикловир (ганцикловир) Бисептол Флуконазол
- 37. Оценка приживления донорских стволовых стволовых клеток Гематологические показатели Цитогенетическое исследование Молекулярно-генетическое исследование (ПЦР, VNTR локусы, аллельный
- 38. Ранние осложнения аллогенной трансплантации стволовых клеток Острая реакция трансплантат против хозяина Геморрагический цистит Венооклюзионная болезнь печени
- 40. Поздние осложнения аллогенной трансплантации стволовых клеток Хроническая РТПХ Инфекционные осложнения Фиброз легких Эндокринная недостаточность Катаракта Отставание
- 41. Аутологичная трансплантация гемопоэтических стволовых клеток выполняется с целью восстановления гемопоэза после применения сублетальных доз лучевой и/или
- 42. цитотоксичность Чувствительность опухолевых и гемопоэтических клеток к химиотерапии Опухолевые клетки Гемопоэтические клетки Доза химиопрепарата
- 43. Методология аутологичной трансплантации гемопоэтических стволовых клеток Основные этапы выполнения аутологичной трансплантации стволовых клеток крови или костного
- 44. Причины смерти после аутологичной трансплантации стволовых клеток 1994-1999 SUM02_32.ppt % OF DEATHS 100 0 20 40
- 46. выживаемость, % 100 0 20 40 60 80 0 годы SUM02_4.ppt P = 0.0001 HLA-identical sibling,
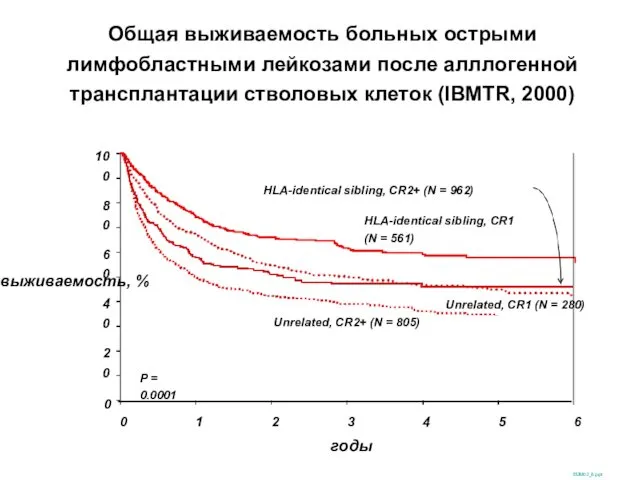
- 47. Общая выживаемость больных острыми лимфобластными лейкозами после алллогенной трансплантации стволовых клеток (IBMTR, 2000) выживаемость, % 100
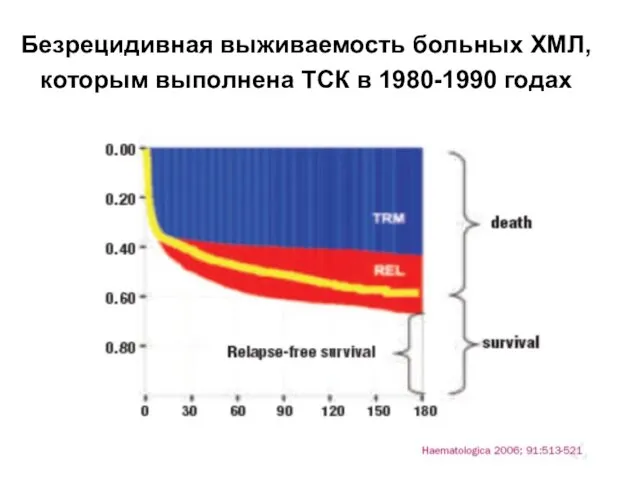
- 49. Безрецидивная выживаемость больных ХМЛ, которым выполнена ТСК в 1980-1990 годах
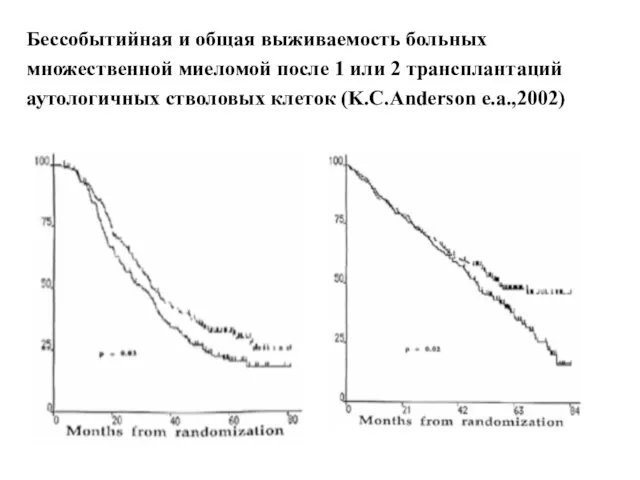
- 50. Бессобытийная и общая выживаемость больных множественной миеломой после 1 или 2 трансплантаций аутологичных стволовых клеток (K.C.Anderson
- 51. Эффективность трансплантации гемопоэтических стволовых клеток от HLA-совместимого донора родственника у больных апластической анемией
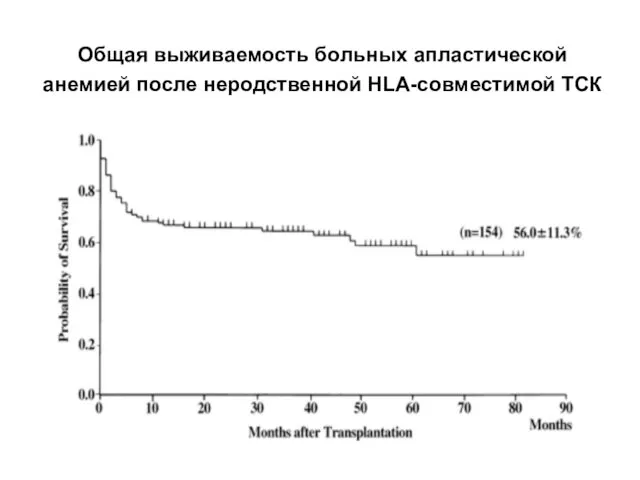
- 52. Общая выживаемость больных апластической анемией после неродственной HLA-совместимой ТСК
- 53. Концептуальная основа для трансплантации стволовых клеток при аутоиммунных заболеваниях Эрадикация иммунных эффекторов Восстановление нормальной функции системы
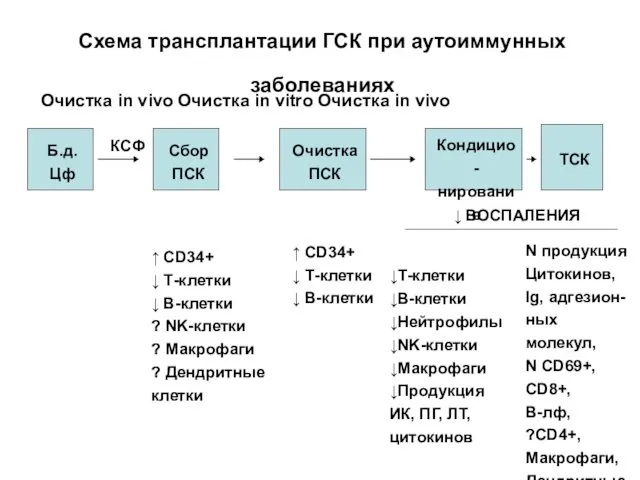
- 54. Схема трансплантации ГСК при аутоиммунных заболеваниях Очистка in vivo Очистка in vitro Очистка in vivo Б.д.
- 55. Эффективность трансплантации ГСК при аутоиммунных заболеваниях ( EBMT ) Заболевание TRM Эффект/DPFS Рассеянный склероз 6% (0-12%)
- 56. Трансплантация стволовых клеток в лечении сахарного диабета Трансплантация аутологичных стволовых клеток для лечения впервые выявленного (6
- 57. Использование стволовых клеток у экспериментальных животных в ранний постинфарктный период снижает не только выраженность зон повреждения,
- 58. Потенцильные возможности терапии ГСК в кардиологии Дифференцировка в кардиомиоциты Ангиогенез Ишемическая болезнь сердца ОИМ стенокардия высокого
- 59. Доказательство возможности образования кардиомиоцитов из циркулирующих стволовых клеток FISH визуализация Y хромосомы в кардиомиоцитах (меченных MF20
- 60. Методы введения стволовых клеток в/в введение интракоронарное введение при коронароангиографии интрамиокардиальное катетерное введение со стороны ЛЖ
- 61. Возможные эффекты введения стволовых клеток у больных ИБС Снижение функционального класса стенокардии Увеличение толерантности к физической
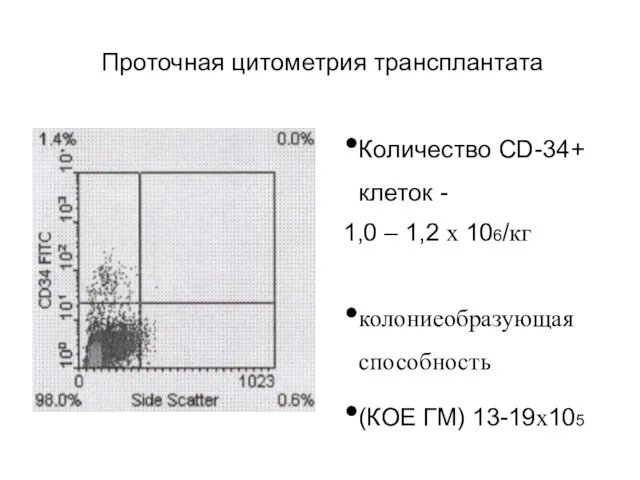
- 62. Проточная цитометрия трансплантата Количество CD-34+ клеток - 1,0 – 1,2 х 106/кг колониеобразующая способность (КОЕ ГМ)
- 64. Скачать презентацию













































 Виды заболеваний. Фенилпировиноградная олигофрения
Виды заболеваний. Фенилпировиноградная олигофрения Волчья пасть и заячья губа
Волчья пасть и заячья губа Сестринский уход за пациентами с хирургической инфекцией
Сестринский уход за пациентами с хирургической инфекцией Факторы неспецифической и специфической защиты организма. Понятие об антигенах и антителах. Иммунокомпетентные клетки
Факторы неспецифической и специфической защиты организма. Понятие об антигенах и антителах. Иммунокомпетентные клетки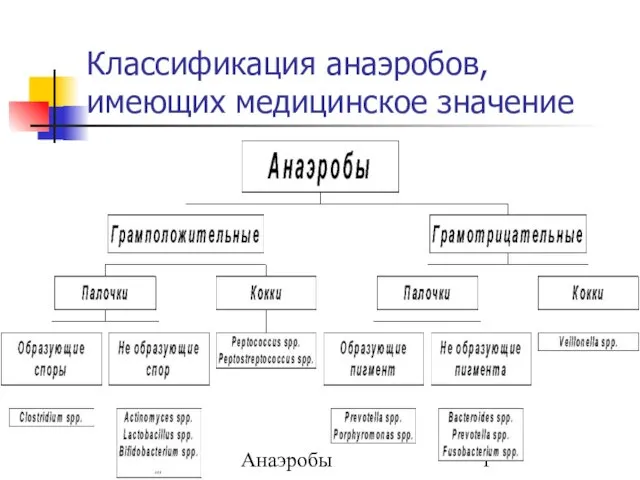 Классификация анаэробов, имеющих медицинское значение
Классификация анаэробов, имеющих медицинское значение В-блокаторы
В-блокаторы 10 Алгоритм проведения текущей уборки
10 Алгоритм проведения текущей уборки Бронхоальвеолярный лаваж
Бронхоальвеолярный лаваж Гемостаз. Понятия гемостаз, система регуляции агрегатного состояния крови
Гемостаз. Понятия гемостаз, система регуляции агрегатного состояния крови Онтогенез. Возрастная периодизация. Лекция 3
Онтогенез. Возрастная периодизация. Лекция 3 الشائعة التي تستخدم في قياس الظاهرة السيكولوجية التي
الشائعة التي تستخدم في قياس الظاهرة السيكولوجية التي Дифференциальная психофизиология (часть 2)
Дифференциальная психофизиология (часть 2) Тромбоз мезентериальных сосудов
Тромбоз мезентериальных сосудов Как информационные технологии помогают в подборе и контроле терапии гемофилии А
Как информационные технологии помогают в подборе и контроле терапии гемофилии А Дифференциальная диагностика гемоколитов у детей
Дифференциальная диагностика гемоколитов у детей Методы психолого-педагогической диагностики семьи
Методы психолого-педагогической диагностики семьи Рентгенография органов грудной клетки при пневмонии
Рентгенография органов грудной клетки при пневмонии Контроль диабета при беременности
Контроль диабета при беременности Оказание паллиативной медицинской помощи, в части назначения, выписки и обеспечения обезболивающими средствами
Оказание паллиативной медицинской помощи, в части назначения, выписки и обеспечения обезболивающими средствами Клещевой энцефалит
Клещевой энцефалит Описание локального статуса травматологического больного
Описание локального статуса травматологического больного Көз алмасын қозғалтатын бұлшық еттер анатомиясы. IV жұп нервтер
Көз алмасын қозғалтатын бұлшық еттер анатомиясы. IV жұп нервтер Эмбриология. Мужские и женские половые клетки. Сперматогенез. (Модуль 4)
Эмбриология. Мужские и женские половые клетки. Сперматогенез. (Модуль 4) Острая сосудистая недостаточность,
Острая сосудистая недостаточность, Жүктілік физиологиясы
Жүктілік физиологиясы Анализаторы. Кодирование информации
Анализаторы. Кодирование информации Сүйек-буын туберкулезі
Сүйек-буын туберкулезі Аутоиммунные энцефалиты: определение, классификации, принципы лечения
Аутоиммунные энцефалиты: определение, классификации, принципы лечения