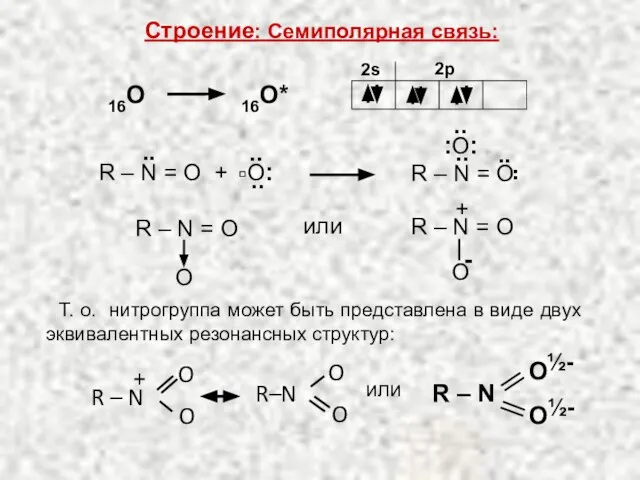
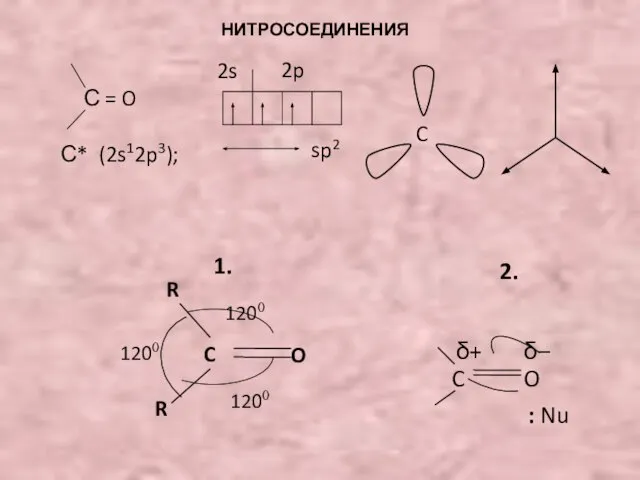
НИТРОСОЕДИНЕНИЯ R–NO 2 Строение: Семиполярная связь: N … 2s 2 2p 3 14 O … 2s 2 2p 4 16 2s 2p R – N = O.. 7 8 2s 2p. - презентация
Содержание
- 2. 16O* 16O 2s 2p или R – N = O O + R – N =
- 3. НИТРОСОЕДИНЕНИЯ. Т. кип. (CH3NO2) = 101˚C Т. кип. (CH3COCH3) = 56˚C Нитросоединения термодинамически неустойчивы: CH3NO2 1/2
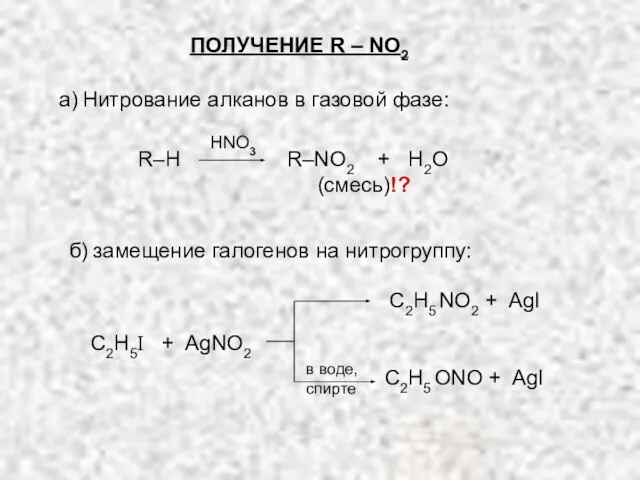
- 4. ПОЛУЧЕНИЕ R – NO2 (смесь)!? R–H R–NO2 + H2O С2Н5I + AgNO2 С2Н5 NO2 + AgI
- 5. ХИМИЧЕСКИЕ СВОЙСТВА НИТРОСОЕДИНЕНИЙ 1. Восстановление до аминов (для Ar – NH2). 2. Очень важны реакции по
- 6. OH- CH2–N O O O O CH2=N O O CH2–N - .. H α H+ H+
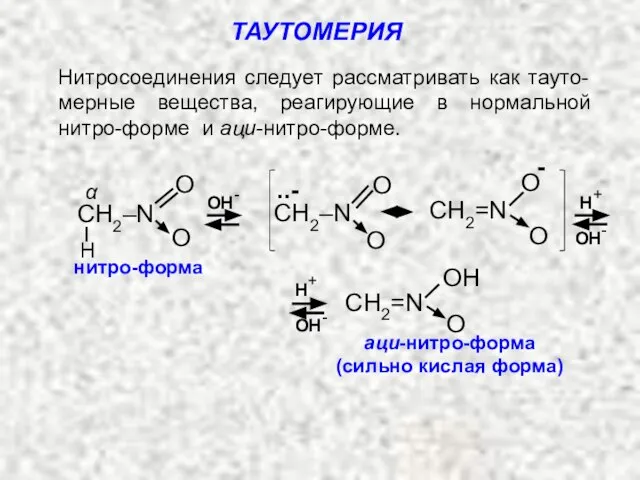
- 7. В растворе нормальные первичные и вторичные нитроалканы находятся в равновесии с аци-нитро-формой. Равновесие между обеими формами
- 8. б). При разложении натриевой соли аци-нитросоединения избытком холодной минераль-ной кислоты (раствор соли вливают в кислоту) образуются
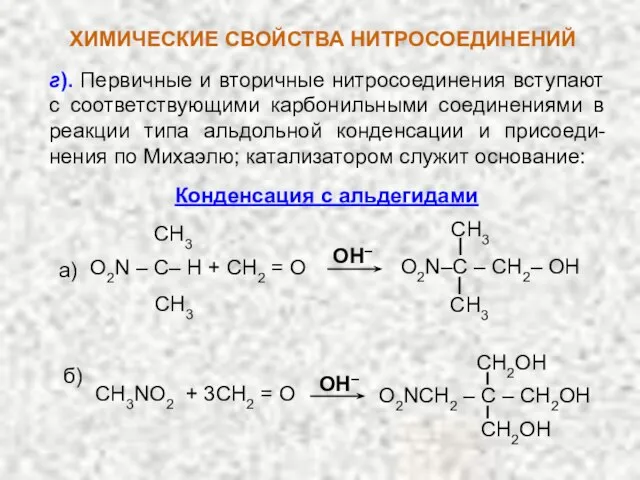
- 9. г). Первичные и вторичные нитросоединения вступают с соответствующими карбонильными соединениями в реакции типа альдольной конденсации и
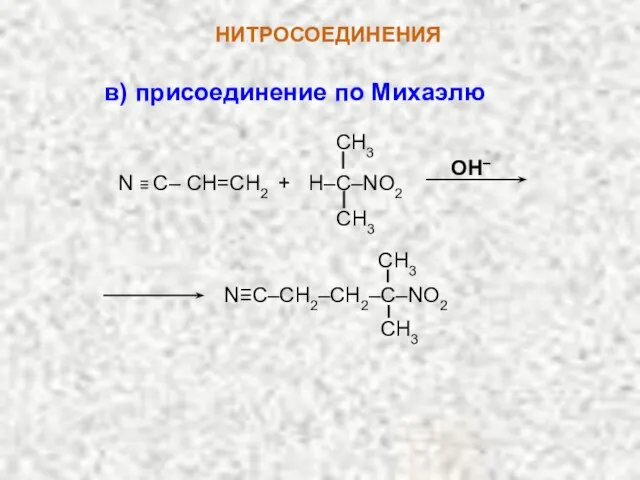
- 10. НИТРОСОЕДИНЕНИЯ OH– N ≡ C– CH=СН2 + H–C–NO2 CH3 CH3 N≡C–CH2–CH2–C–NO2 CH3 CH3 в) присоединение по
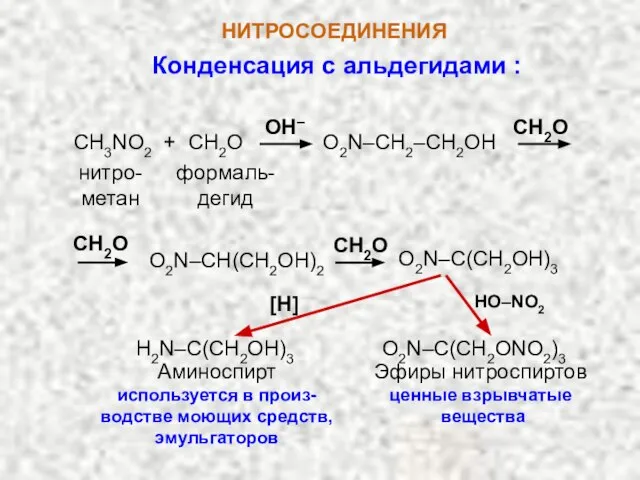
- 11. НИТРОСОЕДИНЕНИЯ Конденсация с альдегидами : CH3NO2 + CH2O O2N–CH2–CH2OH CH2O нитро-метан формаль- дегид O2N–CH(CH2OH)2 O2N–C(CH2OH)3 CH2O
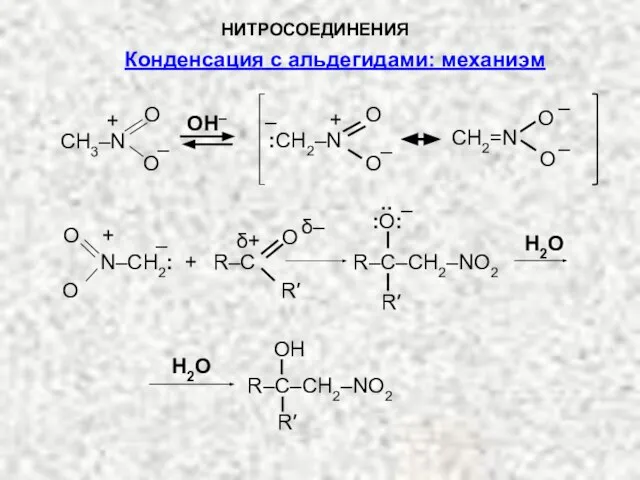
- 12. НИТРОСОЕДИНЕНИЯ CH3–N O O + – OH– O O – CH2=N – O O – :CH2–N
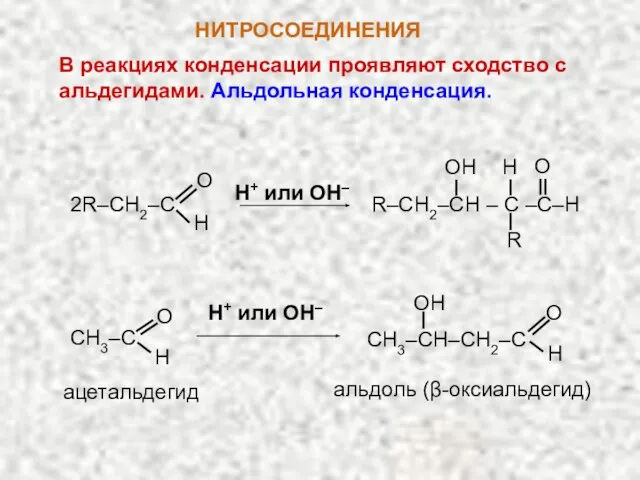
- 13. НИТРОСОЕДИНЕНИЯ В реакциях конденсации проявляют сходство с альдегидами. Альдольная конденсация. 2R–CH2–C O H R–CH2–CH – C
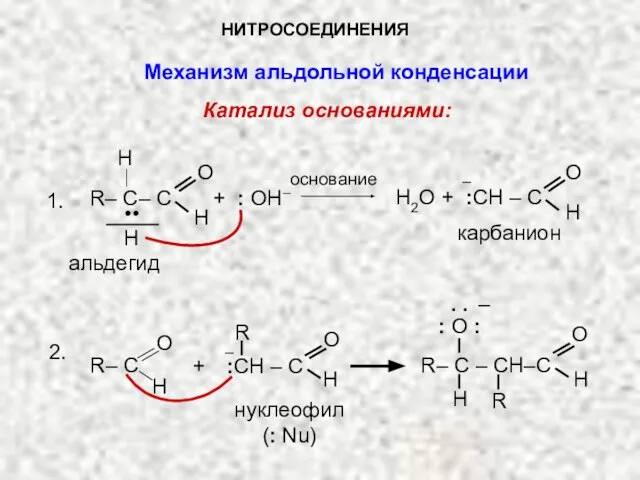
- 14. НИТРОСОЕДИНЕНИЯ Механизм альдольной конденсации Катализ основаниями: основание R– C– C O H .. + : OH–
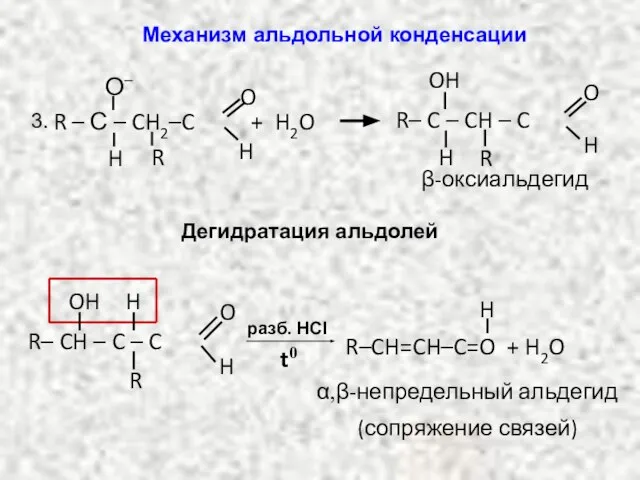
- 15. β-оксиальдегид R – С – CH2–C O H H О– R + H2O R– C –
- 16. НИТРОСОЕДИНЕНИЯ
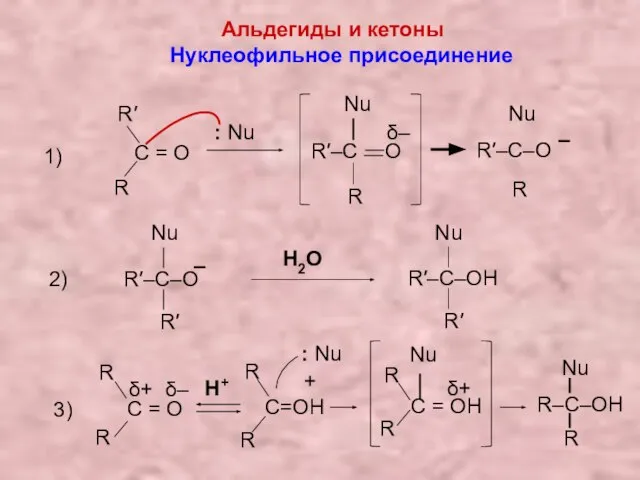
- 17. Альдегиды и кетоны Нуклеофильное присоединение 1) C = О R R′ R′–C O δ– – R′–C–O
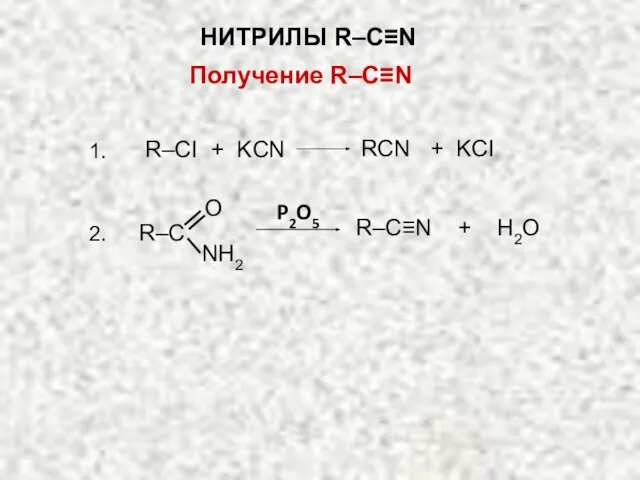
- 18. Получение R–C≡N R–CI + KCN RCN + KCI 1. O R–C NH2 P2O5 R–C≡N + H2O
- 19. 2. Востановливаются водородом до первичных аминов H2 / Ni R–NH2 R–C ≡ N Свойства R–C≡N Т
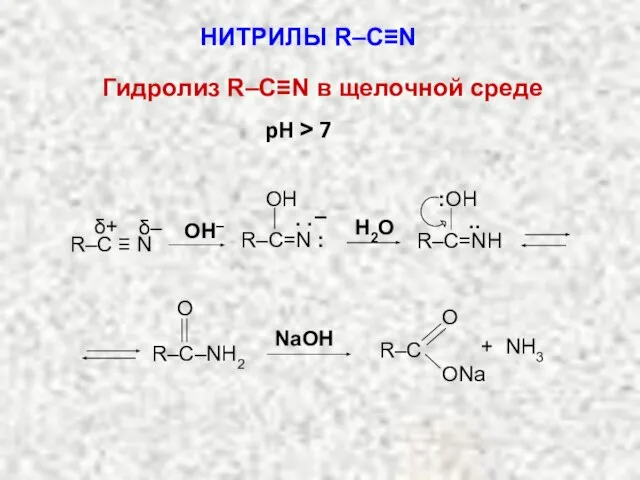
- 20. НИТРИЛЫ R–C≡N Гидролиз R–C≡N в щелочной среде R–C=N : OH . . – R–C=NН .. :OH
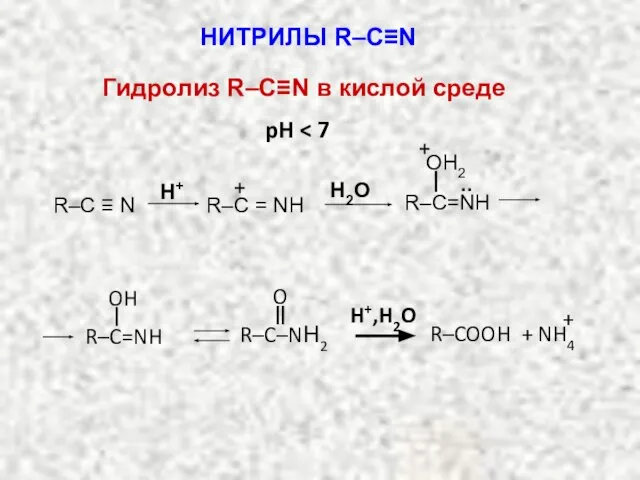
- 21. pH H2O R–C ≡ N H+ R–C = NН + R–C=NН .. OH2 + R–C=NH OH
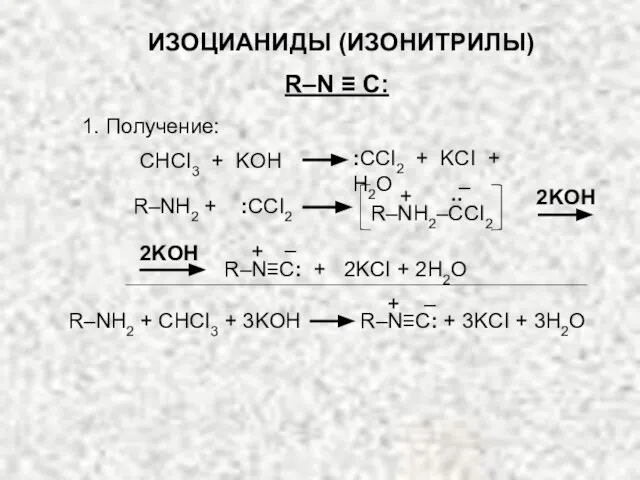
- 22. ИЗОЦИАНИДЫ (ИЗОНИТРИЛЫ) R–N ≡ C: 1. Получение: R–N≡C: + 2KCI + 2H2O 2KOH + – CHCI3
- 23. Свойства R–N≡C 1. Изонитрилы кипят при несколько меньшей температуре, чем R–C≡N 2. Гидролизуются только в кислой
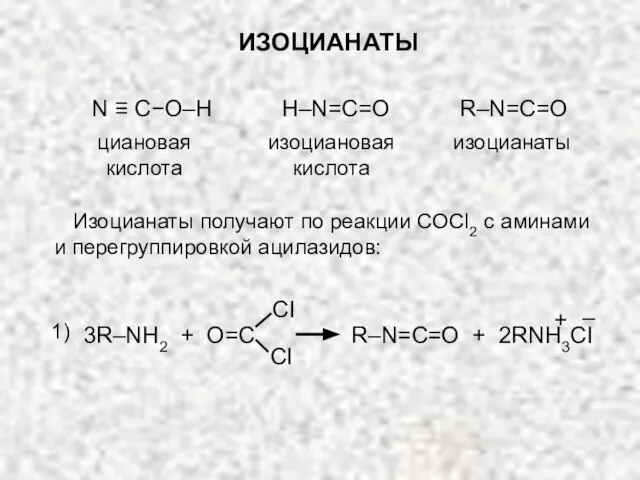
- 24. ИЗОЦИАНАТЫ циановая кислота N ≡ C−O–H H–N=C=O изоциановая кислота изоцианаты R–N=C=O Изоцианаты получают по реакции COCl2
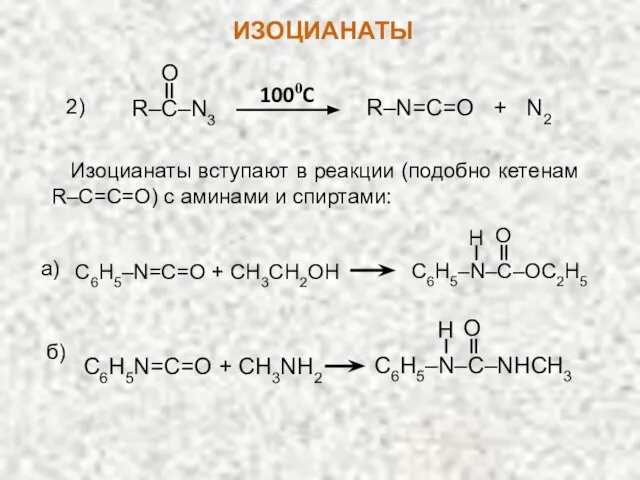
- 25. R–C–N3 O R–N=C=O + N2 1000C 2) Изоцианаты вступают в реакции (подобно кетенам R–С=C=O) с аминами
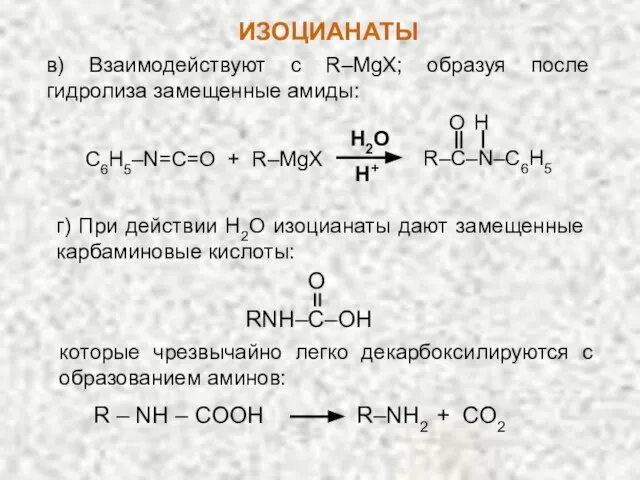
- 26. в) Взаимодействуют с R–MgX; образуя после гидролиза замещенные амиды: C6H5–N=C=O + R–MgX R–C–N–C6H5 H O H2O
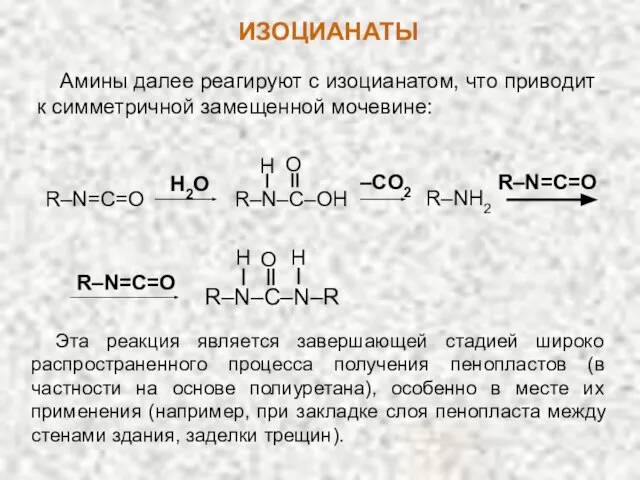
- 27. Амины далее реагируют с изоцианатом, что приводит к симметричной замещенной мочевине: R–NH2 R–N–C–OH H O R–N=C=O
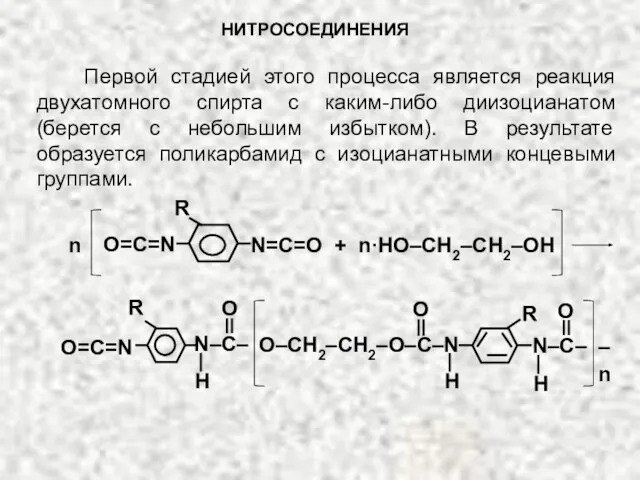
- 28. НИТРОСОЕДИНЕНИЯ Первой стадией этого процесса является реакция двухатомного спирта с каким-либо диизоцианатом (берется с небольшим избытком).
- 30. Скачать презентацию






 Forming of political world map
Forming of political world map Последние реализованные задачи и планы ЮТС по проектам
Последние реализованные задачи и планы ЮТС по проектам Положительные стороны занятий в секции спортивного ориентирования
Положительные стороны занятий в секции спортивного ориентирования Методическая разработка «Адаптивная физическая культура»
Методическая разработка «Адаптивная физическая культура» Расчет на прочность. (Лекция 6)
Расчет на прочность. (Лекция 6) Модуль1.
Модуль1.  ОРГАНІЗАЦІЯ ВИРОБНИЦТВА
ОРГАНІЗАЦІЯ ВИРОБНИЦТВА Архитектура Web-баз данных. Лекция 3.19
Архитектура Web-баз данных. Лекция 3.19 Лидеры и элиты в политической жизни
Лидеры и элиты в политической жизни Пересечение поверхности плоскостью
Пересечение поверхности плоскостью Этап «выявление потребностей»
Этап «выявление потребностей» Лисичка-сестричка и серый волк - презентация для начальной школы
Лисичка-сестричка и серый волк - презентация для начальной школы КПД двигателей внутреннего сгорания
КПД двигателей внутреннего сгорания Как корабль назовёшь, так он и полетит
Как корабль назовёшь, так он и полетит Библейская теология работы и устойчивости
Библейская теология работы и устойчивости Проективный метод в психодиагностике
Проективный метод в психодиагностике Банковское дело
Банковское дело Корейский буддизм в колониальный период
Корейский буддизм в колониальный период Карловы Вары
Карловы Вары Поверхности
Поверхности  УВВ
УВВ Новый год и Рождество
Новый год и Рождество Выполнили Галибина Л. и Кошарный И. Т-114
Выполнили Галибина Л. и Кошарный И. Т-114  Effects of sanctions on Russia & the European Union
Effects of sanctions on Russia & the European Union Средства создания презентаций MS PowerPoint
Средства создания презентаций MS PowerPoint МОУ средняя общеобразовательная школа №9 г. Искитима Новосибирской области Научно-исследовательская работа по теме «В школу с у
МОУ средняя общеобразовательная школа №9 г. Искитима Новосибирской области Научно-исследовательская работа по теме «В школу с у Теракт в метро Санкт- Петербург
Теракт в метро Санкт- Петербург Микропроцессорная техника
Микропроцессорная техника