АЛКИНЫ Углеводороды, содержащие тройную углерод –углерод- ную связь СС называются алкинами. Общая формула алкинов: С n H 2n-2 Структу
Содержание
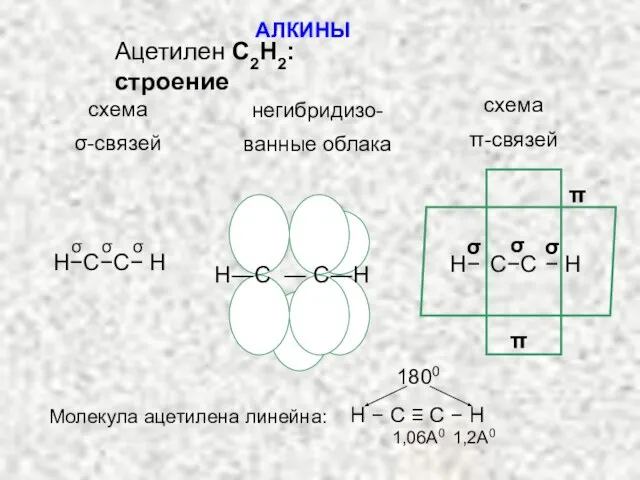
- 2. АЛКИНЫ Ацетилен С2H2: строение схема σ-связей негибридизо- ванные облака схема π-связей σ σ σ H−C−C− H
- 3. ПОЛУЧЕНИЕ АЛКИНОВ Промышленные способы получения ацетилена: 1. Из природного газа при крекинге нефти: 2CH4 C2H2 +
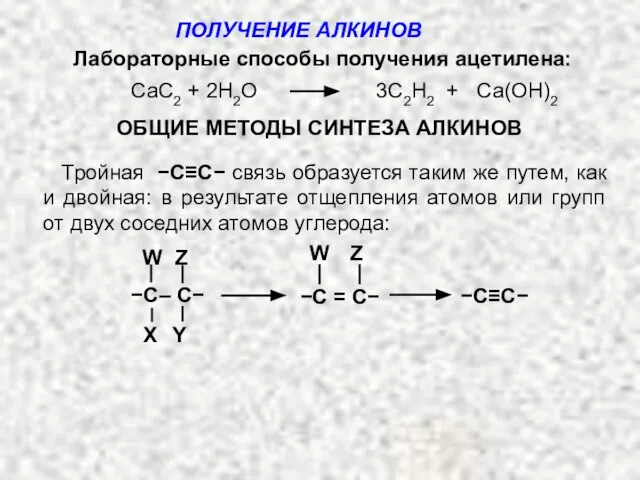
- 4. Лабораторные способы получения ацетилена: CaC2 + 2H2O 3C2H2 + Са(ОH)2 ОБЩИЕ МЕТОДЫ СИНТЕЗА АЛКИНОВ Тройная −С≡С−
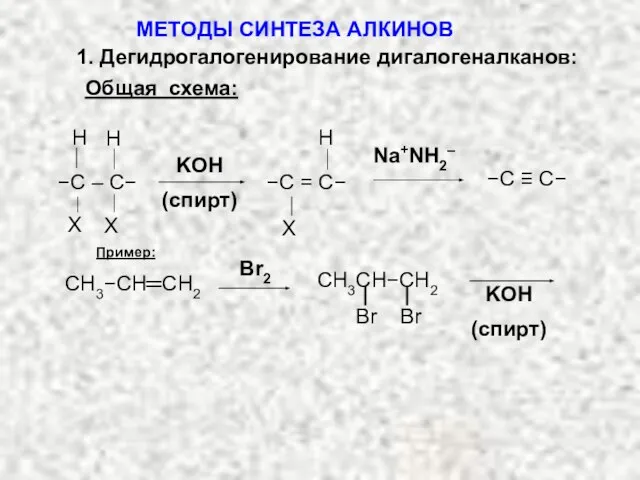
- 5. 1. Дегидрогалогенирование дигалогеналканов: Общая схема: Пример: Br2 KOH (спирт) Br Br CH3CH−CH2 СH3−CH═CH2 МЕТОДЫ СИНТЕЗА АЛКИНОВ
- 6. NaNH2 пропин СH3CH═CH Br CH3−C≡CH Na+NH2- или Na −C≡CR + Na+X– RX −C≡C–:Na+ −С≡СH (R-первичный алкил;
- 7. Пример: CH≡C−Na + CH3I CH≡C−CH3 + NaI ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ Напоминают алкены и алканы: низшие алкины
- 8. Для алкинов характерны две группы реакций: 1. Реакции электрофильного присоединения. 2. Реакции, обусловленные кислотностью водород- ного
- 9. 1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ Алкины, как и алкены, вступают в реакции электрофильного присоединения, т.к. у них
- 10. Механизм присоединения такой же как для алкенов самый, но каждая тройная связь может присоединить две молекулы
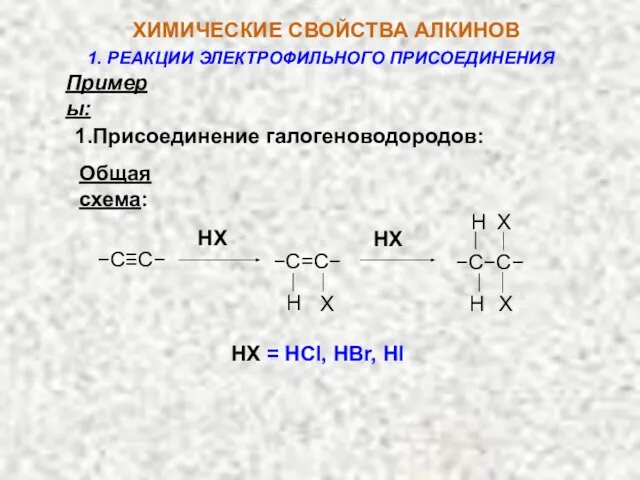
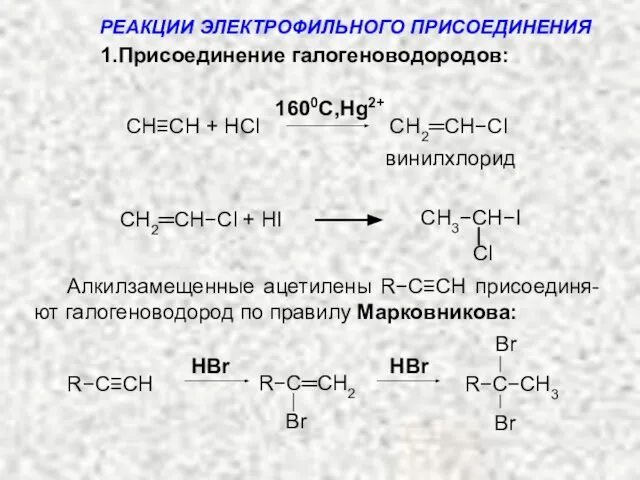
- 11. Примеры: 1.Присоединение галогеноводородов: Общая cхема: HX = HCl, HBr, HI HX HX −C≡C− X Н −C=C−
- 12. CH≡CH + HCl CH2═CH−Cl винилхлорид CH3−CH−I СH2═CH−Cl + HI Алкилзамещенные ацетилены R−С≡СH присоединя-ют галогеноводород по правилу
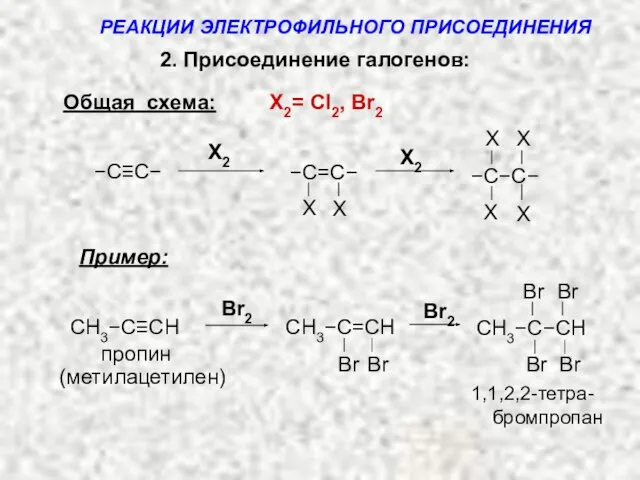
- 13. 2. Присоединение галогенов: Общая схема: X2= Cl2, Br2 Пример: пропин 1,1,2,2-тетра- Br Br Br CH3−C−CH Br
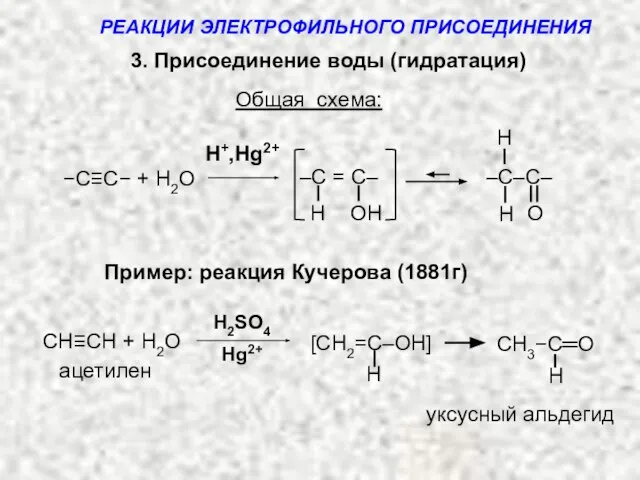
- 14. 3. Присоединение воды (гидратация) Общая схема: H+,Hg2+ H ОH –C = C– −C≡C− + H2O H
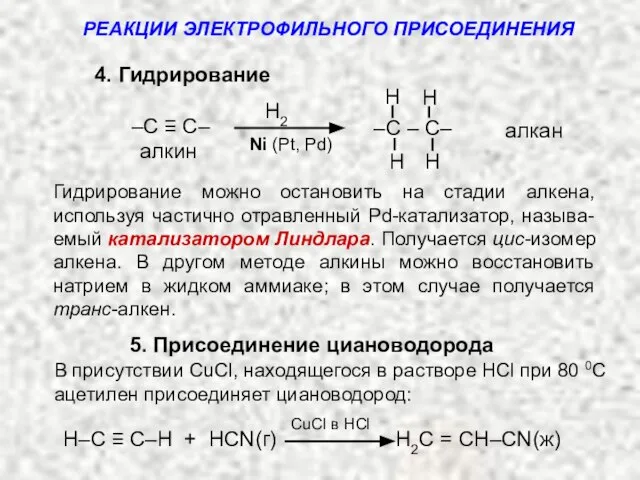
- 15. 4. Гидрирование алкан алкин H H H H –C – C– –C ≡ C– РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО
- 16. 2. РЕАКЦИИ ЗАМЕЩЕНИЯ. КИСЛОТНОСТЬ АЛКИНОВ Алкины с концевой тройной связью реагируют с некоторыми основаниями, при этом
- 17. 2. КИСЛОТНОСТЬ АЛКИНОВ. Согласно Бренстеду-Лоури, кислоты представляют собой вещества, отдающие протон, а основания – вещества, присоединяющие
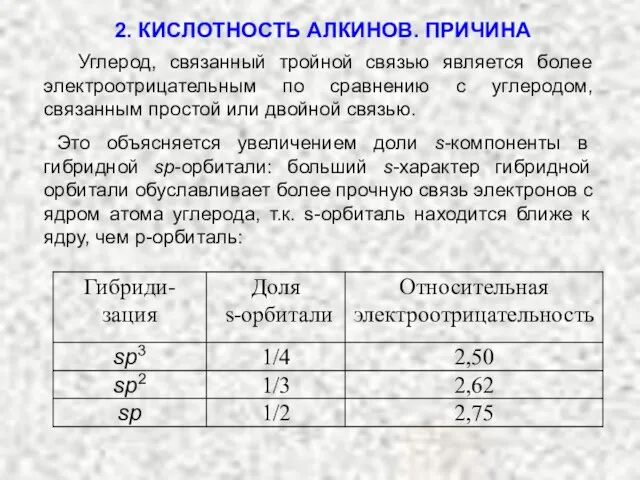
- 18. Кислотность вещества зависит от характера атома, с которым связан водород: кислотность вещества тем больше, чем выше
- 19. Углерод, связанный тройной связью является более электроотрицательным по сравнению с углеродом, связанным простой или двойной связью.
- 20. орбитали увеличение полярности связи C−H увеличение кислотных свойств водорода Таким образом водород, связанный с атомом углерода
- 21. Гомолитический разрыв связи с образованием радикалов затруднен, а гетеролитический протекает легче: H−C≡C−H H−C≡C∙ + H∙ H−C≡C−H
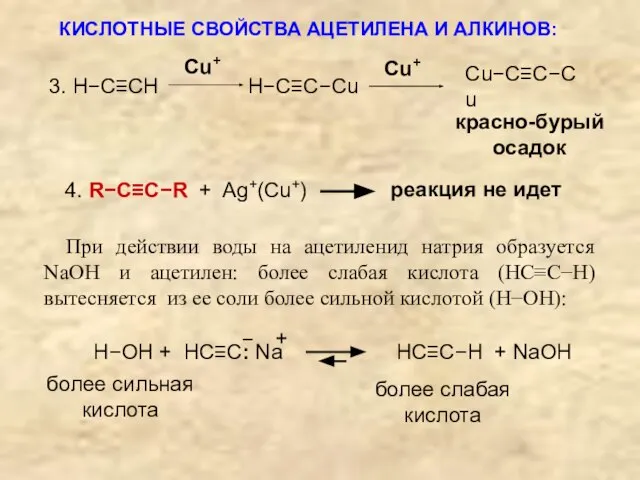
- 22. КИСЛОТНЫЕ СВОЙСТВА АЦЕТИЛЕНА И АЛКИНОВ: (R−C≡CH) проявляются, например, в их реакциях с ионами Na+, Ag+, Cu+
- 23. 4. R−C≡C−R + Ag+(Cu+) реакция не идет При действии воды на ацетиленид натрия образуется NaOH и
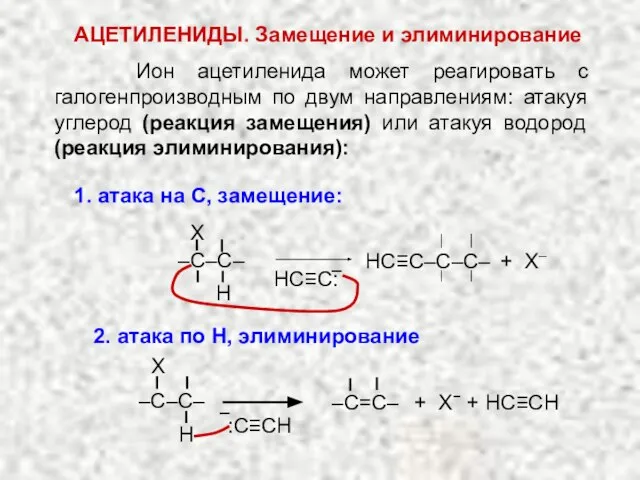
- 24. АЦЕТИЛЕНИДЫ. Нуклеофильное замещение Образование нерастворимых ацетиленидов тяжелых металлов (Ag, Cu) является качественной реакцией на атом водорода
- 25. Ион ацетиленида может реагировать с галогенпроизводным по двум направлениям: атакуя углерод (реакция замещения) или атакуя водород
- 26. АЛКИНЫ Элиминирование возрастает RX= первичный, вторичный, третичный Замещение возрастает КОНКУРЕНЦИЯ ЭЛИМИНИРОВАНИЯ И ЗАМЕЩЕНИЯ
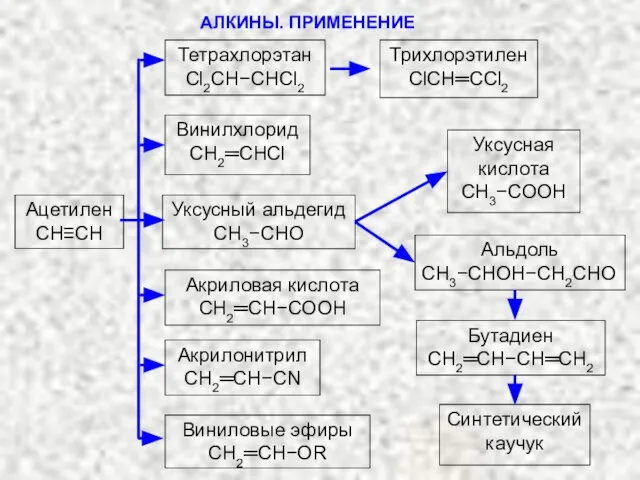
- 27. АЛКИНЫ. ПРИМЕНЕНИЕ Ацетилен СH≡CH Тетрахлорэтан Cl2CH−CHCl2 Трихлорэтилен ClCH═CCl2 Винилхлорид СH2═CHCl Уксусный альдегид CH3−CHO Уксусная кислота СH3−COOH
- 29. Скачать презентацию














 Клинические формы нарушений речи: 1) Периферического характера: Дислалия (механическая и функциональная) Ринолалия (открытая и за
Клинические формы нарушений речи: 1) Периферического характера: Дислалия (механическая и функциональная) Ринолалия (открытая и за Русская живопись Конец 20 – начало 21 века
Русская живопись Конец 20 – начало 21 века Самостоятельные занятия физическими упражнениями
Самостоятельные занятия физическими упражнениями Дробилка безрешетная
Дробилка безрешетная Устройства электропитания УЭП-МПК
Устройства электропитания УЭП-МПК Механические свойства грунтов
Механические свойства грунтов Теория потребительского поведения (выбора)
Теория потребительского поведения (выбора) Мифология древних славян
Мифология древних славян Организация социально-гигиенического мониторинга в Российской Федерации
Организация социально-гигиенического мониторинга в Российской Федерации Перспектива в искусстве
Перспектива в искусстве Пословицы о добре - презентация для начальной школы
Пословицы о добре - презентация для начальной школы Методы принятия управленческих решений
Методы принятия управленческих решений Набоков Владимир Владимирович
Набоков Владимир Владимирович Аксонометрия. Однокартинный чертеж, обладающий свойствами наглядности и обратимости
Аксонометрия. Однокартинный чертеж, обладающий свойствами наглядности и обратимости Приём и распределение Оборудование для эфирного приёма ТВ программ
Приём и распределение Оборудование для эфирного приёма ТВ программ Корреляционный анализ.ppt
Корреляционный анализ.ppt Денсаулық сақтау ұйымында сапа менеджмент жүйесі
Денсаулық сақтау ұйымында сапа менеджмент жүйесі Презентация на тему Способы нарезки овощей
Презентация на тему Способы нарезки овощей  ПРЕДПРИНИМАТЕЛЬСКАЯ ДЕЯТЕЛЬНОСТЬ ПРЕЗЕНТАЦИЯ ПО ОБЩЕСТВОЗНАНИЮ . В КЛАСС. БАЗОВЫЙ УРОВЕНЬ.
ПРЕДПРИНИМАТЕЛЬСКАЯ ДЕЯТЕЛЬНОСТЬ ПРЕЗЕНТАЦИЯ ПО ОБЩЕСТВОЗНАНИЮ . В КЛАСС. БАЗОВЫЙ УРОВЕНЬ.  Храми Японії та Китаю
Храми Японії та Китаю Ненаркотические анальгетики
Ненаркотические анальгетики Особливості дзен-буддизму та ламаїзму
Особливості дзен-буддизму та ламаїзму Распределенные службы имен
Распределенные службы имен Философская основа закона больших чисел
Философская основа закона больших чисел 1. Product Planning & Development
1. Product Planning & Development Management Decision Support and Intelligent Systems
Management Decision Support and Intelligent Systems Связующие процессы в менеджменте
Связующие процессы в менеджменте Стан української мови в сучасній Україні
Стан української мови в сучасній Україні