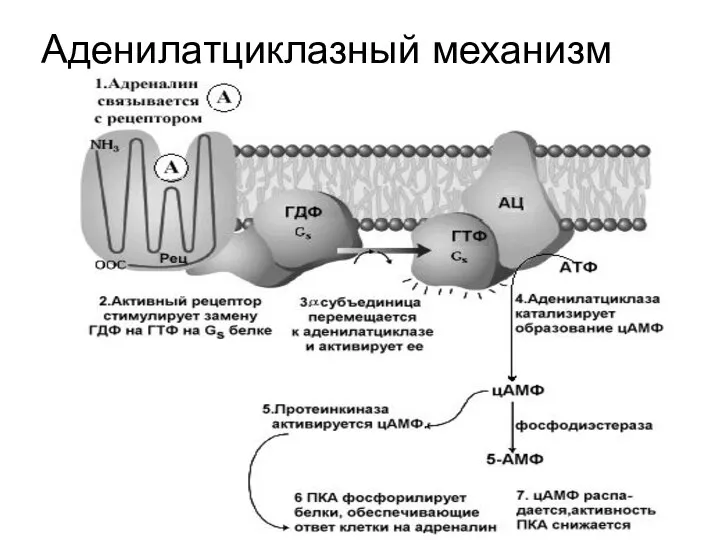
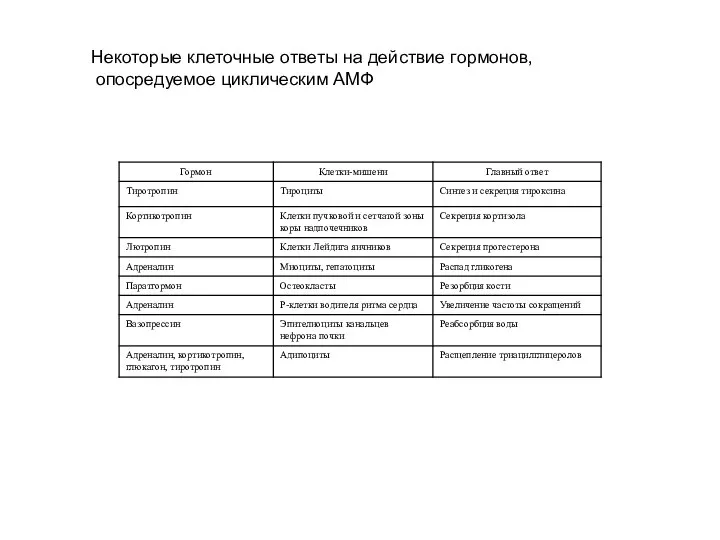
Слайд 8

Сигнальные роли ДАГ
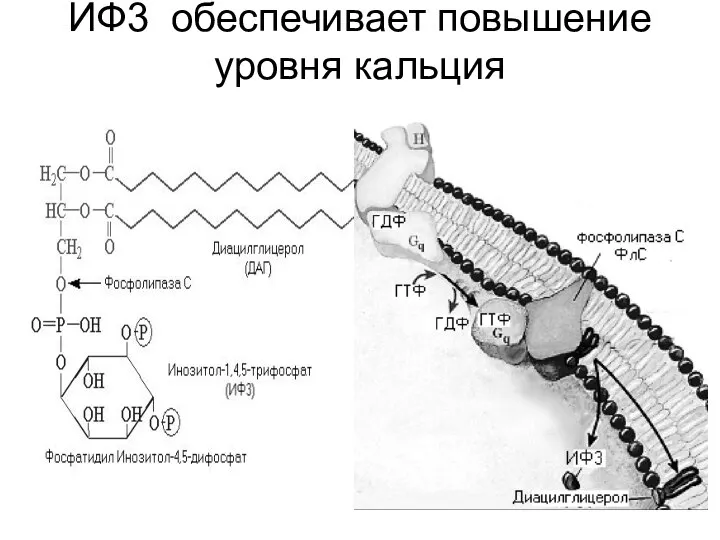
Если ИФ3 повышает концентрацию ионов Са2+ в цитозоле,
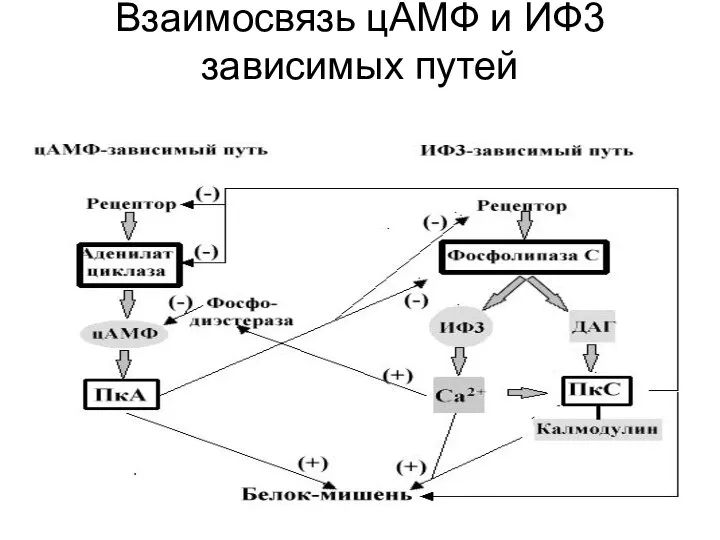
другой продукт расщепления фосфатидилинозитол -4,5- дифосфата – ДАГ – остается в плазматической мембране и вызывает совершенно иные молекулярные эффекты. У него есть две "сигнальные" роли: он может гидролизоваться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы, или способен активировать специфическую протеинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени.
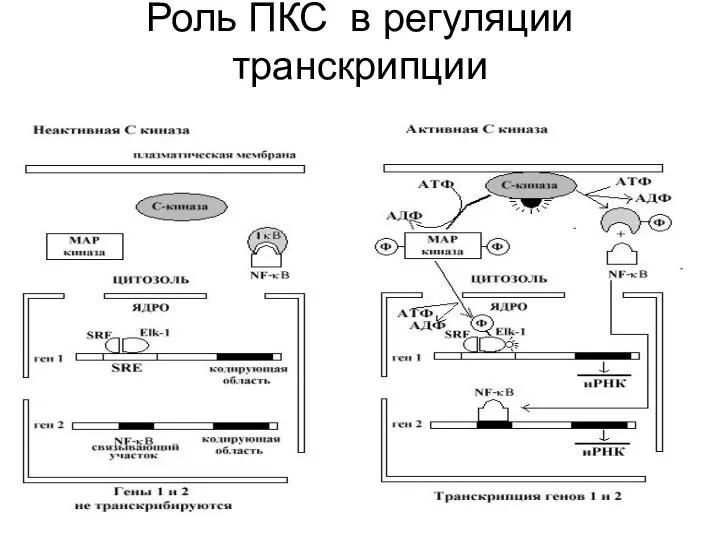
Фермент, активируемый ДАГ, называется протеинкиназой С (ПКС) или С–киназой, так как активность его зависит от уровня Са2+ в цитозоле клетки. Полипептидная цепь этого фермента содержит четыре консервативных домена и пять вариабельных областей. Консервативные области включают АТФ-, Са2+ - , диацилглицерол- и субстрат-связывающий домены. При низком внутриклеточном уровне Са2+ и отсутствии диацилглицерола протеинкиназа С находится в цитоплазме в неактивном состоянии. Связывание диацилглицерола изменяет конформацию протеинкиназы С, что сопровождается повышением ее сродства к ионам Са2+ и липидам. Это приводит к связыванию протеинкиназы С с цитоплазматической поверхностью плазматической мембраны и переводу фермента в активное состояние. Активация С-киназы кратковременна, так как через несколько секунд диацилглицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты.
С-киназа, активированная диацилглицеролом и Са2+, переносит концевую фосфатную группу с АТФ на специфические сериновые или треониновые остатки белков-мишеней, которые в разных клетках различны. Например, во многих животных клетках С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН. Концентрация С-киназы выше всего в нейронах головного мозга, где, помимо, прочего она фосфорилирует ионные каналы нейронов и, изменяя их проницаемость, может влиять на возбудимость этих клеток.
В некоторых клетках активация С - киназы усиливает транскрипцию определенных генов.


















 Turystyka kajakowa w Polsce
Turystyka kajakowa w Polsce Web-сайт сети магазинов для видеоигр «GameTime»
Web-сайт сети магазинов для видеоигр «GameTime» «НСОТ – Новая система оплаты труда работников бюджетной сферы» Косова Марина Вячеславовна
«НСОТ – Новая система оплаты труда работников бюджетной сферы» Косова Марина Вячеславовна  Фестиваль детских объединений ГДОО "Росток"
Фестиваль детских объединений ГДОО "Росток" Етнокультурна мозаїка України
Етнокультурна мозаїка України Украинская культура
Украинская культура  Физические лица. Правосубъектность граждан. Тема 3
Физические лица. Правосубъектность граждан. Тема 3 Презентация на тему "Рахит" - скачать презентации по Медицине
Презентация на тему "Рахит" - скачать презентации по Медицине Raspberri Pi, Python и Git. Схема команд
Raspberri Pi, Python и Git. Схема команд Презентация: «Факторы влияющие на принятия управленческих решений» Выполнил: магистр. МС – 11м Нарг
Презентация: «Факторы влияющие на принятия управленческих решений» Выполнил: магистр. МС – 11м Нарг Основы военной связи. Общая тактика
Основы военной связи. Общая тактика Управление карьерой
Управление карьерой Товар Гиффена
Товар Гиффена Основи побудови автоматизованих систем управління військами
Основи побудови автоматизованих систем управління військами Ведение клиентской базы
Ведение клиентской базы Iqtisodiyotning xalqaro integratsiyasida
Iqtisodiyotning xalqaro integratsiyasida Политические роли личности
Политические роли личности УМК «Школа России» Переместительный закон сложения 1 класс
УМК «Школа России» Переместительный закон сложения 1 класс Управление световым оформлением зданий
Управление световым оформлением зданий CAD/CAM/CAE системы. Виды и этапы программирования. Виды моделирования. Уровни CAM систем
CAD/CAM/CAE системы. Виды и этапы программирования. Виды моделирования. Уровни CAM систем Презентация на тему "Система высшего образования новые вызовы и тренды" - скачать презентации по Педагогике
Презентация на тему "Система высшего образования новые вызовы и тренды" - скачать презентации по Педагогике Центробежные компрессоры. Проточный тракт
Центробежные компрессоры. Проточный тракт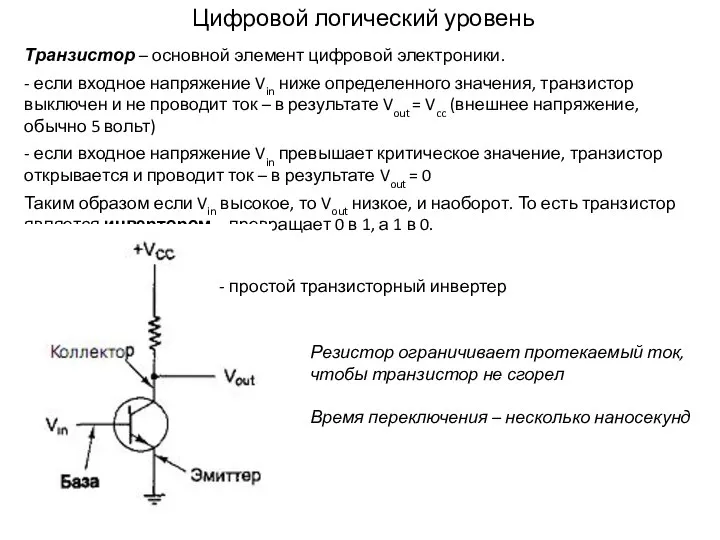 Цифровой логический уровень. Транзистор
Цифровой логический уровень. Транзистор Презентация на тему "ВОЗРАСНЫЕ ОСОБЕННОСТИ РАЗВИТИЯ ЛИЧНОСТИ" - скачать презентации по Медицине
Презентация на тему "ВОЗРАСНЫЕ ОСОБЕННОСТИ РАЗВИТИЯ ЛИЧНОСТИ" - скачать презентации по Медицине реляционная алгебра SQL
реляционная алгебра SQL Мир верх ногами
Мир верх ногами Программирование на языке Паскаль
Программирование на языке Паскаль Оформление интерьеров Центров образования цифрового и гуманитарного профилей «Точка роста»
Оформление интерьеров Центров образования цифрового и гуманитарного профилей «Точка роста»