Содержание
- 2. Классификация реакций
- 3. По направлению и конечному результату Реакции присоединения – А; Реакции замещения – S; Реакции отщепления –
- 4. По механизму реакции радикальные - участвуют радикалы (R.), образующиеся за счёт гомолитического типа разрыва связей Х
- 5. Основные понятия РАДИКАЛЫ – свободные атомы или частицы с неспаренным электроном. ЭЛЕКТРОФИЛЫ – частицы или фрагменты
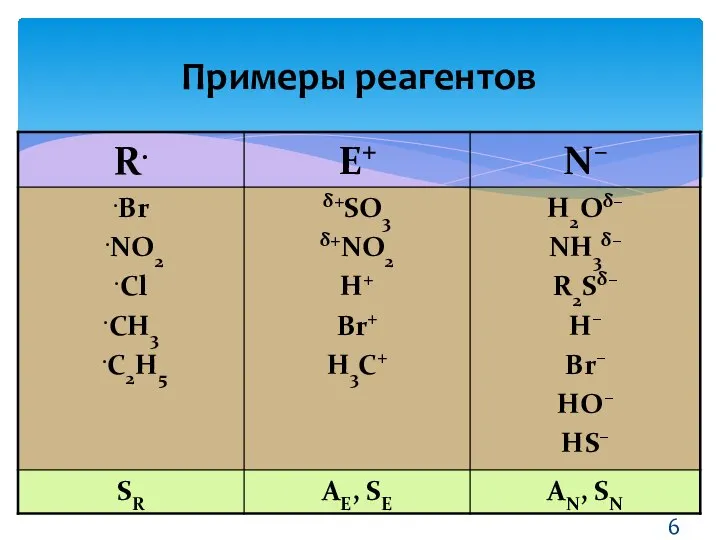
- 6. Примеры реагентов
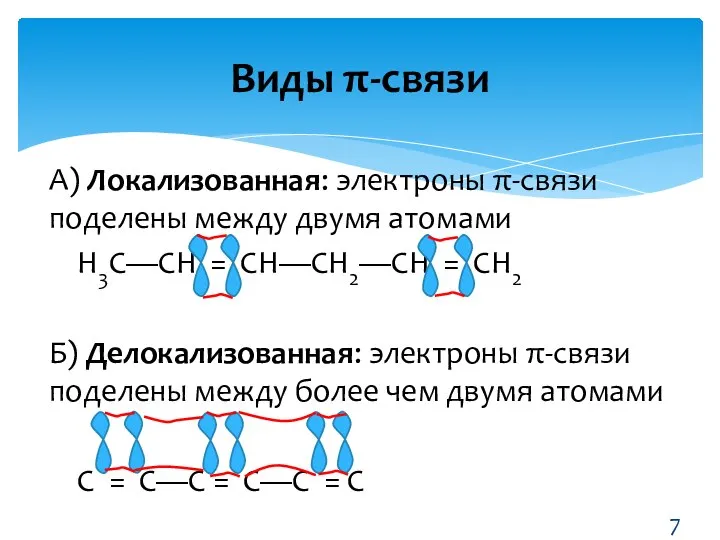
- 7. Виды π-связи А) Локализованная: электроны π-связи поделены между двумя атомами Н3С—СН = СН—СН2—СН = СН2 Б)
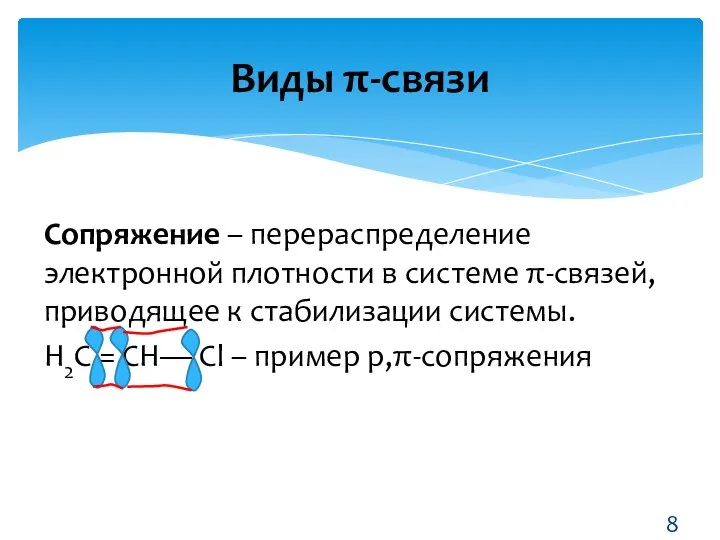
- 8. Сопряжение – перераспределение электронной плотности в системе π-связей, приводящее к стабилизации системы. Н2С = СН— Сl
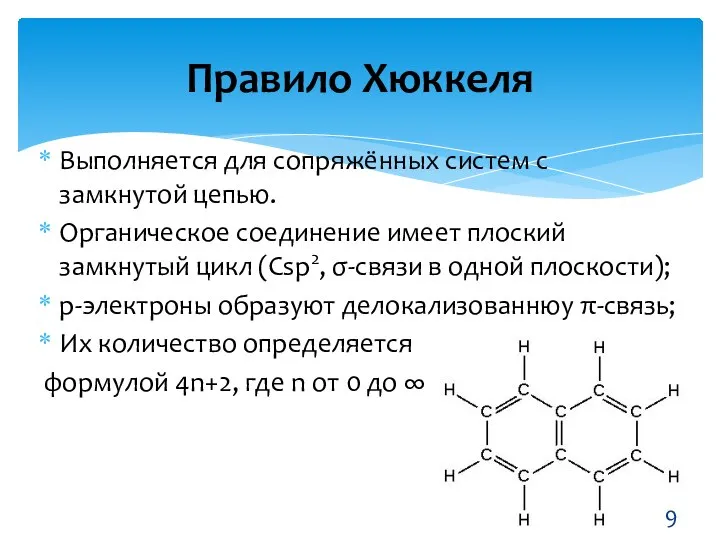
- 9. Выполняется для сопряжённых систем с замкнутой цепью. Органическое соединение имеет плоский замкнутый цикл (Сsp2, σ-связи в
- 10. приводят к неравномерному распределению электронной плотности в ОС и возникновению реакционных центров. Индуктивный эффект – передача
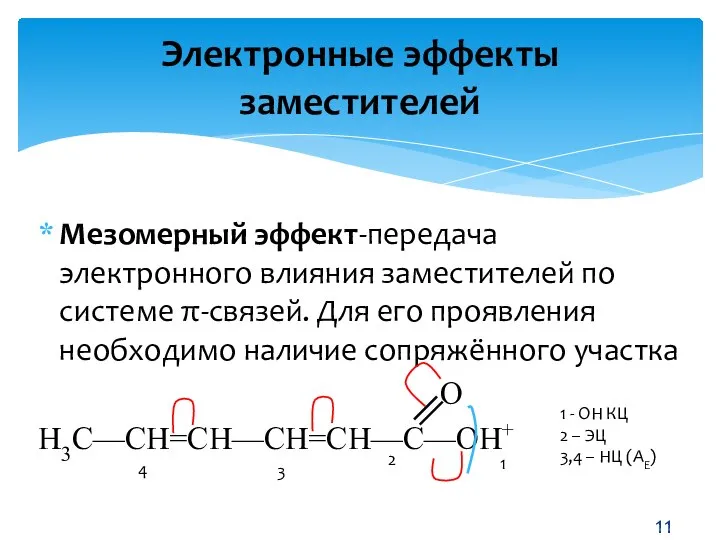
- 11. Мезомерный эффект-передача электронного влияния заместителей по системе π-связей. Для его проявления необходимо наличие сопряжённого участка О
- 12. Заместители 1 рода (Э.Д.): СН3, NН2, ОН, Нal ориентируют последующие заместители в орто- и пара- (2,
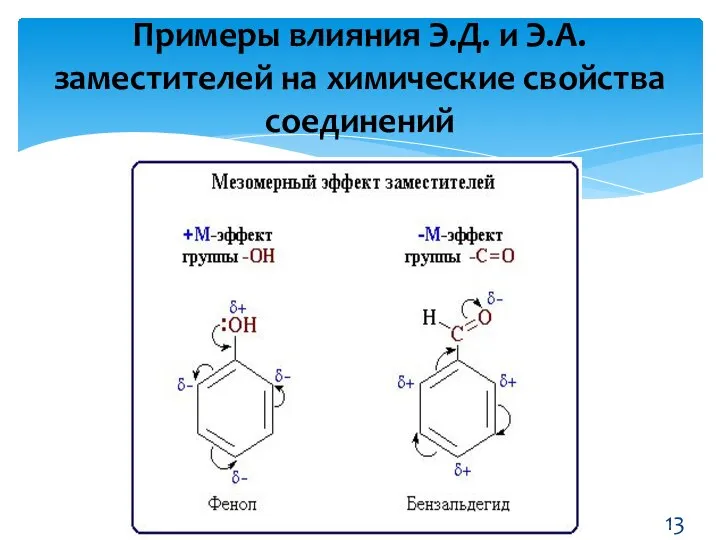
- 13. Примеры влияния Э.Д. и Э.А. заместителей на химические свойства соединений
- 15. Скачать презентацию






 Монголия- Белый Месяц. Встреча весны
Монголия- Белый Месяц. Встреча весны Проект разработки портала турфирмы
Проект разработки портала турфирмы  Неорганические строительные материалы Керамические материалы. Фарфор. Фаянс. Керамика.
Неорганические строительные материалы Керамические материалы. Фарфор. Фаянс. Керамика. Я і мае сябры. На вуліцы. (Тэма 16)
Я і мае сябры. На вуліцы. (Тэма 16) Hai oder Torte
Hai oder Torte Функциональная анатомия мышечной системы
Функциональная анатомия мышечной системы Сертификация ISTQB. За и против. Птицына Виктория. ООО «НПФ «Гейзер»
Сертификация ISTQB. За и против. Птицына Виктория. ООО «НПФ «Гейзер» EXE и COM файлы. Выполнение программ и распределение памяти
EXE и COM файлы. Выполнение программ и распределение памяти Среда Embarcadero RAD Studio. C++ Builder
Среда Embarcadero RAD Studio. C++ Builder Второй день творения
Второй день творения Выполнил: ФИО ФИО ФИО
Выполнил: ФИО ФИО ФИО ПРОИЗВОДСТВЕННЫЕ ОСНОВЫ В ОРГАНИЗАЦИИ АГРОБИЗНЕССА
ПРОИЗВОДСТВЕННЫЕ ОСНОВЫ В ОРГАНИЗАЦИИ АГРОБИЗНЕССА Педагогический совет Методы обучения в современной школе: cемь мыслей в секунду 14 января 2011 г.
Педагогический совет Методы обучения в современной школе: cемь мыслей в секунду 14 января 2011 г. Презентация The Carribian Community КАРИКОМ
Презентация The Carribian Community КАРИКОМ РУССКИЕ НАРОДНЫЕ СКАЗКИ Викторина для 2 класса по литературному чтению УМК «Школа России»
РУССКИЕ НАРОДНЫЕ СКАЗКИ Викторина для 2 класса по литературному чтению УМК «Школа России» Покідіна Алла Василівна Учитель географії ЗОШ №24 Рік народження -1971 Освіта – вища
Покідіна Алла Василівна Учитель географії ЗОШ №24 Рік народження -1971 Освіта – вища  Шандор Ремете. Чайя йога
Шандор Ремете. Чайя йога Внимание: профессиональная ошибка медицинского работника!
Внимание: профессиональная ошибка медицинского работника! Экономические и материальные блага
Экономические и материальные блага Sport in our life
Sport in our life Воскресная школа «Омофор»
Воскресная школа «Омофор» Статика культуры. Парадигмы культуры. (Лекция 3)
Статика культуры. Парадигмы культуры. (Лекция 3) Презентация Формы трансакционных издержек в современной экономике
Презентация Формы трансакционных издержек в современной экономике  Еврейский образ жизни
Еврейский образ жизни поиск последних научных публикаций по теме лучевой болезни
поиск последних научных публикаций по теме лучевой болезни  Кинематика поступательного движения
Кинематика поступательного движения Презентация Работник как субъект трудового права
Презентация Работник как субъект трудового права  Практическое занятие 1. Пароли.
Практическое занятие 1. Пароли.