Содержание
- 2. Оценку правильности принятого механизма проводят по многим критериям. Механизм должен объяснять: образование всех продуктов реакции; предсказывать
- 3. Выявление механизма органической реакции осуществляется в несколько этапов: - проработка литературы; - выдвижение одной или нескольких
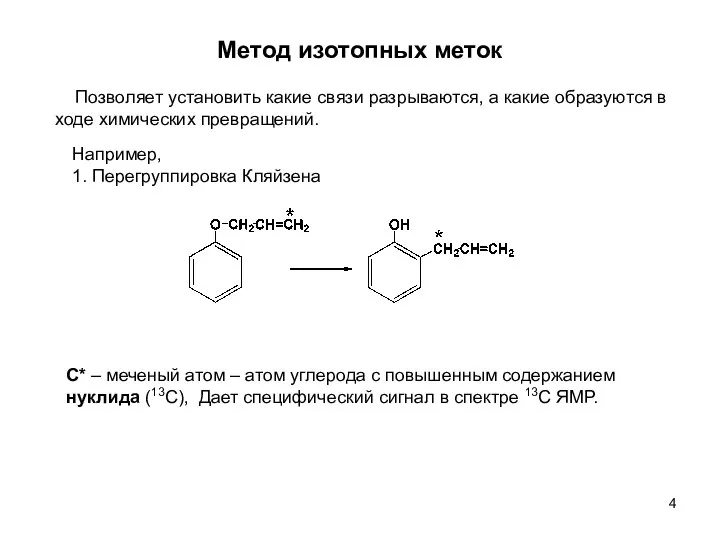
- 4. Метод изотопных меток Позволяет установить какие связи разрываются, а какие образуются в ходе химических превращений. Например,
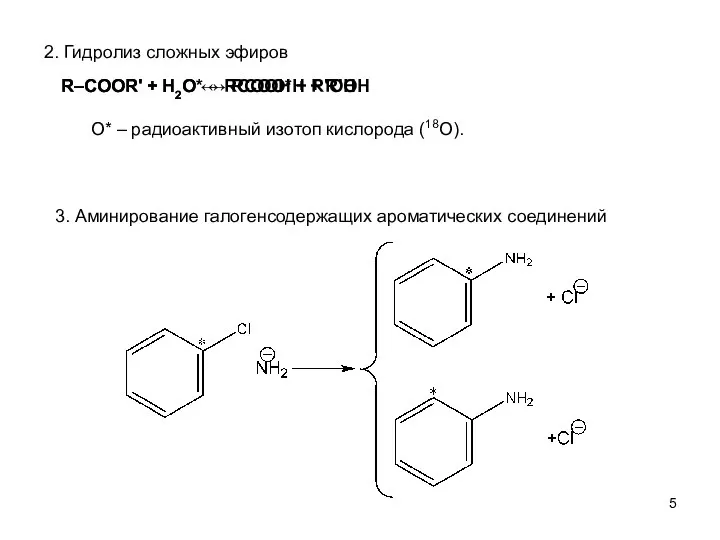
- 5. 2. Гидролиз сложных эфиров 3. Аминирование галогенсодержащих ароматических соединений R–COOR' + Н2О* ↔ RCOO*H + R'ОН
- 6. Кинетический метод в установлении механизма реакции На основании предложенного механизма реакции составляются кинетические уравнения. Далее проводятся
- 7. Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым
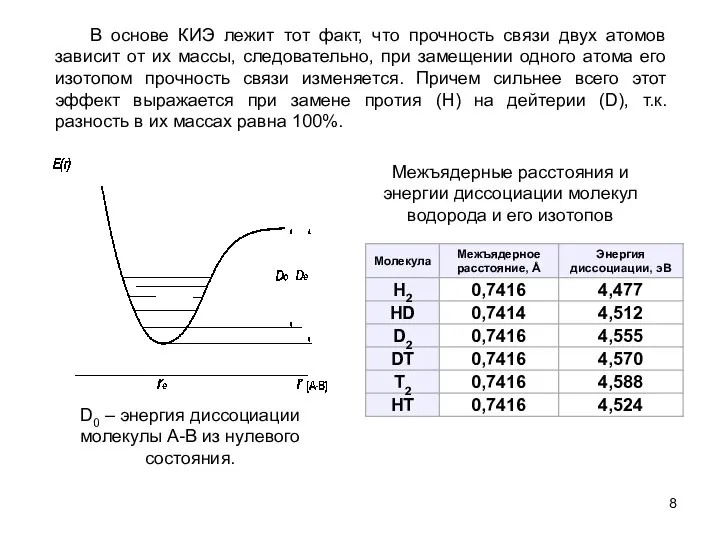
- 8. D0 – энергия диссоциации молекулы A-B из нулевого состояния. Межъядерные расстояния и энергии диссоциации молекул водорода
- 9. При замене водорода дейтерием приведенная масса увеличивается, в результате чего энергия диссоциации также увеличивается, следовательно, связь
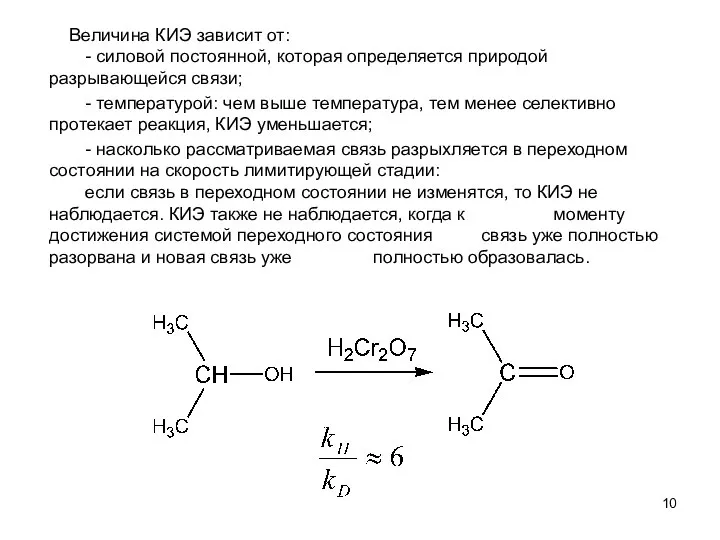
- 10. Величина КИЭ зависит от: - силовой постоянной, которая определяется природой разрывающейся связи; - температурой: чем выше
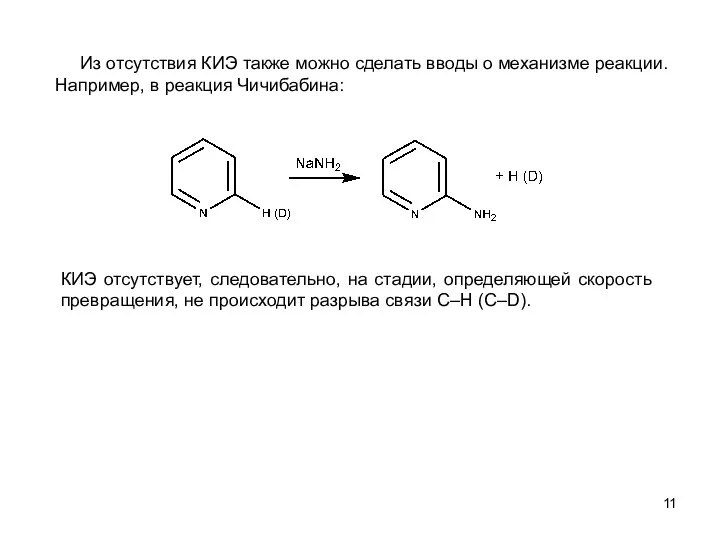
- 11. Из отсутствия КИЭ также можно сделать вводы о механизме реакции. Например, в реакция Чичибабина: КИЭ отсутствует,
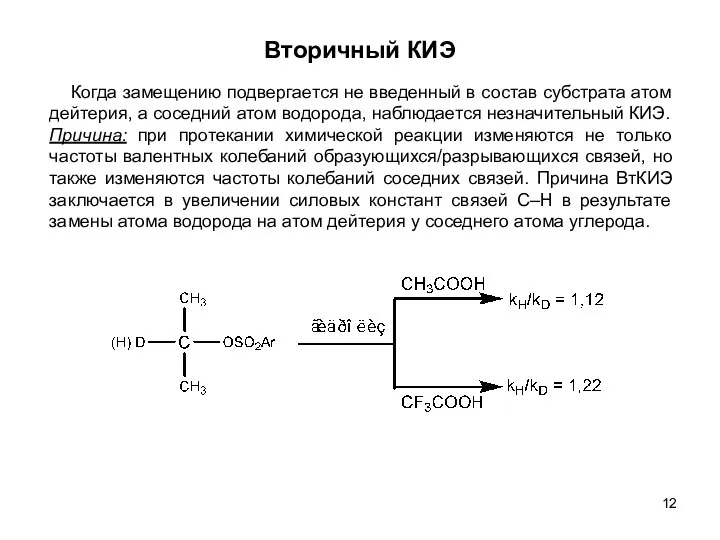
- 12. Вторичный КИЭ Когда замещению подвергается не введенный в состав субстрата атом дейтерия, а соседний атом водорода,
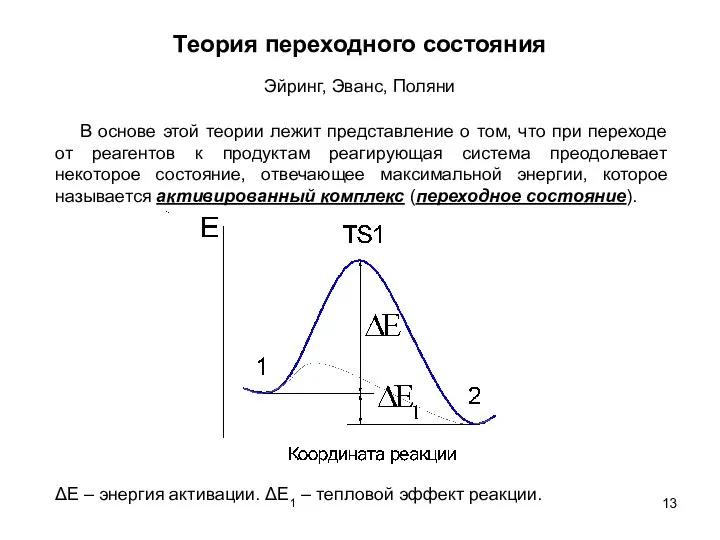
- 13. Теория переходного состояния Эйринг, Эванс, Поляни В основе этой теории лежит представление о том, что при
- 14. Из переходного состояния система без всякого поглощения энергии может перейти либо в продукт, либо в исходное
- 15. Энтальпия активации - разность энтальпий образования TS и исходного состояния. Различия в характеризуют изменения энергии системы
- 16. Для неполярных реакций (между электронейтральными молекулами, когда образуются незаряженные продукты) эффекты сольватации не могут играть значительной
- 17. При возникновении в ходе реакции зарядов, переходное состояние обладает более высоким дипольным моментом, чем исходная система.
- 18. Термодинамический и кинетический контроль состава продуктов Очень часто наблюдается ситуация когда из одних и тех же
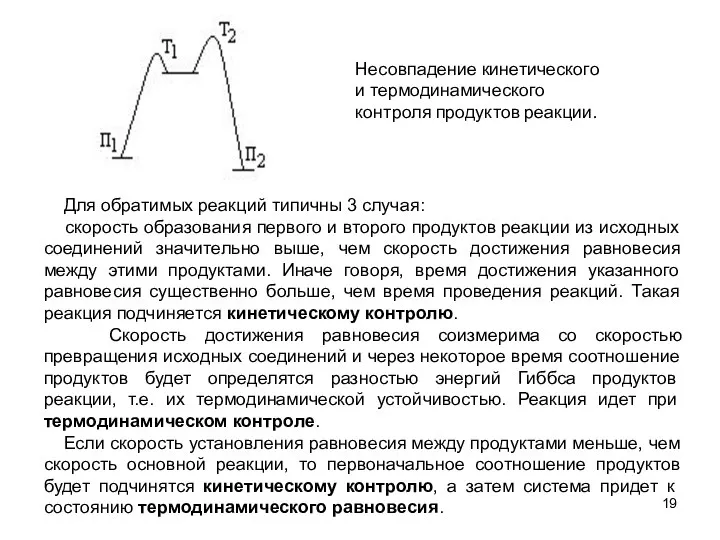
- 19. Для обратимых реакций типичны 3 случая: скорость образования первого и второго продуктов реакции из исходных соединений
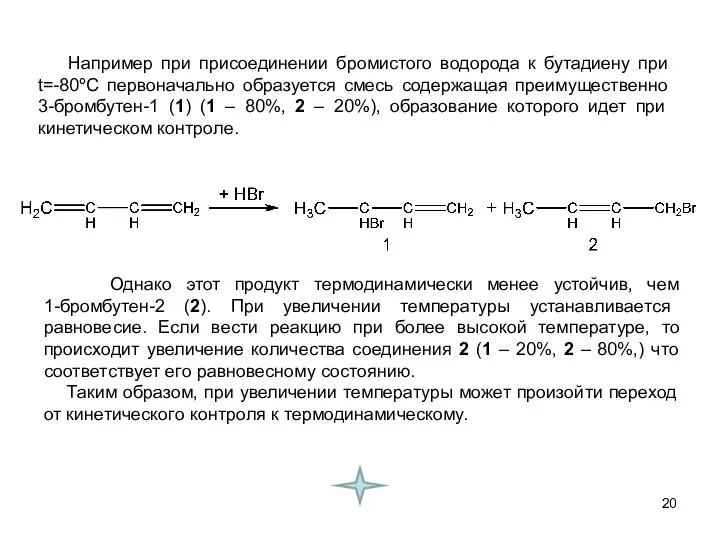
- 20. Например при присоединении бромистого водорода к бутадиену при t=-80ºС первоначально образуется смесь содержащая преимущественно 3-бромбутен-1 (1)
- 22. Скачать презентацию










 Тест. Экстремальное программирование
Тест. Экстремальное программирование Презентация Трудности и опасности выхода на внешние рынки и осуществления внешнеэкономической деятельности
Презентация Трудности и опасности выхода на внешние рынки и осуществления внешнеэкономической деятельности  «Проектирование образовательной программы дошкольной организации в условиях внедрения «Проектирование образовательной прогр
«Проектирование образовательной программы дошкольной организации в условиях внедрения «Проектирование образовательной прогр Протокол MGCP
Протокол MGCP Терроризм. Причины терроризма
Терроризм. Причины терроризма Модели развития экономики на базе производственных функций
Модели развития экономики на базе производственных функций Домашняя утварь в крестьянском доме
Домашняя утварь в крестьянском доме АНАТОМИЯ ЧЕРЕПА сдудентам занятие
АНАТОМИЯ ЧЕРЕПА сдудентам занятие Презентация "Копилка. Психологические особенности накопления денег в подростковом возрасте" - скачать презентации по Эконом
Презентация "Копилка. Психологические особенности накопления денег в подростковом возрасте" - скачать презентации по Эконом Лицензирование фармацевтической деятельности
Лицензирование фармацевтической деятельности Почему наша реклама действительно работает.
Почему наша реклама действительно работает. Презентация на тему Обмен жиров в организме
Презентация на тему Обмен жиров в организме McDonalds Logo - презентация
McDonalds Logo - презентация Финансовое и денежно-кредитное регулирование
Финансовое и денежно-кредитное регулирование Stunde
Stunde Системы автоматизированного программирования обработки на станках с ЧПУ их структура и классификация
Системы автоматизированного программирования обработки на станках с ЧПУ их структура и классификация Авторский семинар Варламова П.П., учителя географии и экологии высшей квалификационной категории МБОУ «Кептинская СОШ» по тем
Авторский семинар Варламова П.П., учителя географии и экологии высшей квалификационной категории МБОУ «Кептинская СОШ» по тем Диалектика. Диктатура. Демократия. Сущность, основные характеристики
Диалектика. Диктатура. Демократия. Сущность, основные характеристики Паніровка
Паніровка Дифференциальная диагностика опухолей средостения.
Дифференциальная диагностика опухолей средостения. Презентация "Художественная культура Древней и Средневековой Японии" - скачать презентации по МХК
Презентация "Художественная культура Древней и Средневековой Японии" - скачать презентации по МХК Презентация Европейская валютная система
Презентация Европейская валютная система Ремёсла и украшения древнейших людей
Ремёсла и украшения древнейших людей Основные понятия и определения статики
Основные понятия и определения статики ФОНТАНЫ: история и современность
ФОНТАНЫ: история и современность Государственное регулирование предпринимательской деятельности Выполнил студент 2 курса ФТД группы Т-091 Карпачёв Вячеслав
Государственное регулирование предпринимательской деятельности Выполнил студент 2 курса ФТД группы Т-091 Карпачёв Вячеслав Мир хозяйства в общественном сознании докапиталистических эпох
Мир хозяйства в общественном сознании докапиталистических эпох Определение религии
Определение религии