Содержание
- 2. В случае сложных реакций наиболее медленно протекающая стадия называется скорость лимитирующей стадией - она определяет скорость
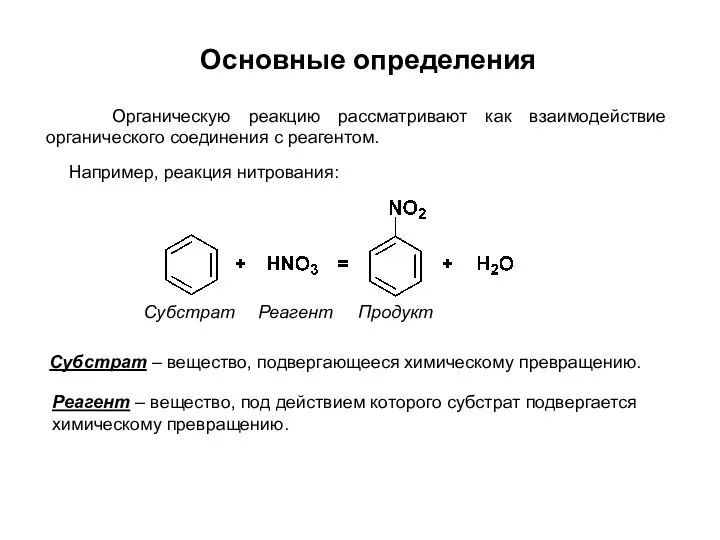
- 3. Например, реакция нитрования: Субстрат – вещество, подвергающееся химическому превращению. Реагент – вещество, под действием которого субстрат
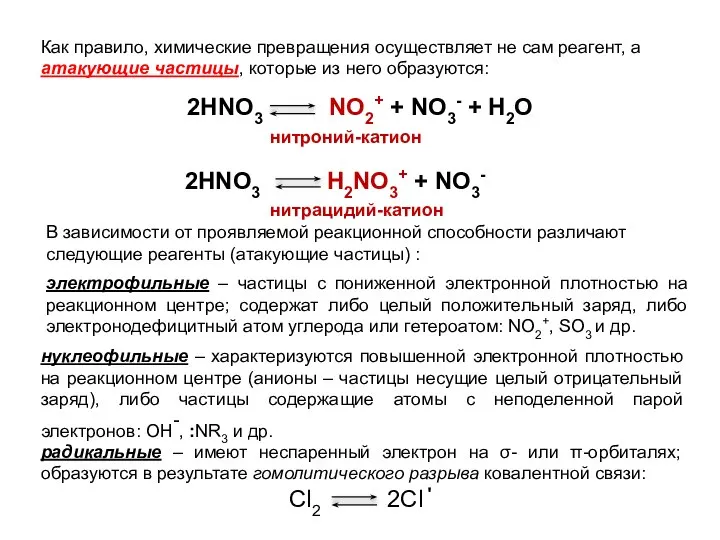
- 4. Как правило, химические превращения осуществляет не сам реагент, а атакующие частицы, которые из него образуются: 2HNO3
- 5. Классификация органических реакций 1. Гомолитические. Ковалентная связь образуется в результате обобщения двух электронов, причем каждый атом,
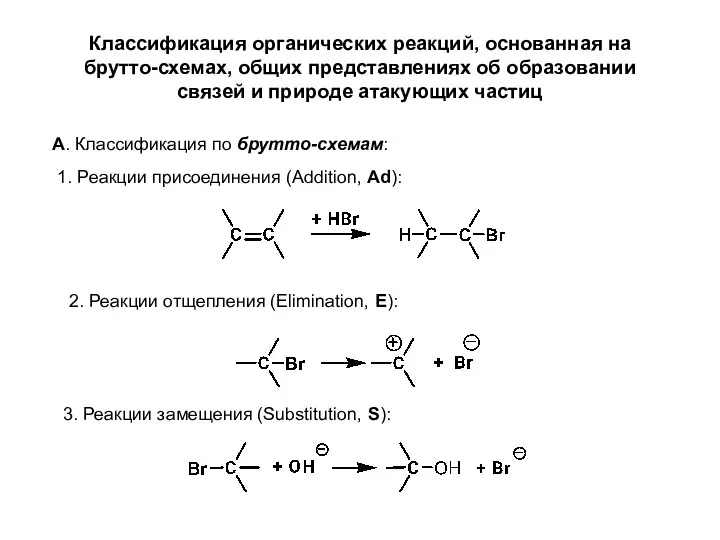
- 6. Классификация органических реакций, основанная на брутто-схемах, общих представлениях об образовании связей и природе атакующих частиц А.
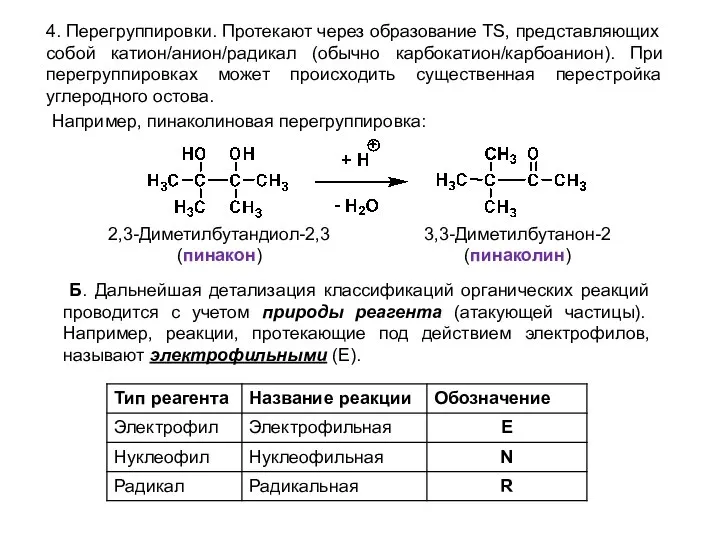
- 7. 4. Перегруппировки. Протекают через образование TS, представляющих собой катион/анион/радикал (обычно карбокатион/карбоанион). При перегруппировках может происходить существенная
- 8. В. Количество частиц, участвующих на стадии, определяющей скорость реакции в целом: - мономолекулярная реакция 1; -
- 9. Существуют также и другие классификации, например, по характеру реагентов и продуктов реакции: - сульфирование - нитрование
- 10. Взаимное влияние атомов в молекулах органических соединений Заместители (функциональные группы) – атомы или группы атомов, являющиеся
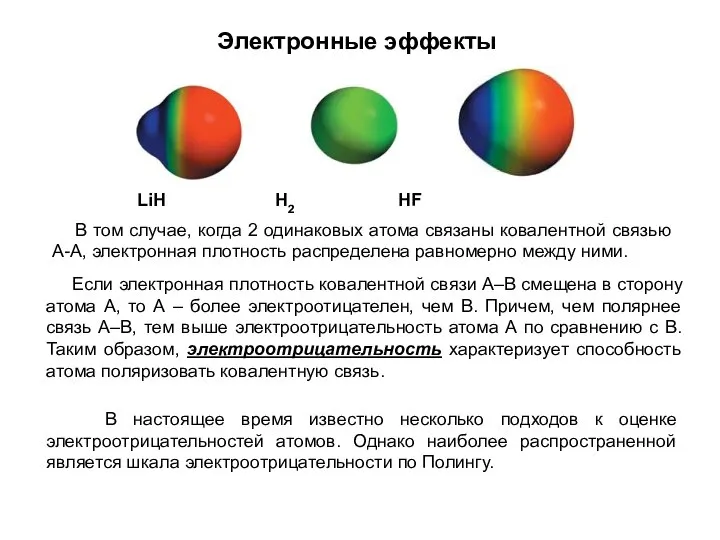
- 11. Электронные эффекты В том случае, когда 2 одинаковых атома связаны ковалентной связью А-А, электронная плотность распределена
- 12. Разность электроотрицательностьей двух атомов А и В (χA и χB) определяется по формуле: где ЕАВ, ЕАА,
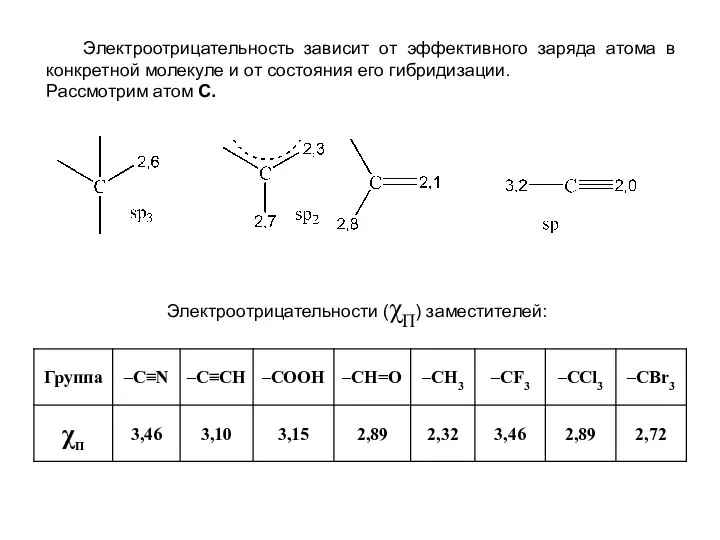
- 13. Электроотрицательность зависит от эффективного заряда атома в конкретной молекуле и от состояния его гибридизации. Рассмотрим атом
- 14. Есть и другие шкалы. Например, электроотрицательность по Малликену рассчитывается по формуле: где I – потенциал ионизации,
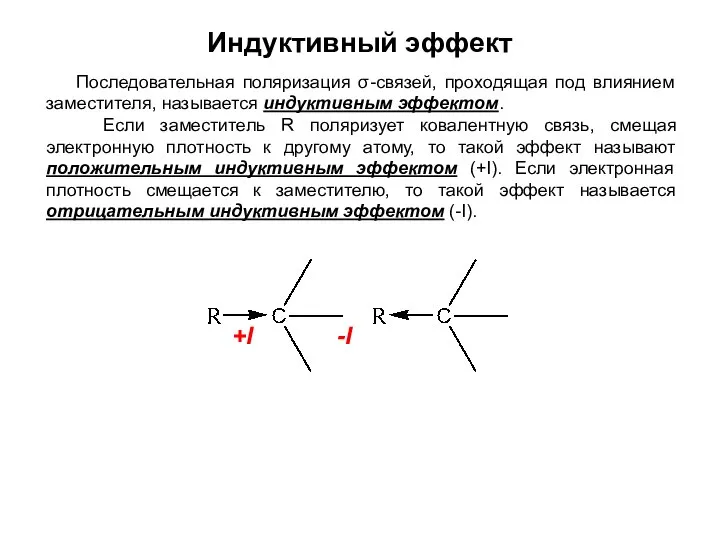
- 15. Индуктивный эффект Последовательная поляризация σ-связей, проходящая под влиянием заместителя, называется индуктивным эффектом. Если заместитель R поляризует
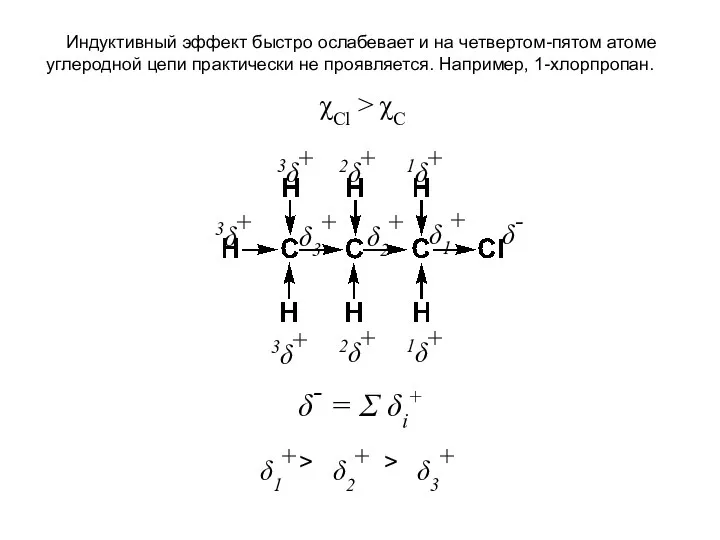
- 16. Индуктивный эффект быстро ослабевает и на четвертом-пятом атоме углеродной цепи практически не проявляется. Например, 1-хлорпропан. δ-
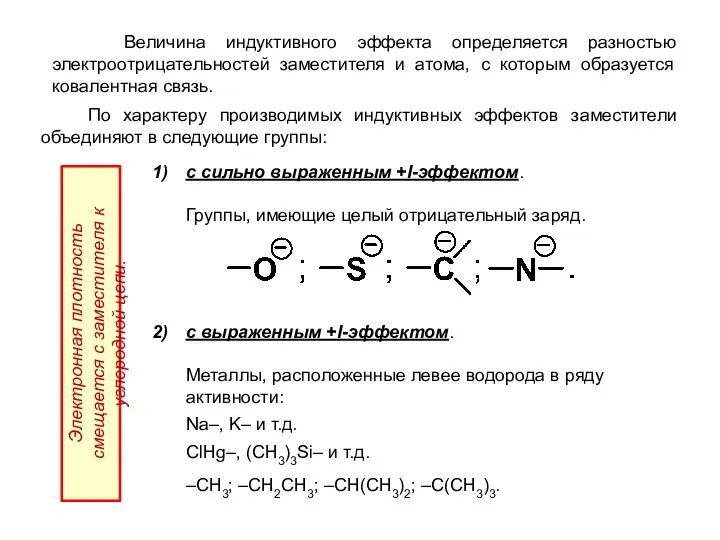
- 17. Величина индуктивного эффекта определяется разностью электроотрицательностей заместителя и атома, с которым образуется ковалентная связь. По характеру
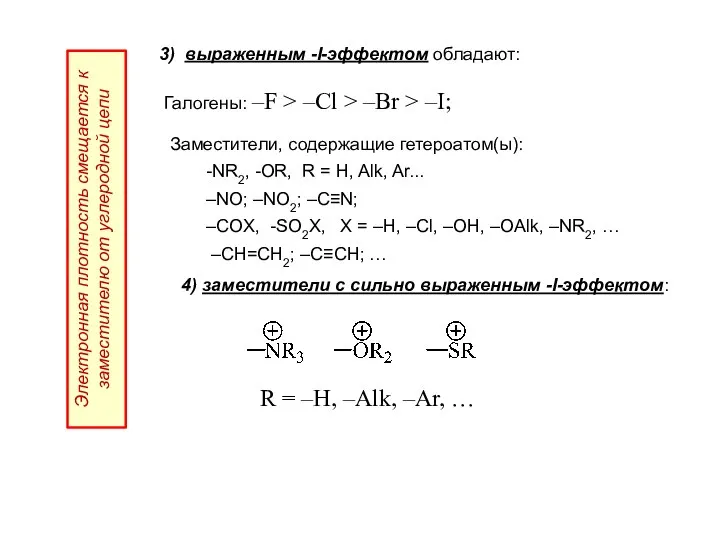
- 18. 3) выраженным -I-эффектом обладают: Галогены: –F > –Cl > –Br > –I; Электронная плотность смещается к
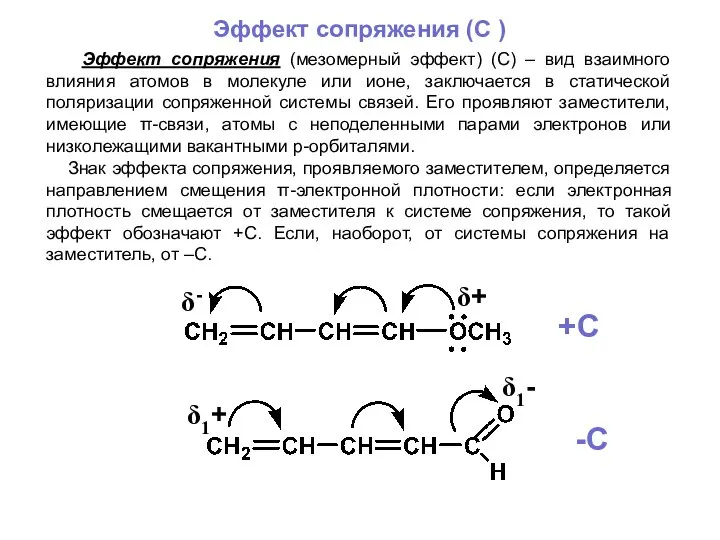
- 19. Эффект сопряжения (C ) Эффект сопряжения (мезомерный эффект) (С) – вид взаимного влияния атомов в молекуле
- 20. +С-эффект проявляют заместители, имеющие неподеленную пару электронов на атоме, непосредственно связанном с системой сопряжения: .. –NR2;
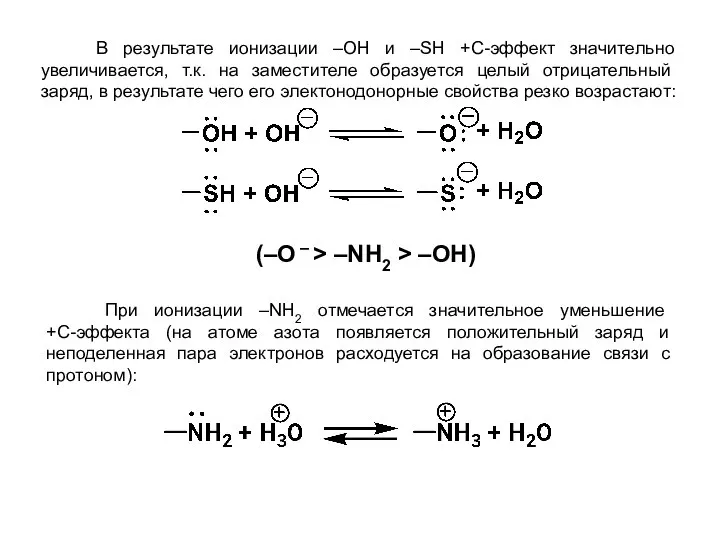
- 21. В результате ионизации –OН и –SН +С-эффект значительно увеличивается, т.к. на заместителе образуется целый отрицательный заряд,
- 23. Скачать презентацию








 Тест. Экстремальное программирование
Тест. Экстремальное программирование Презентация Трудности и опасности выхода на внешние рынки и осуществления внешнеэкономической деятельности
Презентация Трудности и опасности выхода на внешние рынки и осуществления внешнеэкономической деятельности  «Проектирование образовательной программы дошкольной организации в условиях внедрения «Проектирование образовательной прогр
«Проектирование образовательной программы дошкольной организации в условиях внедрения «Проектирование образовательной прогр Протокол MGCP
Протокол MGCP Терроризм. Причины терроризма
Терроризм. Причины терроризма Модели развития экономики на базе производственных функций
Модели развития экономики на базе производственных функций Домашняя утварь в крестьянском доме
Домашняя утварь в крестьянском доме АНАТОМИЯ ЧЕРЕПА сдудентам занятие
АНАТОМИЯ ЧЕРЕПА сдудентам занятие Презентация "Копилка. Психологические особенности накопления денег в подростковом возрасте" - скачать презентации по Эконом
Презентация "Копилка. Психологические особенности накопления денег в подростковом возрасте" - скачать презентации по Эконом Лицензирование фармацевтической деятельности
Лицензирование фармацевтической деятельности Почему наша реклама действительно работает.
Почему наша реклама действительно работает. Презентация на тему Обмен жиров в организме
Презентация на тему Обмен жиров в организме McDonalds Logo - презентация
McDonalds Logo - презентация Финансовое и денежно-кредитное регулирование
Финансовое и денежно-кредитное регулирование Stunde
Stunde Системы автоматизированного программирования обработки на станках с ЧПУ их структура и классификация
Системы автоматизированного программирования обработки на станках с ЧПУ их структура и классификация Авторский семинар Варламова П.П., учителя географии и экологии высшей квалификационной категории МБОУ «Кептинская СОШ» по тем
Авторский семинар Варламова П.П., учителя географии и экологии высшей квалификационной категории МБОУ «Кептинская СОШ» по тем Диалектика. Диктатура. Демократия. Сущность, основные характеристики
Диалектика. Диктатура. Демократия. Сущность, основные характеристики Паніровка
Паніровка Дифференциальная диагностика опухолей средостения.
Дифференциальная диагностика опухолей средостения. Презентация "Художественная культура Древней и Средневековой Японии" - скачать презентации по МХК
Презентация "Художественная культура Древней и Средневековой Японии" - скачать презентации по МХК Презентация Европейская валютная система
Презентация Европейская валютная система Ремёсла и украшения древнейших людей
Ремёсла и украшения древнейших людей Основные понятия и определения статики
Основные понятия и определения статики ФОНТАНЫ: история и современность
ФОНТАНЫ: история и современность Государственное регулирование предпринимательской деятельности Выполнил студент 2 курса ФТД группы Т-091 Карпачёв Вячеслав
Государственное регулирование предпринимательской деятельности Выполнил студент 2 курса ФТД группы Т-091 Карпачёв Вячеслав Мир хозяйства в общественном сознании докапиталистических эпох
Мир хозяйства в общественном сознании докапиталистических эпох Определение религии
Определение религии