Содержание
- 2. Термин «воспаление» происходит от латинского слова inflammatio, от греческого слова phlogosis, что условно означает «воспламенение», «жар».
- 3. ВОСПАЛЕНИЕ – это стереотипный, эволюционно сложившийся ответ организма как целого, развивающийся в виде типового патологического процесса
- 5. Воспаление не местный, а «местнотекущий» процесс, формируемый всем организмом (И.И. Мечников)
- 6. Аутохтонность
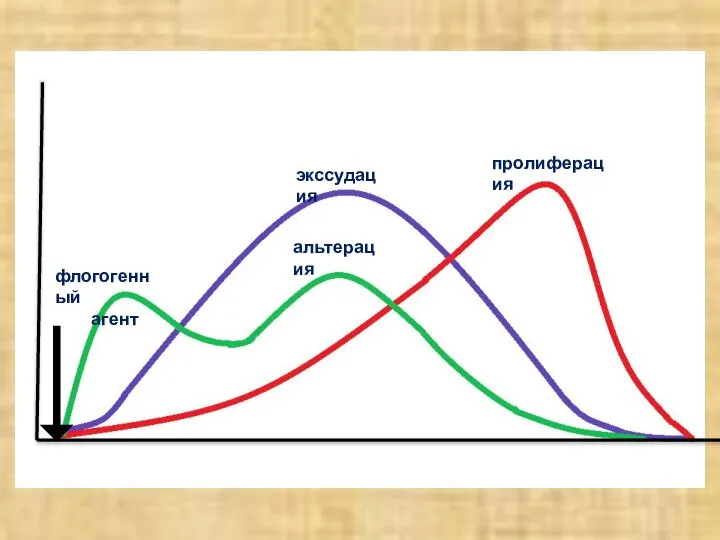
- 7. СТАДИИ ВОСПАЛЕНИЯ Альтерация (повреждение) Экссудация с расстройством микроциркуляции Пролиферация элементов соединительной ткани
- 8. флогогенный агент альтерация пролиферация экссудация
- 9. СХЕМА ПАТОГЕНЕЗА ВОСПАЛЕНИЯ I. Стадия – Альтерации (повреждение) а) первичная; б) вторичная. II. Стадия – Экссудации
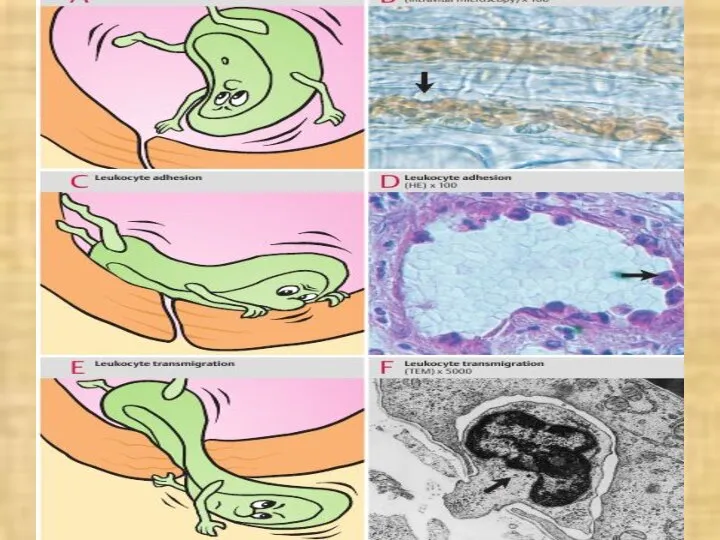
- 10. в) маргинация (margo - край) (краевое стояние) и эмиграция лейкоцитов; г) внесосудистые процессы: 1 – хемотаксис
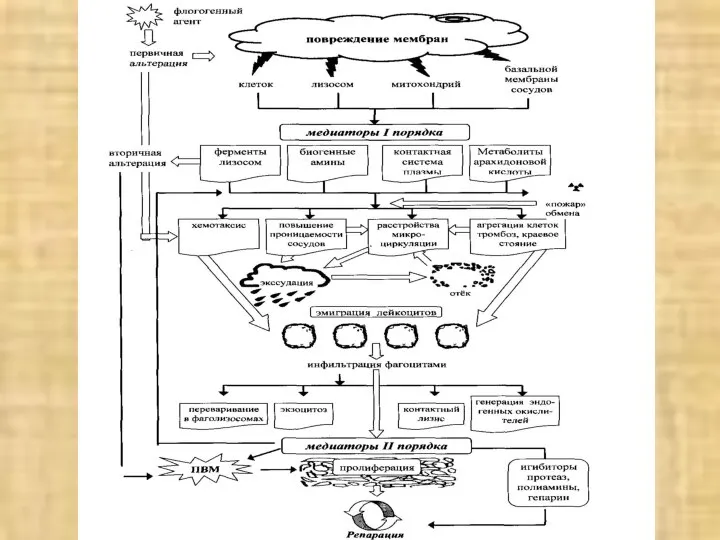
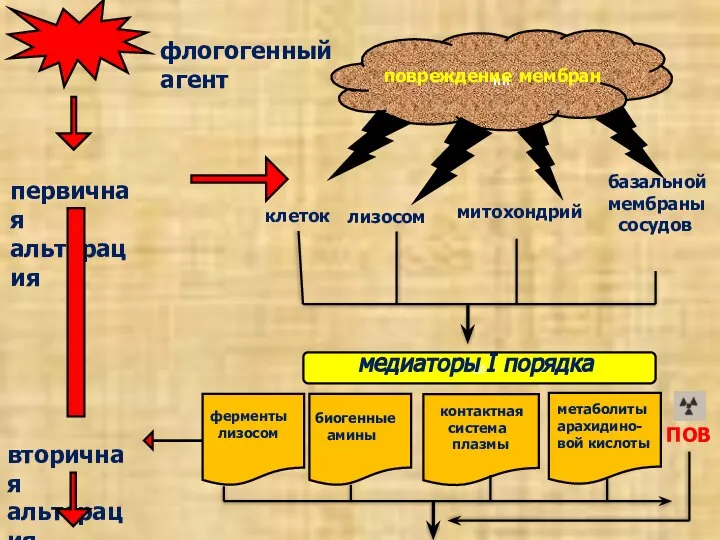
- 12. пп повреждение мембран первичная альтерация вторичная альтерация флогогенный агент клеток лизосом митохондрий базальной мембраны сосудов м
- 13. ГУМОРАЛЬНЫЕ И КЛЕТОЧНЫЕ АГЕНТЫ ВТОРИЧНОЙ АЛЬТЕРАЦИИ. Гуморальные агенты: активные формы кислорода; оксид азота – выделяется макрофагами
- 14. катионные антибиотические белки – действуют до развития ацидоза (ранняя стадия бактерицидного и цитостатического эффекта). К ним
- 15. Клеточные агенты (особенно важны при гиперэргических реакциях замедленного типа): нейтрофильный и макрофагальный фагоцитоз; клеточно-опосредованная цитотоксичность (антителозависимая
- 16. МЕТАБОЛИЧЕСКИЕ ИЗМЕНЕНИЯ В ОЧАГЕ ВОСПАЛЕНИЯ Увеличение интенсивности обменных процессов (2-3 часа – «пожар» обмена) Нарушение обмена
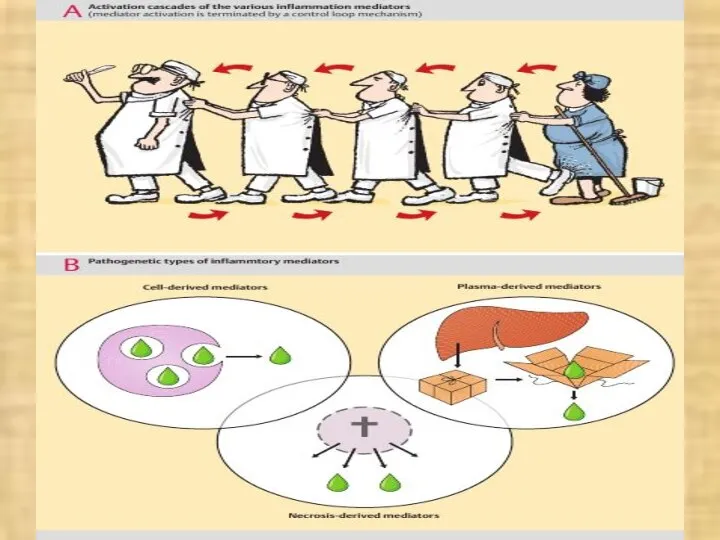
- 17. Динамика развития воспаления связана с образованием и высвобождением его медиаторов. Медиаторы воспаления – это химические вещества,
- 18. МЕДИАТОРЫ ВОСПАЛЕНИЯ ОБЕСПЕЧИВАЮТ: 1. Боль 2. Действие на сосуды: а) изменения тонуса сосудов, б) изменение проницаемости
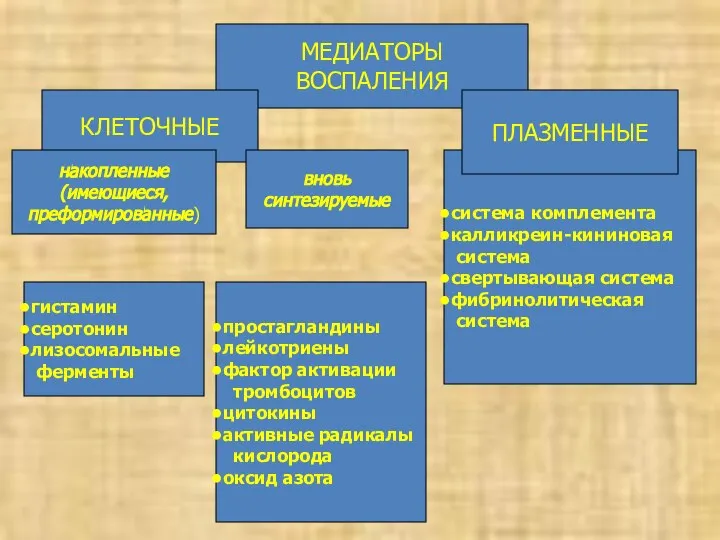
- 19. МЕДИАТОРЫ ВОСПАЛЕНИЯ КЛЕТОЧНЫЕ накопленные (имеющиеся, преформированные) система комплемента калликреин-кининовая система свертывающая система фибринолитическая система ПЛАЗМЕННЫЕ вновь
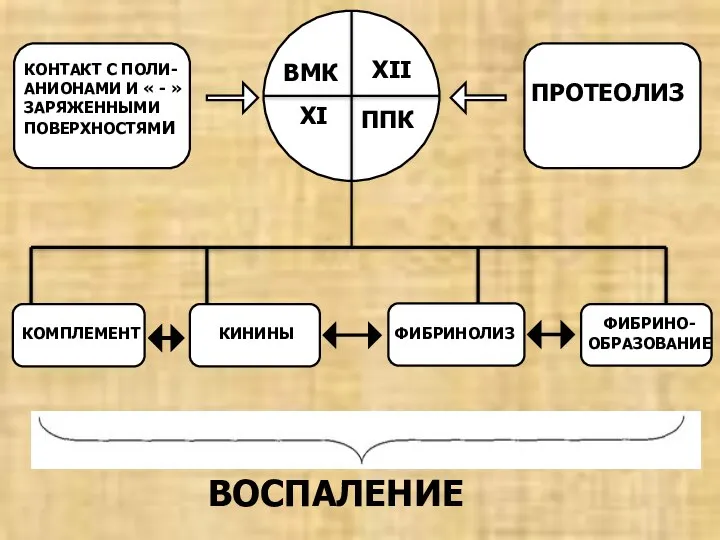
- 20. КОМПЛЕМЕНТ КИНИНЫ ФИБРИНОЛИЗ ФИБРИНО- ОБРАЗОВАНИЕ ВОСПАЛЕНИЕ ВМК ППК XI XII ПРОТЕОЛИЗ КОНТАКТ С ПОЛИ- АНИОНАМИ И
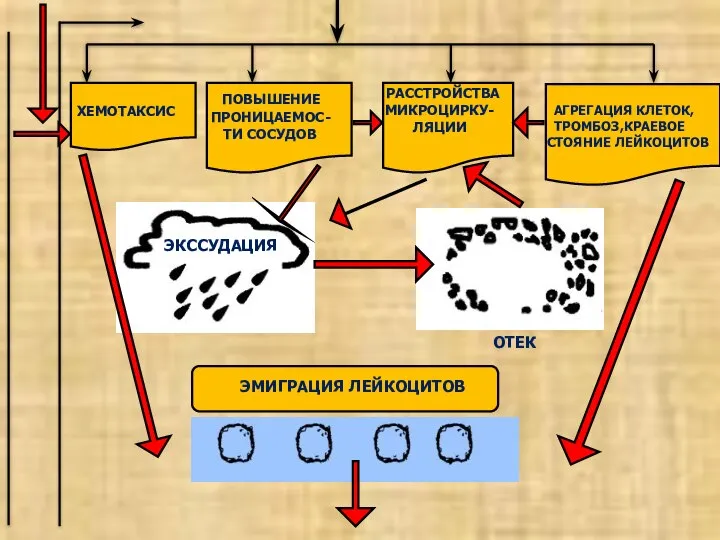
- 21. ХЕМОТАКСИС ПОВЫШЕНИЕ ПРОНИЦАЕМОС- ТИ СОСУДОВ РАССТРОЙСТВА МИКРОЦИРКУ- ЛЯЦИИ АГРЕГАЦИЯ КЛЕТОК, ТРОМБОЗ,КРАЕВОЕ СТОЯНИЕ ЛЕЙКОЦИТОВ ЭКССУДАЦИЯ ОТЕК ЭМИГРАЦИЯ
- 22. СТАДИИ ИЗМЕНЕНИЯ МИКРОЦИРКУЛЯЦИИ В ОЧАГЕ ВОСПАЛЕНИЯ I. Кратковременный спазм артериол Нейрогенный механизм (вазоконстрикция – катехоламины↑) II.
- 23. СТАДИИ ИЗМЕНЕНИЯ МИКРОЦИРКУЛЯЦИИ В ОЧАГЕ ВОСПАЛЕНИЯ III. Диффузная «капиллярная» гиперемия (смешанная гиперемия, воспалительная дилатация капилляров) Дестабилизация
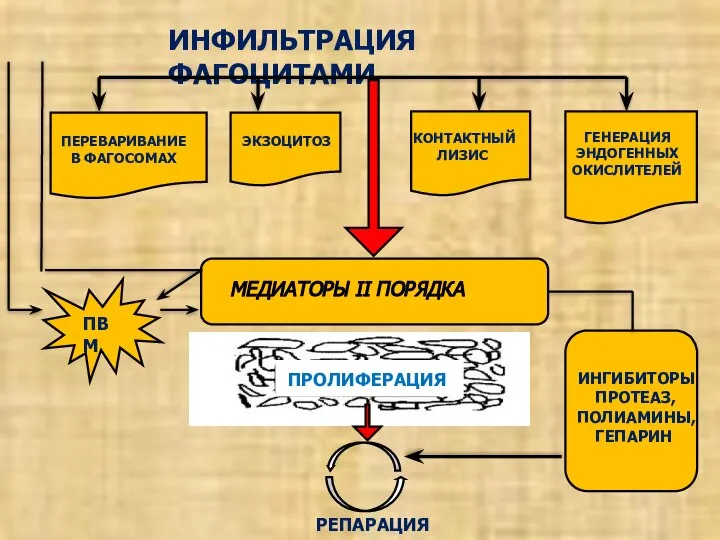
- 25. ИНФИЛЬТРАЦИЯ ФАГОЦИТАМИ ЭКЗОЦИТОЗ КОНТАКТНЫЙ ЛИЗИС ГЕНЕРАЦИЯ ЭНДОГЕННЫХ ОКИСЛИТЕЛЕЙ МЕДИАТОРЫ II ПОРЯДКА ПРОЛИФЕРАЦИЯ ПВМ ИНГИБИТОРЫ ПРОТЕАЗ, ПОЛИАМИНЫ,
- 27. В процессе развития человечества были предложены следующие различные теории происхождения, сущности и значения воспаления Защитная теория
- 28. Сосудистые теории Генле (1846), Брокса (1849) и более известная теория Юлиуса Конгейма (1867) демонстративно показали динамически
- 29. Нервно-трофическая теория Самуэля (1873) и более известная нервно-сосудистая (вазомоторная) теория Г. Риккера (1924), согласно которой первичным
- 30. Воспаление — сложный типовой патологический процесс, который: выработан в процессе эволюции (фило- и онтогенеза); генетически запрограммирован;
- 31. характеризуется динамическими изменениями альтерации, обмена веществ, микроциркуляции с экссудацией, эмиграцией и фагоцитозом лейкоцитов и пролиферации; направлен
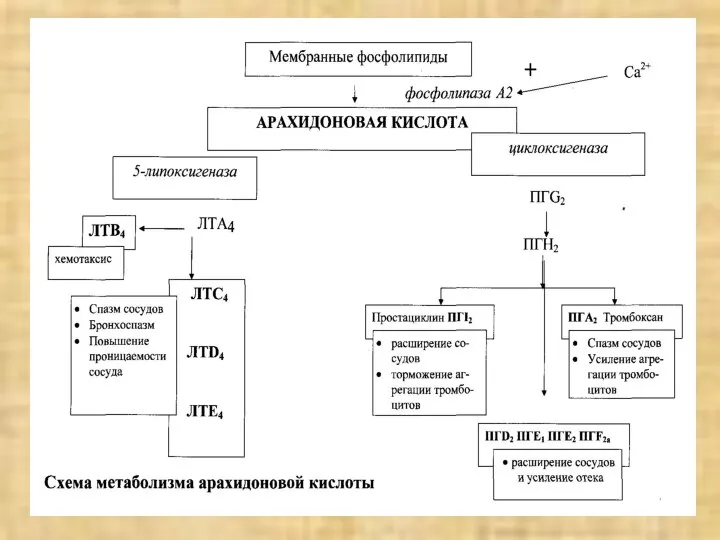
- 32. МЕДИАТОРЫ ВОСПАЛЕНИЯ Если при альтерации плазма крови контактирует с любой полианионной поверхностью (имеющей « – »
- 33. РАЗЛИЧНЫЕ ВИДЫ (ТИПЫ) СОСУДИСТОЙ ПРОНИЦАЕМОСТИ ПРИ ВОСПАЛЕНИИ I тип – ранняя преходящая фаза – развивается до
- 34. ПРИЧИНЫ (условия) формирования хронического экссудативно-деструктивного воспаления (ХЭДВ) I. Факторы, снижающие реактивность организма: Гипо- и авитоминозы, другие
- 35. Все эти условия способствуют продолжению альтерации и экссудации на фоне развернувшихся процессов пролиферации. Сочетание волнообразных острых
- 36. ВОСПАЛЕНИЕ – это типовой патологический процесс – эволюционно-закрепленная, стереотипная защитно-приспособительная реакция целостного организма на локально действующий
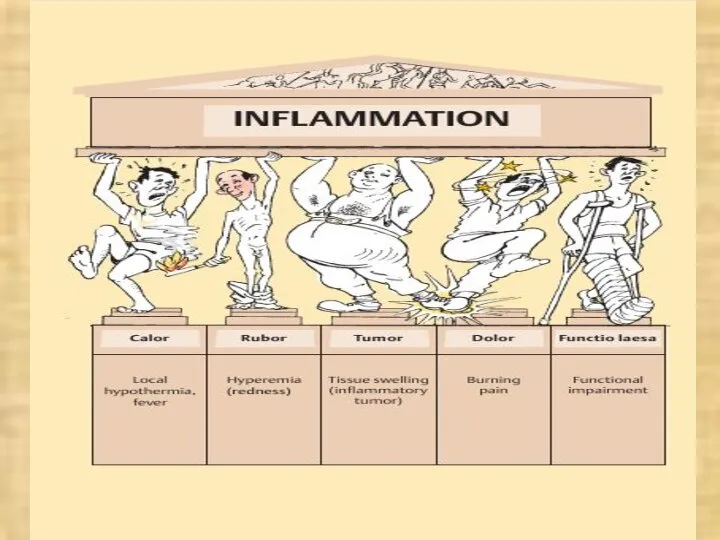
- 37. ПРИЗНАКИ ВОСПАЛЕНИЯ Краснота (rudor) Опухоль (tumor) Жар (calor) Боль (dolor) Нарушение функции (functio laesae)
- 38. ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕ
- 39. ВОСПАЛИТЕЛЬНАЯ РЕАКЦИЯ В ОНТОГЕНЕЗЕ
- 40. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ВОСПАЛЕНИЯ I. Отграничение (изолирование) воспалительного очага от остального организма. Осуществляется путем: замедления и/или остановки
- 41. ПО ВРЕМЕНИ И СТЕПЕНИ РЕАГИРОВАНИЯ НА ПОВРЕЖДЕНИЕ БЕЛКИ ОСТРОЙ ФАЗЫ ПОДРАЗДЕЛЯЮТСЯ НА ТРИ ОСНОВНЫЕ ГРУППЫ: Очень
- 42. ПРИЧИНЫ ДЛИТЕЛЬНОГО ТЕЧЕНИЯ МИВ (мононуклеарного инфекционного воспаления) Продолжительный жизненный цикл макрофагов. Постоянная стимуляция макрофагов лимфоцитами, ИК,
- 43. БЕЛКИ ОСТРОЙ ФАЗЫ с-реактивный белок амилоид А и Р α1-кислый гликопротеин α2-макроглобулин гаптоглобин церулоплазмин антигемофильный глобулин
- 44. СВОЙСТВА БЕЛКОВ ОСТРОЙ ФАЗЫ АНТИОКСИДАНТНОЕ церулоплазмин, амилоид, СРБ, α2-макроглобулин АНТИМИКРОБНОЕ СРБ, лактоферрин, факторы комплемента РЕГУЛЯЦИЯ ГЕМОСТАЗА
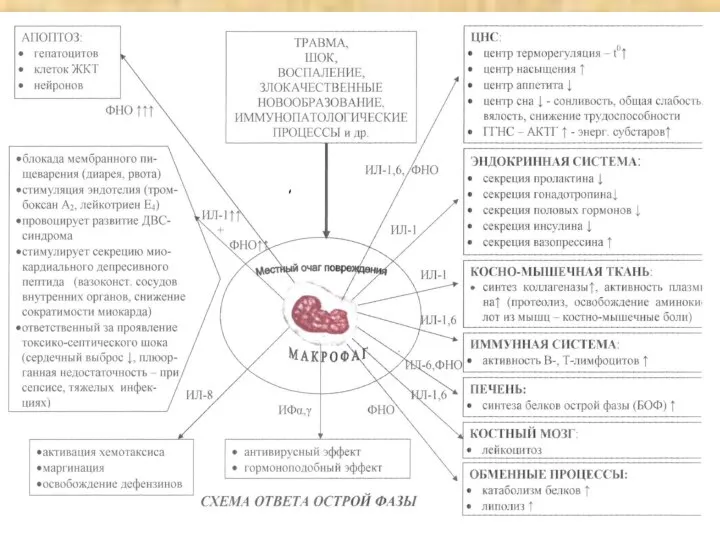
- 45. ОТВЕТ ОСТРОЙ ФАЗЫ ЭТО КОМПЛЕКС ИЗМЕНЕНИЙ, УПРАВЛЯЕМЫХ ЦИТОКИНАМИ, КОТОРЫЙ ВОЗНИКАЕТ ПРИ ВТОРЖЕНИИ В ОРГАНИЗМ ЧУЖЕРОДНЫХ ФАКТОРОВ
- 46. КОМПОНЕНТЫ ОТВЕТА ОСТРОЙ ФАЗЫ (ПРЕДИММУННОГО ОТВЕТА) ЛИХОРАДКА МЕТАБОЛИЧЕСКАЯ ПЕРЕСТРОЙКА ОРГАНИЗМА - увеличенный азотистый распад - интоксикация
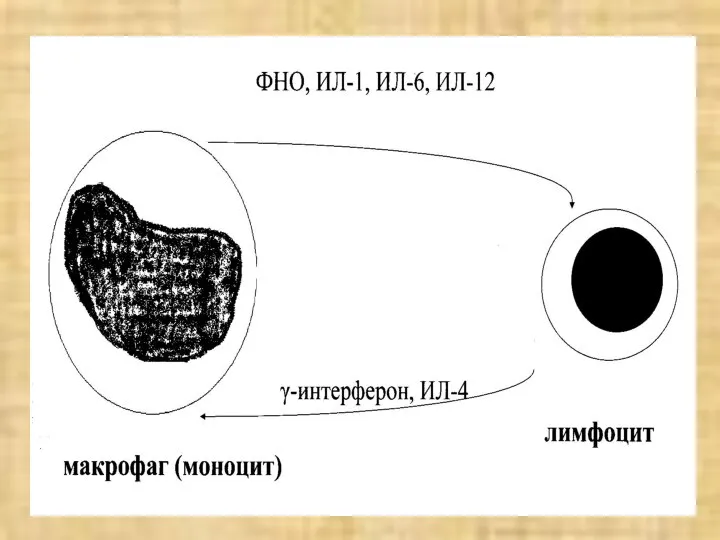
- 47. ЦИТОКИНОВАЯ СЕТЬ СЕМЕЙСТВО ИНТЕРЛЕЙКИНОВ (ИЛ-1 – ИЛ-25…) ИНТЕРФЕРОНЫ (ИФНα, ИФНβ, ИФНγ) ФАКТОРЫ НЕКРОЗА ОПУХОЛЕЙ (ФНОα, ФНОβ)
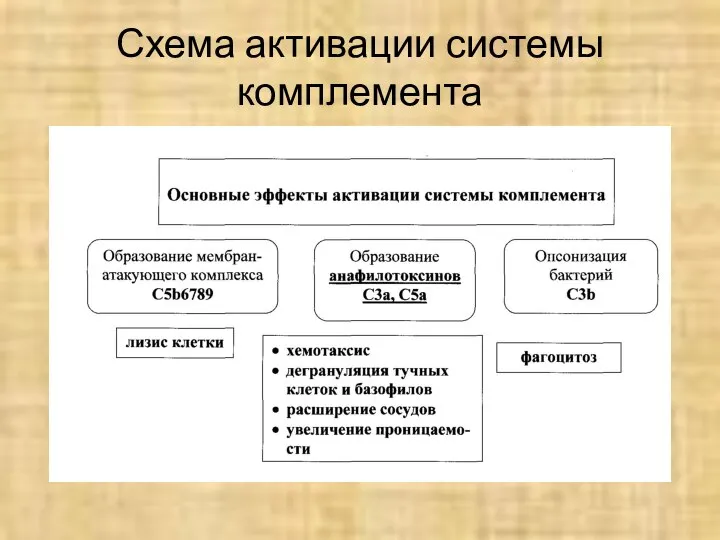
- 50. Схема активации системы комплемента
- 55. Скачать презентацию





































 Для учащихся начальных классов. Внеклассное занятие.
Для учащихся начальных классов. Внеклассное занятие. Focusing ground penetrating radar images with vertical offset filtering
Focusing ground penetrating radar images with vertical offset filtering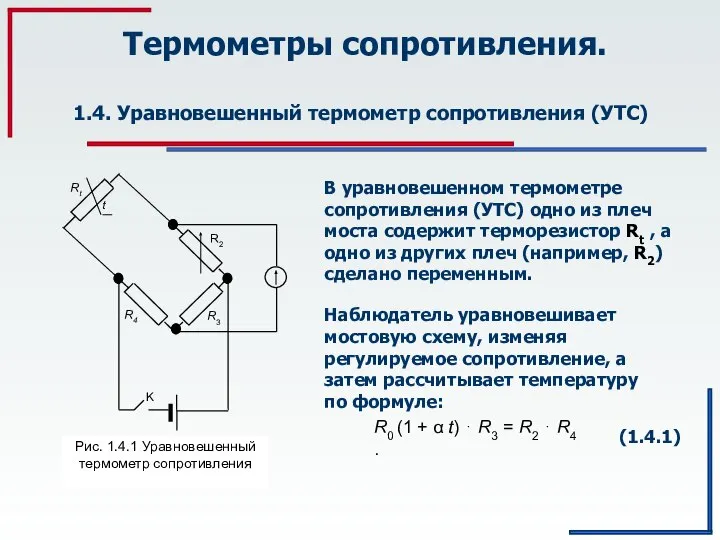 Термометры сопротивления. Уравновешенный термометр сопротивления. (Тема 1.4)
Термометры сопротивления. Уравновешенный термометр сопротивления. (Тема 1.4) Паразитические плоские черви
Паразитические плоские черви Огляд технічного забезпечення комп'ютера
Огляд технічного забезпечення комп'ютера Педагогические Lookи
Педагогические Lookи Концепция аналитического сигнал в радиотехнике
Концепция аналитического сигнал в радиотехнике Иммануил Кант (22 апреля 1724 г.-12 февраля 1804 г.)
Иммануил Кант (22 апреля 1724 г.-12 февраля 1804 г.) Учитель математики и информатики высшей квалификационной категории Учитель математики и информатики высшей квалификационной к
Учитель математики и информатики высшей квалификационной категории Учитель математики и информатики высшей квалификационной к Робота з датчиком кольору
Робота з датчиком кольору Эффективное кодирование
Эффективное кодирование Полуэмпирическая квантовая химия
Полуэмпирическая квантовая химия  Конституционное право России Конституционно-правовой институт правового положения человека и гражданина в Российской Федер
Конституционное право России Конституционно-правовой институт правового положения человека и гражданина в Российской Федер Организация, как система
Организация, как система Что значит быть студентом
Что значит быть студентом Zdrowaś Maryjo
Zdrowaś Maryjo Острые и хронические периодонтиты. Этиология
Острые и хронические периодонтиты. Этиология Типовые контракты в международной торговле
Типовые контракты в международной торговле  Школьный исторический музей. Старая русская деревня
Школьный исторический музей. Старая русская деревня Защита персональных данных
Защита персональных данных Самые необычные праздники мира
Самые необычные праздники мира «Различные действия с дробями»
«Различные действия с дробями» Классный час « Я - Человек» Учитель: Суслина С.Н.
Классный час « Я - Человек» Учитель: Суслина С.Н. Технологическое присоединение к электрическим сетям
Технологическое присоединение к электрическим сетям Управление качеством
Управление качеством Киноафоризмы
Киноафоризмы e713546278c878145075ebcbb0a24
e713546278c878145075ebcbb0a24 A world History of the architecture
A world History of the architecture