Содержание
- 2. Вычислить дефект массы и энергию связи при образовании атома гелия , если его масса равна 4,0026
- 3. Природный магний состоит из трех изотопов 24Мg, 25Мg и 26Мg. Вычислить атомную массу элемента, если содержание
- 4. В человеческом организме в общей сложности содержится примерно 25 мг иода (входящего в состав различных соединений),
- 5. Основные формулы Атом водорода Модель Бора rB n= n2·0,53·10-10 (м) Еn= - 2,18·10-18 /n2 (Дж) Ефот
- 6. Задачи по теме Вычислить длину волны света, поглощаемого атомом водорода при переходе из основного состояния на
- 7. Вычислить скорость движения электрона в атоме водорода на второй боровской орбите. Вычислить энергию ионизации атома водорода,
- 8. Напишите электронные конфигурации элементов N, O, Al, Si, Ca, Br, Sb, Ge, K, In в основном
- 9. Основные формулы Массовая доля элемента А в веществе АхВу ω = х·Аr(А) / Мr(АхВу) Диссоциация химических
- 10. Задачи по теме Определить простейшую формулу вещества, в состав которого входят натрий (29,11 %), сера (40,51
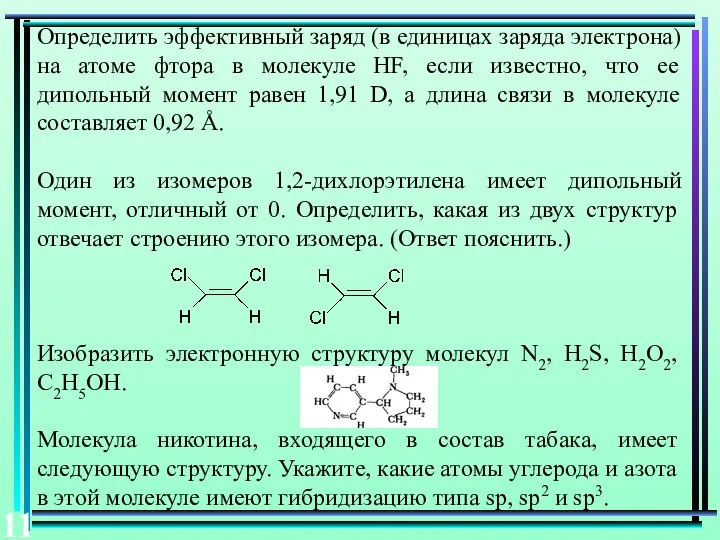
- 11. Определить эффективный заряд (в единицах заряда электрона) на атоме фтора в молекуле HF, если известно, что
- 12. Предскажите геометрическое строение молекул CF4, H2CO, CS2, используя представления о гибридизации атома С. Рассчитать энергию образования
- 13. Основные формулы Законы Бойля-Мариотта, Гей-Люссака, Шарля p1V1 = p2V2 (T – const); V1/V2 = T1/T2 (p
- 14. Задачи по теме Температура азота в газовом баллоне под давлением 12,5 МПа равна 17 ºС. Предельное
- 15. До какой температуры при атмосферном давлении нужно нагреть азот, чтобы масса 1 л газа составила 1
- 16. Газовая смесь составлена из 2 л водорода (р=91 кПа) и 5 л метана (р=112 кПа). Суммарный
- 17. Основные формулы Выход химической реакции η = 100% · ni / (ni)теор Константа равновесия Кс Степень
- 18. Задачи по теме Сколько литров водорода выделится при взаимодействии 1 кг цинка с соляной кислотой (при
- 19. При некоторой температуре для реакции 2СО + О2 ←⎯→ 2СО2 равновесные концентрации газов равны соответственно: С̃(СО)
- 20. Вычислить рН в 0,01 М растворе НF (Ка = 7,4·10-4). Чему равен рН 0,005 M раствора
- 21. Основные формулы Уравнение Нернста Е (МN+/М) = Еº + (RT/NF) · ln С(МN+) ЭДС гальванического элемента
- 22. Потенциал медного электрода, помещенного в раствор его же соли, при температуре 298 К составил 0,345 В.
- 23. Рассчитать (при стандартных условиях) тепловой эффект реакции CH4 (г.) + 4Cl2 (г.) ⎯→ CCl4 (г.) +
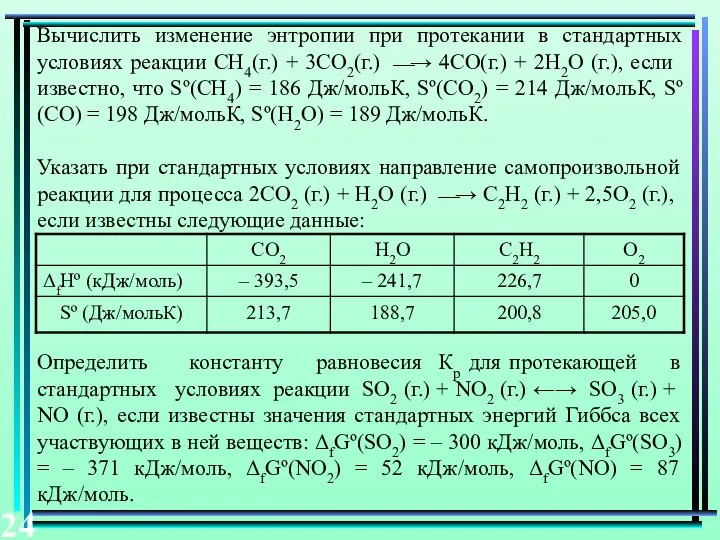
- 24. Вычислить изменение энтропии при протекании в стандартных условиях реакции СН4(г.) + 3СО2(г.) ⎯→ 4СО(г.) + 2Н2О
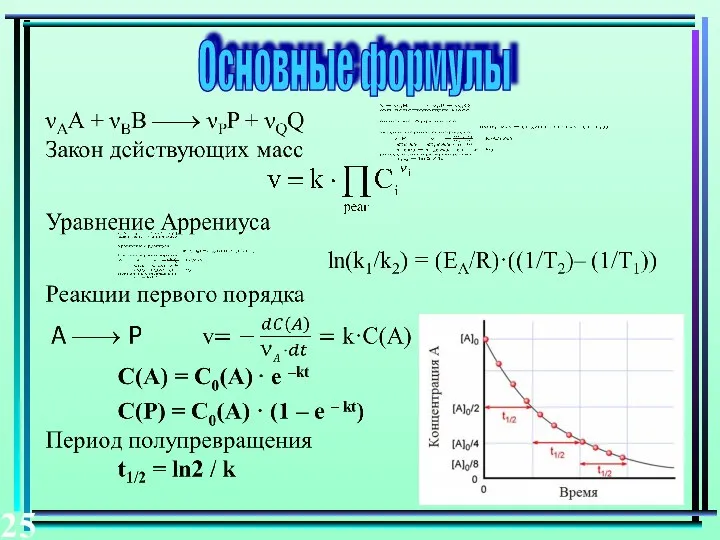
- 25. Основные формулы 25
- 26. Задачи по теме Как изменится скорость реакции 2CO + O2 ⎯→ 2CO2, если концентрации исходных веществ
- 28. Скачать презентацию






















 Физика колебаний и волн. Спектральное разложение света. (Лекция 4)
Физика колебаний и волн. Спектральное разложение света. (Лекция 4) Дифракция электромагнитной волны
Дифракция электромагнитной волны Технология ремонта и монтаж судового распределительного дизеля 6ЧН15/18
Технология ремонта и монтаж судового распределительного дизеля 6ЧН15/18 Сила Лоренца
Сила Лоренца Решение задач на формулу плотности
Решение задач на формулу плотности Удивительный мир научных книг. Виталий Исаакович Рыдник «Многоцветье спектров»
Удивительный мир научных книг. Виталий Исаакович Рыдник «Многоцветье спектров» Физика – фундаментальная наука о природе
Физика – фундаментальная наука о природе Расчет сопротивления проводника. Удельное сопротивление
Расчет сопротивления проводника. Удельное сопротивление Применение энергии атома
Применение энергии атома Физические основы действия ионизирующих излучений на организм
Физические основы действия ионизирующих излучений на организм Приготовление растворов с определённой массовой долей растворённого вещества
Приготовление растворов с определённой массовой долей растворённого вещества Элементы специальной теории относительности (СТО). Релятивистская кинематика
Элементы специальной теории относительности (СТО). Релятивистская кинематика Расчет КИХ-фильтров с окном Кайзера
Расчет КИХ-фильтров с окном Кайзера Сверхпроводимость. (Лекция 10)
Сверхпроводимость. (Лекция 10) Вариатор. Что такое вариатор?
Вариатор. Что такое вариатор? Презентация по физике "Реальные газы и жидкости" - скачать
Презентация по физике "Реальные газы и жидкости" - скачать  Конденсатор. Электроёмкость
Конденсатор. Электроёмкость Презентация по физике "Механическая работа. Единицы работы" - скачать
Презентация по физике "Механическая работа. Единицы работы" - скачать  Причины не включения компрессора на электропоезде ЭТ2М
Причины не включения компрессора на электропоезде ЭТ2М Общая теория относительности. (Часть 4)
Общая теория относительности. (Часть 4) Молекулярная физика
Молекулярная физика  Презентация по физике "Электронагревательные приборы" - скачать
Презентация по физике "Электронагревательные приборы" - скачать  Давление газа
Давление газа Магнит өрісі
Магнит өрісі Особенности конструкции гоночных автомобилей класса Формула 1
Особенности конструкции гоночных автомобилей класса Формула 1 Фазированные антенные решетки и их назначение. Задача адаптации в общем виде
Фазированные антенные решетки и их назначение. Задача адаптации в общем виде Реостат. Решение задач вариантов ОГЭ аналитически и экспериментально (8 класс)
Реостат. Решение задач вариантов ОГЭ аналитически и экспериментально (8 класс) Агрегатні стани речовини. Фізичні властивості тіл у різних агрегатних станах. Кристалічні та аморфні тіла
Агрегатні стани речовини. Фізичні властивості тіл у різних агрегатних станах. Кристалічні та аморфні тіла