Содержание
- 2. Аффинная хроматография Аффинная хроматография (АХ) представляет собой метод разделения биологических молекул, который основан на различии не
- 3. Механизм разделения в АХ а – иммобилизация лиганда (ковалентно); б –связывание целевого вещества (нековалентно) и удаление
- 4. Проведение процесса хроматографии В аффинной хроматографии выделяют две фазы: подвижной фазой служит жидкость, неподвижной фазой может
- 5. Неподвижная фаза Неподвижная фаза в аффинной хроматографии представляет собой специально получаемый сорбент, построенный обычно по схеме:
- 6. Подвижная фаза Подвижная фаза аффинной хроматографии должна: обладать низкой вязкостью; обеспечивать необходимый уровень селективности; быть дешевой;
- 7. Лиганды, используемые в АХ Выбор лиганда для аффинной хроматографии зависит от двух факторов: лиганд должен обладать
- 8. Сорбенты, используемые в АХ Матрица является инертным носителем, с которым лиганд может быть ковалентно или не
- 9. Разрушение аффинной связи Аффинную связь вещества с сорбентом можно нарушить либо: путем создания неблагоприятных для биоспецифического
- 10. Аппаратурное оформление процесса Современный жидкостной хроматограф включает емкости для элюентов, насосы высокого давления, дозатор, хроматографическую колонку,
- 11. Некоторые белки, разделяемые АХ Иммуноглобулины Разнообразие антиген – антитело взаимодействий создало множество приложений для антител и
- 13. Скачать презентацию










 Серебра нитрат и другие препараты серебра. Ртути окись желтая
Серебра нитрат и другие препараты серебра. Ртути окись желтая Полимер. Использование и вред
Полимер. Использование и вред Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов
Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов :Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Ферменттердің әсер ету ерекшеліктері
:Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Ферменттердің әсер ету ерекшеліктері Щелочноземельные металлы Учитель МОУ СОШ № 130 Разнополова О.П.
Щелочноземельные металлы Учитель МОУ СОШ № 130 Разнополова О.П. Презентация по Химии "Мило" - скачать смотреть бесплатно
Презентация по Химии "Мило" - скачать смотреть бесплатно Аналитическая химия
Аналитическая химия Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и ма
Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и ма Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Свойства изомеров. Курсовая работа
Свойства изомеров. Курсовая работа Спирти. Класифікація спиртів
Спирти. Класифікація спиртів Реакции, которые необходимо знать выпускнику средней школы, сдающему ЕГЭ по химии
Реакции, которые необходимо знать выпускнику средней школы, сдающему ЕГЭ по химии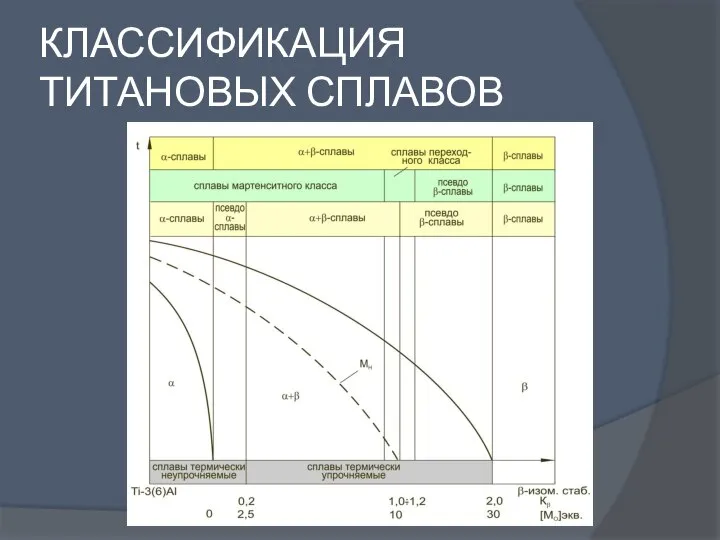 Классификация титановых сплавов
Классификация титановых сплавов Происхождение химических элементов
Происхождение химических элементов Етанол (етиловий спирт, винний спирт)
Етанол (етиловий спирт, винний спирт) История открытия натурального каучука
История открытия натурального каучука Свойства и классификация нефти
Свойства и классификация нефти Масляная кислота
Масляная кислота Алканы. Получение. Применение
Алканы. Получение. Применение Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов
Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов Лекарственные средства
Лекарственные средства  Метаболизм липидов
Метаболизм липидов Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Электрохимические методы
Электрохимические методы Галогены. Галогеноводороды
Галогены. Галогеноводороды Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Окислительно-восстановительные реакции с участием органических веществ
Окислительно-восстановительные реакции с участием органических веществ Крахмал. Физические свойства
Крахмал. Физические свойства