Содержание
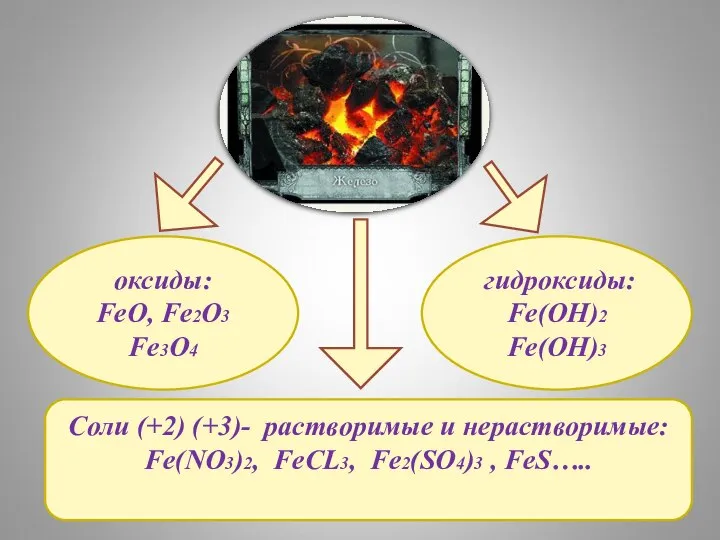
- 2. Соли (+2) (+3)- растворимые и нерастворимые: Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS….. оксиды: FeO, Fe2O3 Fe3O4 гидроксиды:
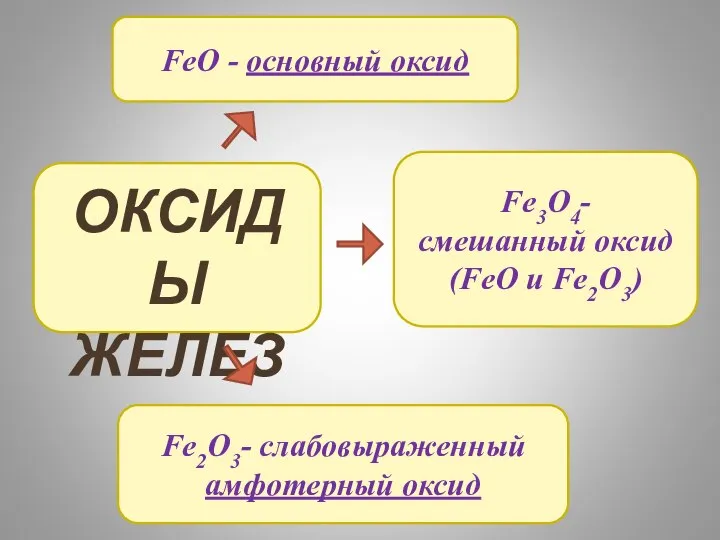
- 3. ОКСИДЫ ЖЕЛЕЗА FeO - основный оксид Fe2O3- слабовыраженный амфотерный оксид Fe3O4- смешанный оксид (FeO и Fe2O3)
- 4. Химические свойства FeO с кислотами: FeO + 2HCL=FeCL2 + H2O 2) с более активными металлами: 3FeO
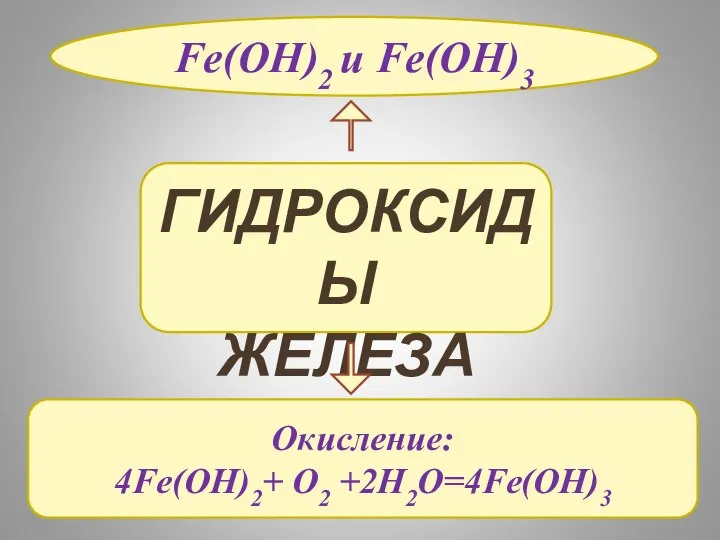
- 5. ГИДРОКСИДЫ ЖЕЛЕЗА Fe(OH)2 и Fe(OH)3 Окисление: 4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
- 6. Fe(OH)2 и Fe(OH)3 Fe(OH)3 реагирует с конц. щелочами Fe(OH)3 + 3NaOH=Na3[Fe(OH)6] 1)Реагируют с кислотами: Fe(OH)2 +
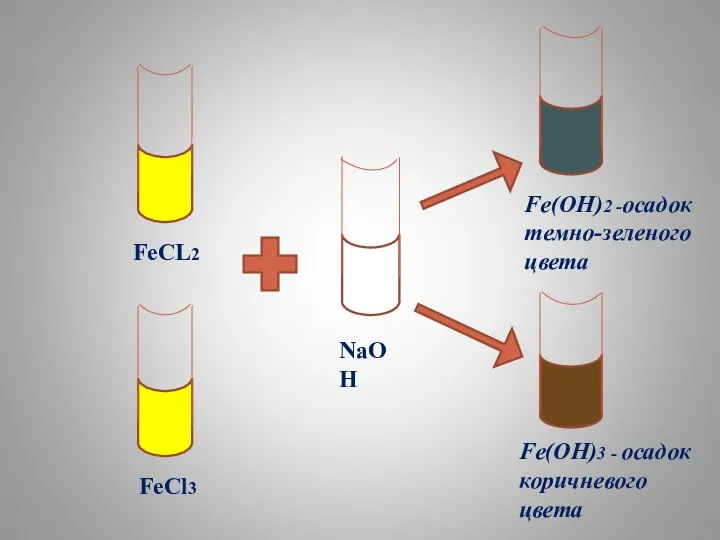
- 7. СОЛИ ЖЕЛЕЗА Реагируют с щелочами: FeCL2 + 2NaOH= Fe(OH)2 + 2 NaCL Реагируют с более активными
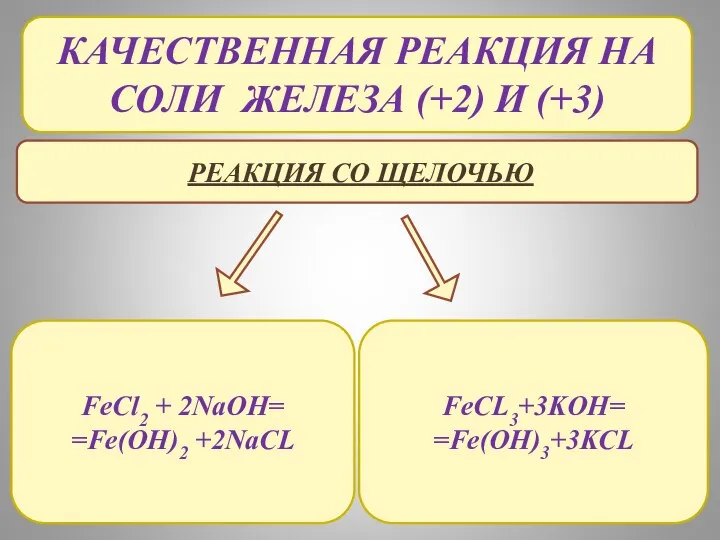
- 8. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СОЛИ ЖЕЛЕЗА (+2) И (+3) РЕАКЦИЯ СО ЩЕЛОЧЬЮ FeCl2 + 2NaOH= =Fe(OH)2 +2NaCL
- 9. FeCL2 FeCl3 NaOH Fe(OH)2 -осадок темно-зеленого цвета Fe(OH)3 - осадок коричневого цвета
- 11. Скачать презентацию

![Fe(OH)2 и Fe(OH)3 Fe(OH)3 реагирует с конц. щелочами Fe(OH)3 + 3NaOH=Na3[Fe(OH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/676329/slide-5.jpg)

 Химия: основные законы
Химия: основные законы Оптическая литография
Оптическая литография Урок по химии в 11 классе. Провела Миронова О.А. МОУ Памятская СОШ.
Урок по химии в 11 классе. Провела Миронова О.А. МОУ Памятская СОШ. Знаки химических элементов
Знаки химических элементов Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Секреты химии. Проект Радуга
Секреты химии. Проект Радуга Исторические картины В. И. Сурикова
Исторические картины В. И. Сурикова Название работы: «Выращивание кристаллов из водного раствора методом охлаждения »
Название работы: «Выращивание кристаллов из водного раствора методом охлаждения » Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Буровые растворы на углеродной основе
Буровые растворы на углеродной основе Биоэнергетика. Энергетическое сопряжение
Биоэнергетика. Энергетическое сопряжение Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Защита полимеров от старения
Защита полимеров от старения Химические свойства хрома
Химические свойства хрома План розміщення добрив у польовій сівозміні. (Лабораторна робота 22)
План розміщення добрив у польовій сівозміні. (Лабораторна робота 22) Химическое образование в современной средней (полной) общеобразовательной школе
Химическое образование в современной средней (полной) общеобразовательной школе Склад нафти Підготувала: Учениця 11 – Б, Костенко Еліна
Склад нафти Підготувала: Учениця 11 – Б, Костенко Еліна  Основные этапы развития химии комплексных соединений Лектор: канд. хим. наук, ст. преп. Камиль Абрарович Сагдеев
Основные этапы развития химии комплексных соединений Лектор: канд. хим. наук, ст. преп. Камиль Абрарович Сагдеев Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Фiзико-хімічні основи розвитку пожеж. Тепломасообмін, температурний режим пожежі в огородженні. (Розділ 4.13.5)
Фiзико-хімічні основи розвитку пожеж. Тепломасообмін, температурний режим пожежі в огородженні. (Розділ 4.13.5) Ароматические углеводороды
Ароматические углеводороды Угольная кислота и ее соли
Угольная кислота и ее соли Ферменттер. Ферменттердің жалпы қасиеттері. Ферменттердің жіктелуі мен номенклатурасы
Ферменттер. Ферменттердің жалпы қасиеттері. Ферменттердің жіктелуі мен номенклатурасы Решение задач на примере идеальных моделей химических реакторов различного типа для гомогенных процессов
Решение задач на примере идеальных моделей химических реакторов различного типа для гомогенных процессов Chemistry quiz
Chemistry quiz Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста
Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста Робота учня 11-В класу: Андрійка Андрія
Робота учня 11-В класу: Андрійка Андрія