Содержание
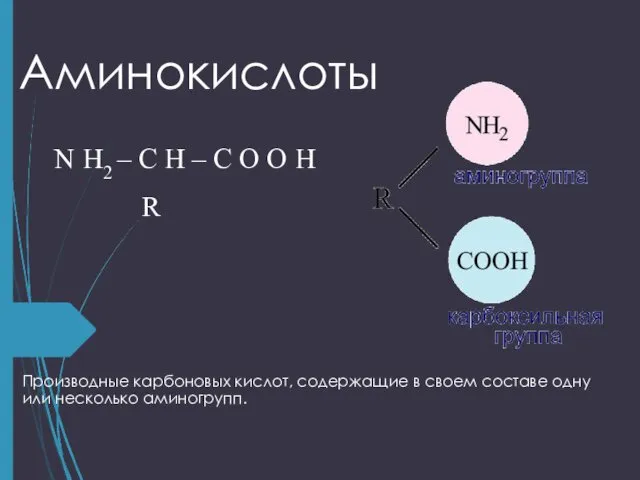
- 2. Аминокислоты Производные карбоновых кислот, содержащие в своем составе одну или несколько аминогрупп. N H2 – C
- 3. Аминокислоты Природные Их около 300, они были обнаружены в живых организмах, 20 из них входят в
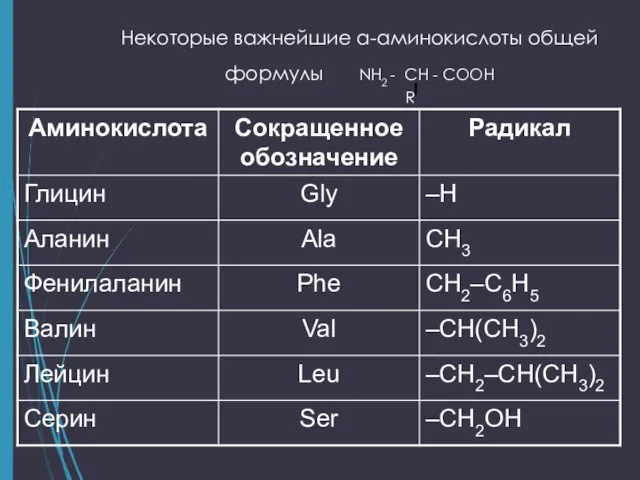
- 4. Некоторые важнейшие α-аминокислоты общей формулы NH2 - CH - COOH R
- 5. Номенклатура По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием
- 6. Номенклатура Часто используется другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется
- 7. Номенклатура Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три
- 8. Номенклатура Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
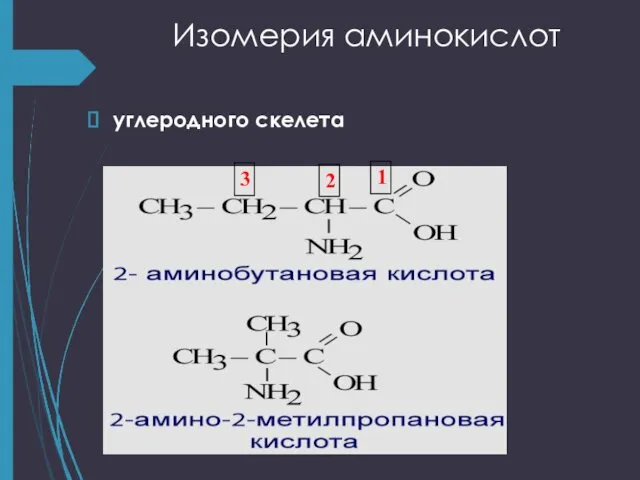
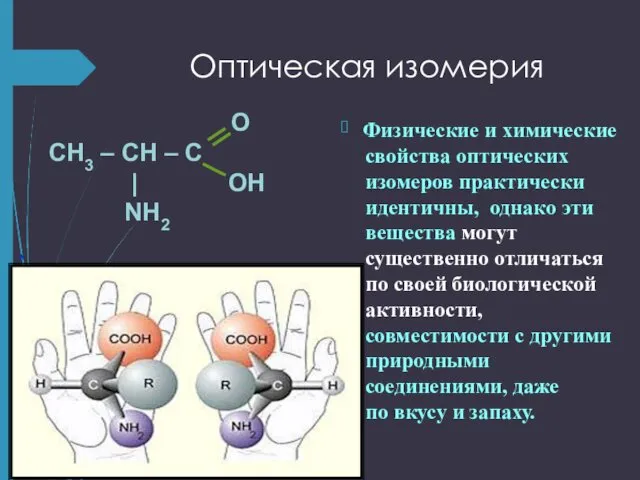
- 9. Изомерия аминокислот углеродного скелета ; положения функциональных групп межклассовая (сложные эфиры); оптическая.
- 10. Изомерия аминокислот углеродного скелета 1 2 3
- 11. Изомерия аминокислот положения функциональных групп
- 12. Оптическая изомерия O CH3 – CH – C | OH NH2 Физические и химические свойства оптических
- 13. Оптическая изомерия Аминокислоты относят к D- или L- ряду. Если в стандартной проекции Фишера (карбоксильная группа
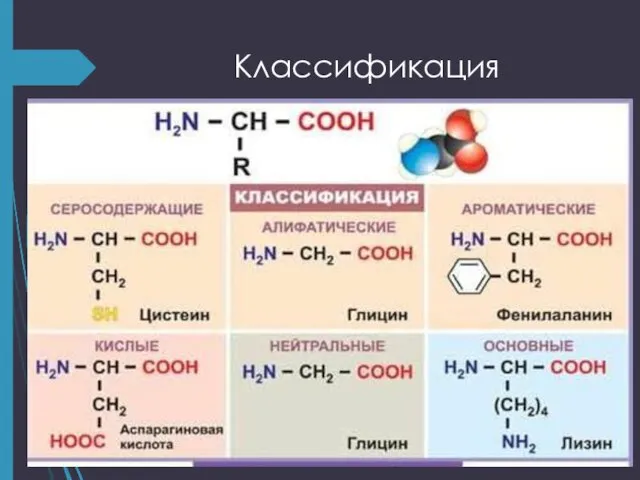
- 14. Классификация
- 15. Физические свойства Аминокислоты бесцветные; кристаллические; хорошо растворимы в воде, но нерастворимы в эфире; в зависимости от
- 16. Химические свойства Наличие амино- и карбоксильной групп определяет двойственность химических свойств аминокислот. Амфотерность (от греч. amphуteros
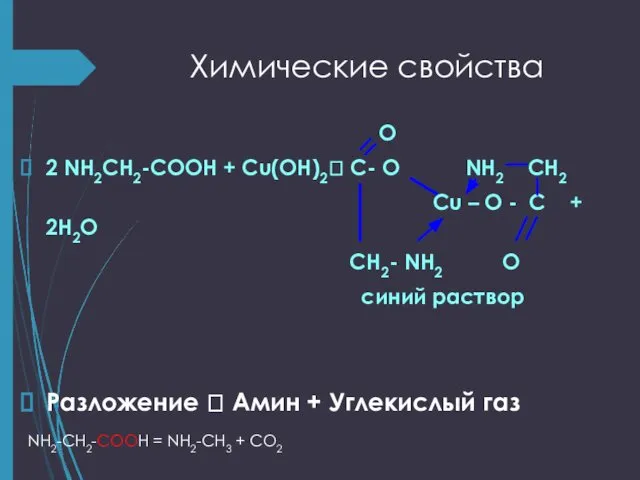
- 17. Химические свойства Аминокислота +Аминокислота + Cu(OH)2 синий раствор
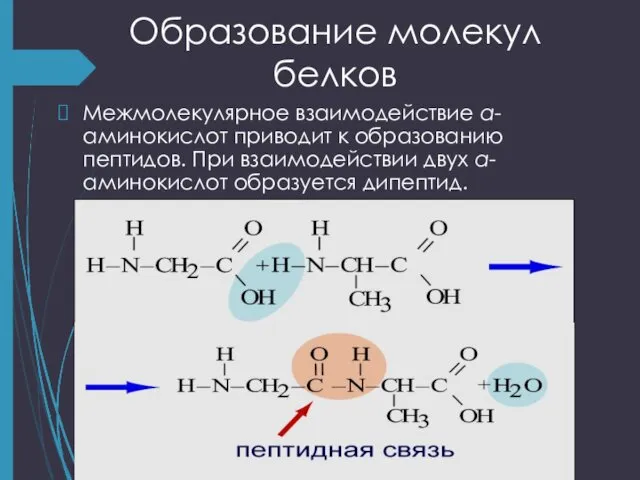
- 18. Образование молекул белков Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид.
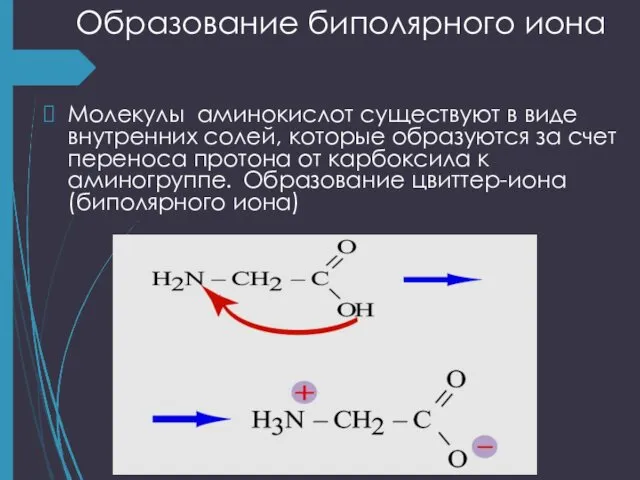
- 19. Образование биполярного иона Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона
- 20. Химические свойства O 2 NH2CH2-COOH + Cu(OH)2? C- O NH2 CH2 Cu – O - C
- 21. Химические свойства С основаниями → образуются соли: NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O натриевая соль
- 22. Химические свойства Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам
- 23. . С сильными кислотами → соли: HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl С азотистой кислотой: NH2-CH2-COOH +
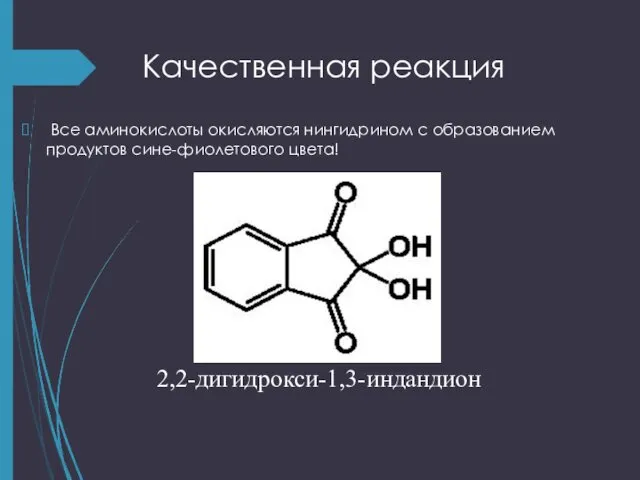
- 24. Качественная реакция Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета! 2,2-дигидрокси-1,3-индандион
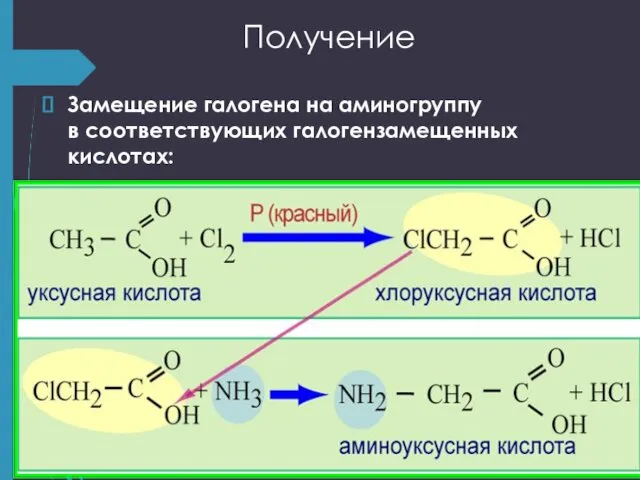
- 25. Получение Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- 26. Получение аминокислот Присоединение аммиака к α, β-непредельным кислотам с образованием β-аминокислот: CH2=CH–COOH + NH3 H2N–CH2–CH2–COOH
- 27. Получение аминокислот Гидролиз белков (пептидов) CH2-CO-NH-CH-COOH + H2O ↔ CH2-COOH + CH3-CH-COOH │ │ │ │
- 29. Скачать презентацию













![. С сильными кислотами → соли: HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/488637/slide-22.jpg)


 Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Гидролиз органических веществ
Гидролиз органических веществ Алюминий и его соединения
Алюминий и его соединения Багатоатомні спирти
Багатоатомні спирти  Оксосоединения: альдегиды и кетоны
Оксосоединения: альдегиды и кетоны Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Окислительно-восстановительные потенциалы (электродные потенциалы)
Окислительно-восстановительные потенциалы (электродные потенциалы) Растительное сырье содержащее флавоноиды
Растительное сырье содержащее флавоноиды Зат алмасу
Зат алмасу НАФТА РОБОТА УЧЕНИЦІ 11-А КЛАСУ КУЦАН НАТАЛІЇ
НАФТА РОБОТА УЧЕНИЦІ 11-А КЛАСУ КУЦАН НАТАЛІЇ  Основное уравнение молекулярно-кинетической теории
Основное уравнение молекулярно-кинетической теории Душистые вещества животного и растительного происхождения
Душистые вещества животного и растительного происхождения Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Презентация на тему Экологические проблемы Казахстана
Презентация на тему Экологические проблемы Казахстана  Галогены. Их роль в нашей жизни
Галогены. Их роль в нашей жизни Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.
Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.  Рецепты литературы в химических опытах
Рецепты литературы в химических опытах Химический состав молока
Химический состав молока The Shapes of Molecules
The Shapes of Molecules Химия плутония, америция и трансамерициевых актиноидов
Химия плутония, америция и трансамерициевых актиноидов Презентация по Химии "Молочная кислота" - скачать смотреть _
Презентация по Химии "Молочная кислота" - скачать смотреть _ Металл вольфрам
Металл вольфрам ООО «Ангарский Азотно-туковый завод». Основы производства аммиака
ООО «Ангарский Азотно-туковый завод». Основы производства аммиака Графическое представление газовых процессов. (10 класс)
Графическое представление газовых процессов. (10 класс) Презентация по Химии "Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева" - скачать смотреть
Презентация по Химии "Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева" - скачать смотреть  Презентация по Химии "Кислотные дожди" - скачать смотреть
Презентация по Химии "Кислотные дожди" - скачать смотреть  SVOJSTVA (1)
SVOJSTVA (1)