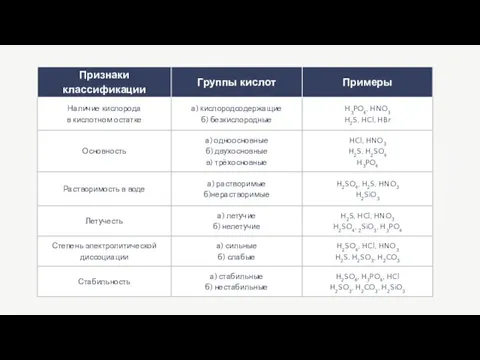
Содержание
- 4. Взаимодействие кислот с металлами 2Al + 6HCl = 2AlCl3 + 3H2↑
- 6. Взаимодействие концентрированной серной кислоты с медью 2H2SO4 (конц.) + Cu = CuSO4 + SO2↑ + 2H2O
- 8. Особенности взаимодействия азотной кислоты с металлами Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2↑ + 3H2O Концентрированная
- 9. Концентрированная азотная кислота не взаимодействует с благородными металлами — золотом и платиной, а также при низких
- 10. Особенности взаимодействия азотной кислоты с металлами NO, N2O, N2, NH4NO3 Разбавленная азотная кислота при взаимодействии с
- 11. Взаимодействие кислот с основными и амфотерными оксидами H2SO4 + CaO = CaSO4 + H2O При взаимодействии
- 12. Взаимодействие кислот с основаниями и амфотерными гидроксидами HCl + KOH = KCl + H2O При взаимодействии
- 13. Кислоты взаимодействуют с солями, в результате чего образуются новая соль и новая кислота. Однако для протекания
- 14. Взаимодействие кислот с солями AgNO3 + HCl = AgCl↓ + HNO3 При взаимодействии нитрата серебра с
- 15. Взаимодействие кислот с солями 2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2↑ При взаимодействии азотной
- 17. Скачать презентацию













 Химия в медицине
Химия в медицине Органическая химия: Жиры
Органическая химия: Жиры Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Железо и его соединения
Железо и его соединения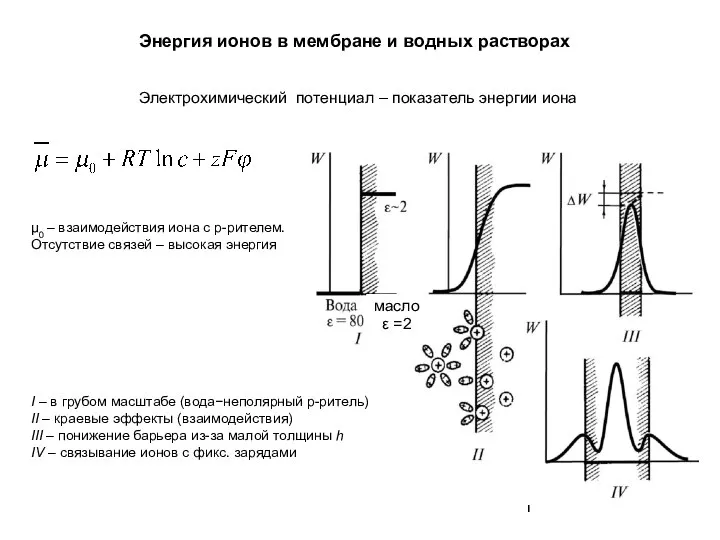 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Крым и Россия «Мы вместе»
Крым и Россия «Мы вместе»  Успехи естественных наук XIX века
Успехи естественных наук XIX века Mechanika płynów
Mechanika płynów Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер
Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер Многоатомные спирты
Многоатомные спирты Презентация по Химии "Сильнодіючі отруйні речовини: поняття та класифікація." - скачать смотреть бесплатно
Презентация по Химии "Сильнодіючі отруйні речовини: поняття та класифікація." - скачать смотреть бесплатно Введение в высокопроизводительное секвенирование
Введение в высокопроизводительное секвенирование Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий Презентацию подготовила: Учитель химии высшей категории Отрошко Елена Александровна МОУ СОШ № 6 Ст. Старотитаровской Темрюкс
Презентацию подготовила: Учитель химии высшей категории Отрошко Елена Александровна МОУ СОШ № 6 Ст. Старотитаровской Темрюкс Культивирование растительных и животных клеток
Культивирование растительных и животных клеток Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Соли. Названия солей
Соли. Названия солей Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Каталитический риформинг
Каталитический риформинг Электролиз Цель: изучить сущность процесса электролиза Задачи: раскрыть принцип работы электролизёра суть катодных и анодных
Электролиз Цель: изучить сущность процесса электролиза Задачи: раскрыть принцип работы электролизёра суть катодных и анодных  Химические свойства хрома
Химические свойства хрома Количество вещества. 8 класс
Количество вещества. 8 класс Ізотопи і нукліди
Ізотопи і нукліди Электролитическая диссоциация уксусной и муравьиной кислоты
Электролитическая диссоциация уксусной и муравьиной кислоты Brain элементтері
Brain элементтері Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Неметаллы 9 класс
Неметаллы 9 класс Методика расчета горения топлива
Методика расчета горения топлива