Содержание
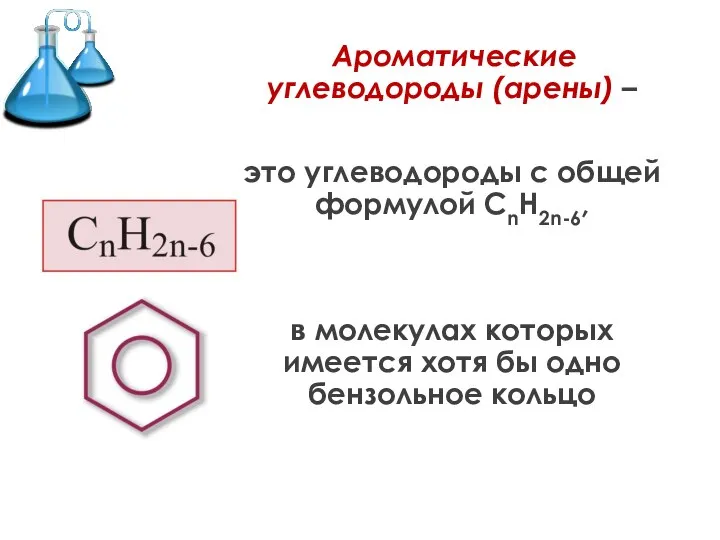
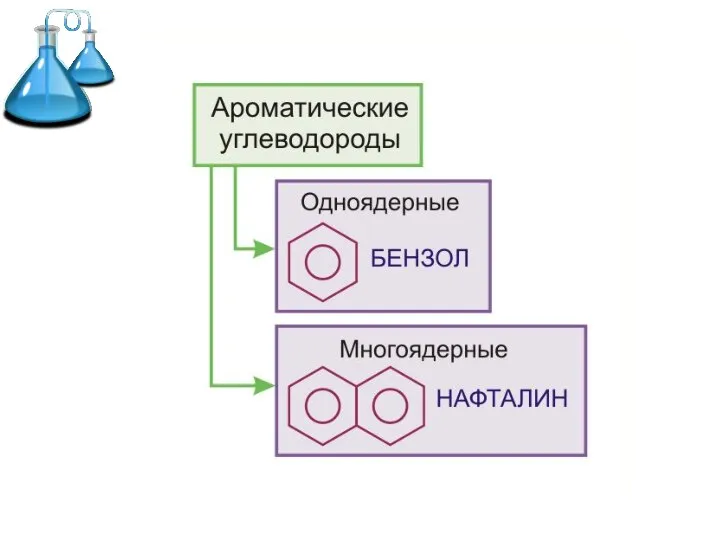
- 2. Ароматические углеводороды (арены) – это углеводороды с общей формулой СnH2n-6, в молекулах которых имеется хотя бы
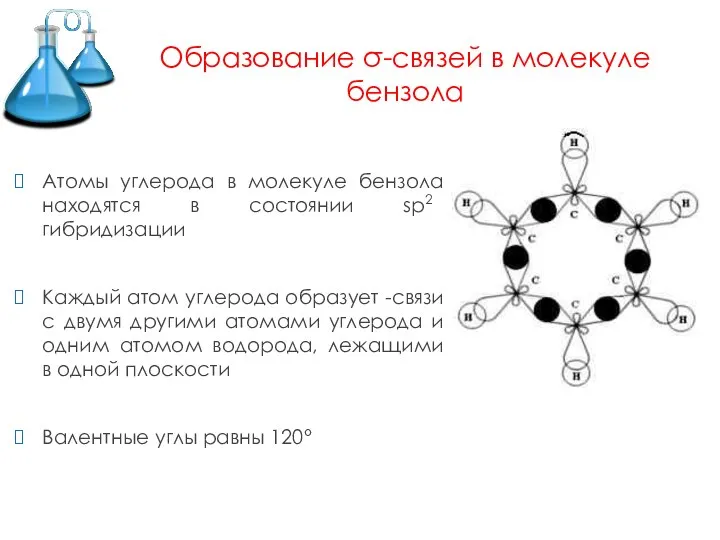
- 4. Образование σ-связей в молекуле бензола Атомы углерода в молекуле бензола находятся в состоянии sp2 гибридизации Каждый
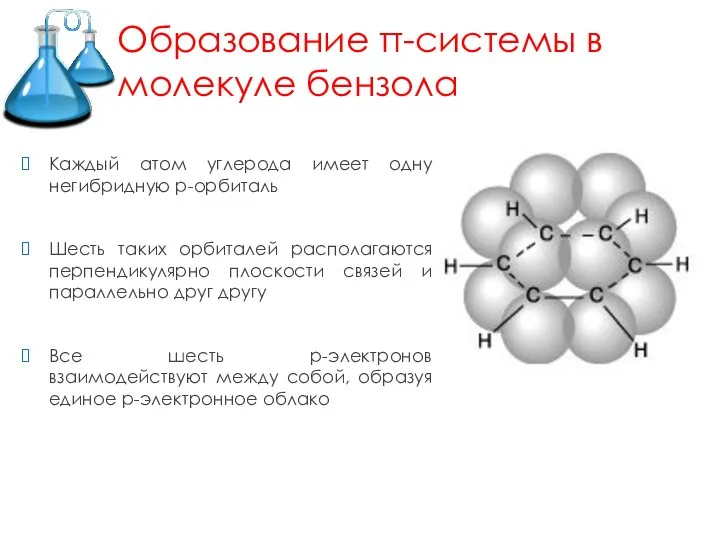
- 5. Образование π-системы в молекуле бензола Каждый атом углерода имеет одну негибридную р-орбиталь Шесть таких орбиталей располагаются
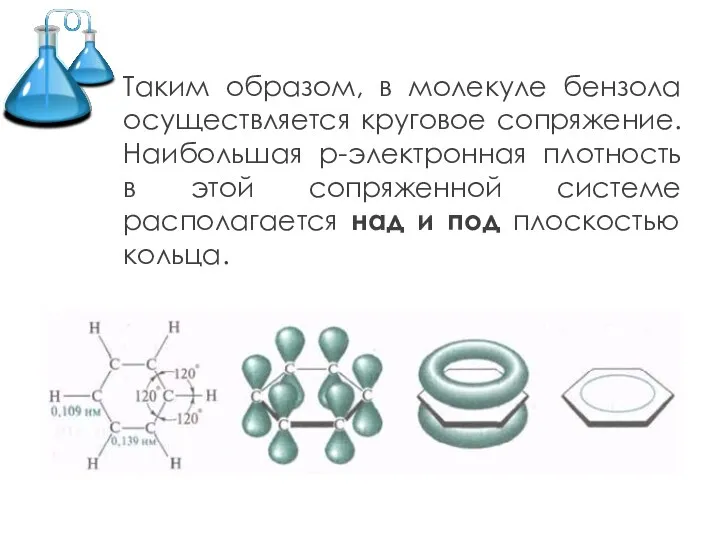
- 6. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая р-электронная плотность в этой сопряженной системе располагается
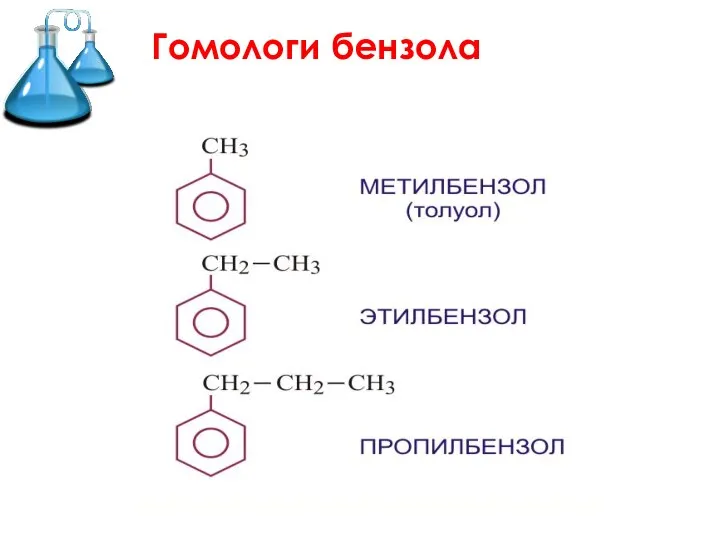
- 8. Гомологи бензола
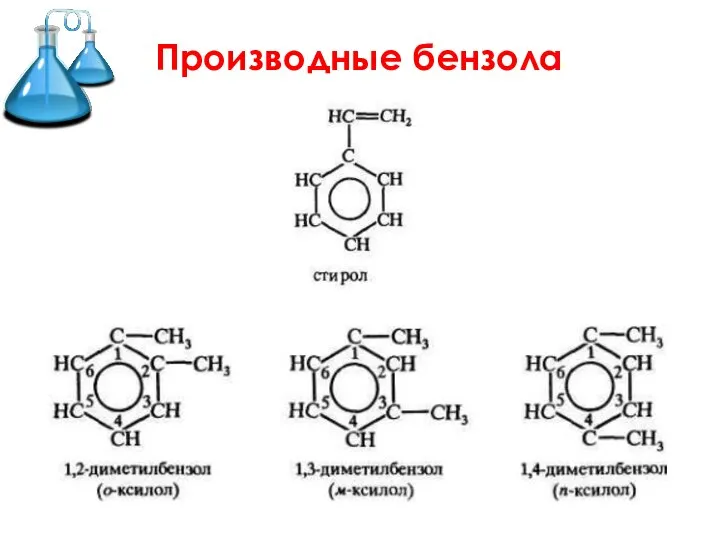
- 9. Производные бензола
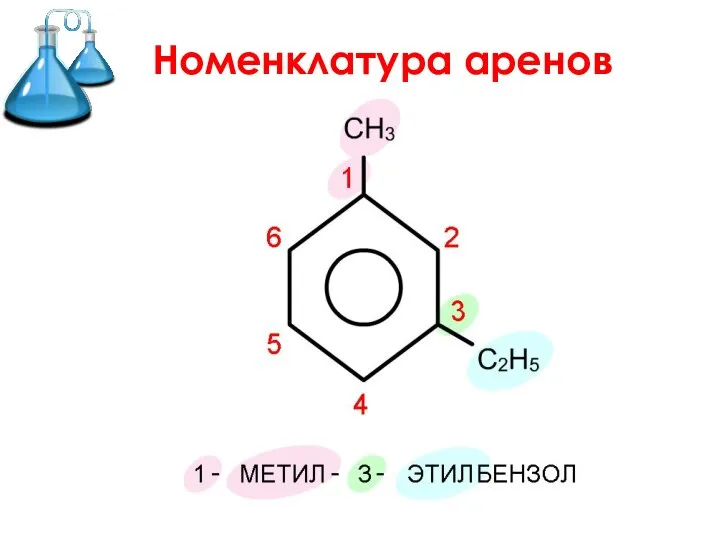
- 10. Номенклатура аренов
- 11. Физические свойства Бензол Бесцветная, летучая, огнеопасная жидкость С неприятным запахом Легче воды ( р=0,88 г/см3) Не
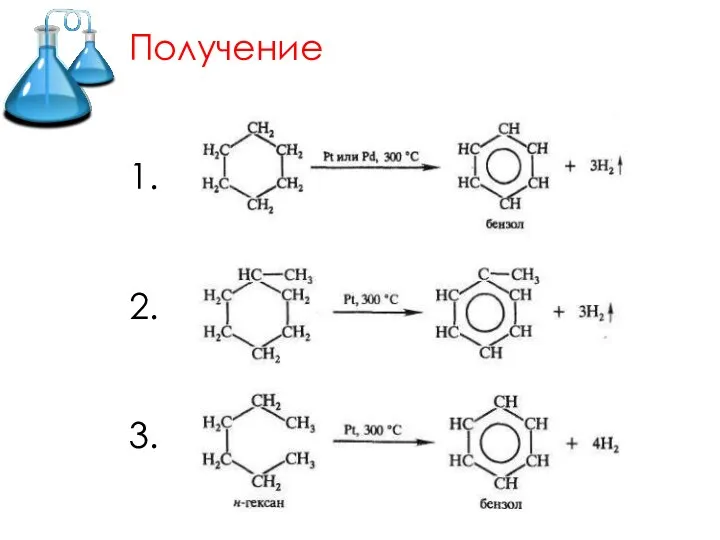
- 12. Получение 1. 2. 3.
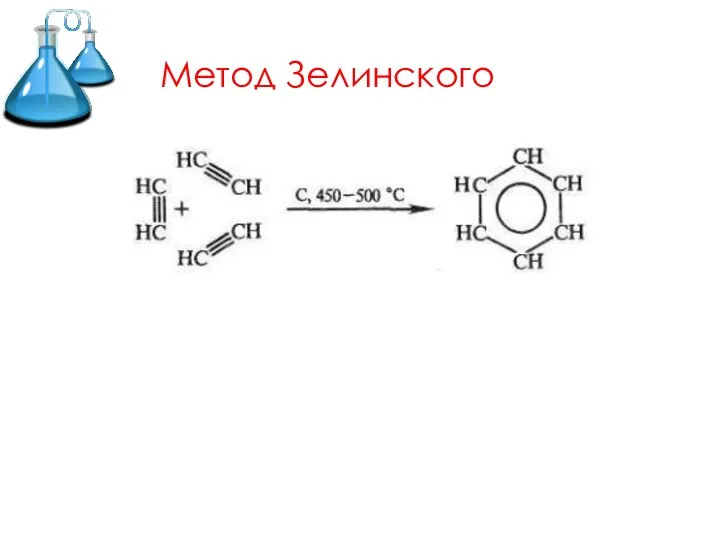
- 13. Метод Зелинского
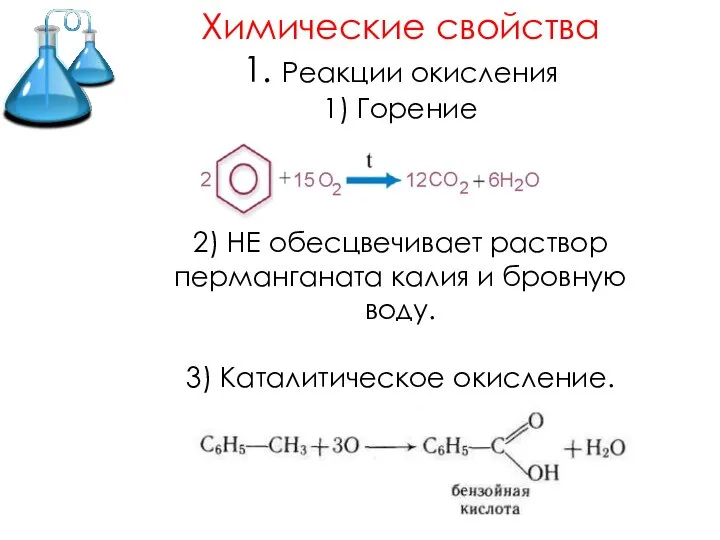
- 14. Химические свойства 1. Реакции окисления 1) Горение 2) НЕ обесцвечивает раствор перманганата калия и бровную воду.
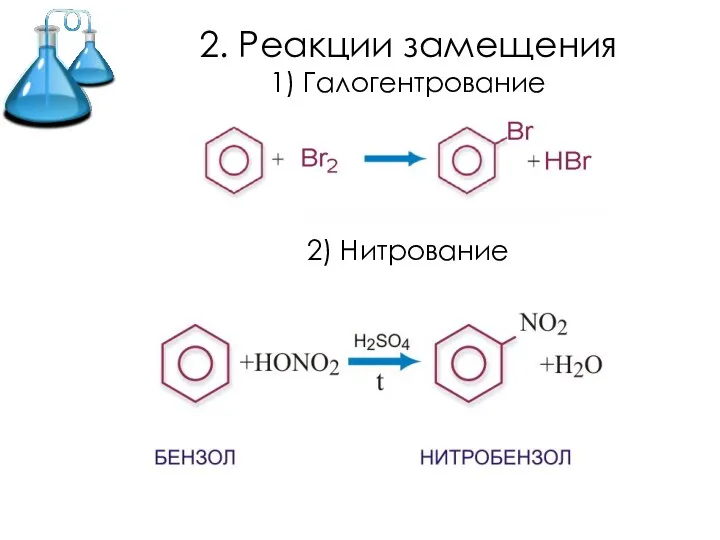
- 15. 2. Реакции замещения 1) Галогентрование 2) Нитрование
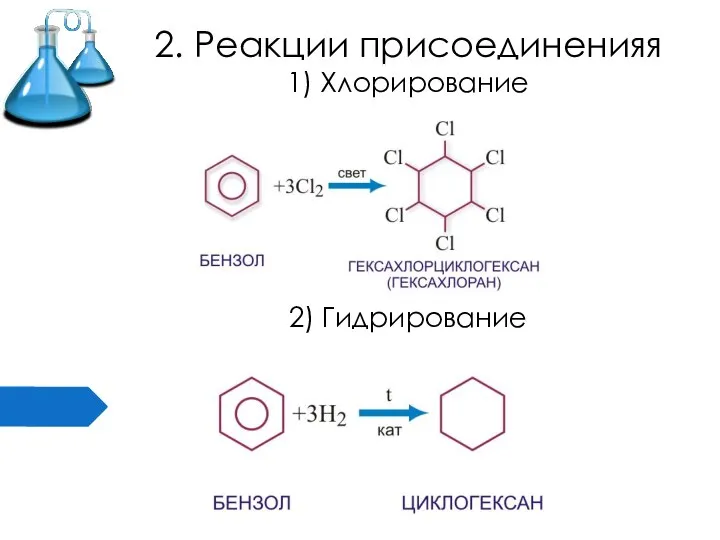
- 16. 2. Реакции присоединенияя 1) Хлорирование 2) Гидрирование
- 18. Скачать презентацию

 Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал
Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Робота учня 11-В класу: Андрійка Андрія
Робота учня 11-В класу: Андрійка Андрія  Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Общенаучные методы исследований
Общенаучные методы исследований Iodine
Iodine Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть  Химические свойства карбокатионов
Химические свойства карбокатионов Симметрия физических свойств кристаллов
Симметрия физических свойств кристаллов Оксокислоти. Номенклатура
Оксокислоти. Номенклатура Комплексні сполуки
Комплексні сполуки Презентация по Химии "ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ" - скачать смотреть бесплатно
Презентация по Химии "ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ" - скачать смотреть бесплатно Железо
Железо Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев Нуклеиновые кислоты
Нуклеиновые кислоты Неорганические полимеры
Неорганические полимеры Камни и Стрелец
Камни и Стрелец Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Кислоты
Кислоты Алкины. Строение,номенклатура, изомерия
Алкины. Строение,номенклатура, изомерия Важнейшие кислоты и кислотные остатки. (Леция 1)
Важнейшие кислоты и кислотные остатки. (Леция 1) Пестицидтердің қоршаған ортаға тигізетін әсері
Пестицидтердің қоршаған ортаға тигізетін әсері Гидродинамика (процессы и аппараты химической технологии, 3 лекция)
Гидродинамика (процессы и аппараты химической технологии, 3 лекция) Характеристика ядов, изолируемых водой в клинической фармации
Характеристика ядов, изолируемых водой в клинической фармации