Содержание
- 2. Білген сайын келеді біле бергің, біле беру емес пе тілегі елдің
- 3. Осы сабақ арқылы жүзеге асатын оқу мақсаттары - электрондық қабаттар және алғашқы 20 элементтердегі электрондардың орналасуын
- 4. Сабақтың мақсаты: Химия және физика курстарынан алған білімдерін пайдалана отырып , атомдағы электрондардың құрылысымен тереңірек таныстыру,
- 5. Атом-молекулалық ілімінің негізгі қағидалары: Атом-молекулалық ілімін жасаған орыс ғалымы Михаил Васильевич Ломоносов, VIII ғасыр. Барлық заттар
- 6. Элемент атомының қасиеттері: Атом радиусы-ядроның өзегінен сыртқы электронға дейінгі қашықтық. Иондану энергиясы-бейтарап атомнан бір электронды жұлып
- 8. Натрий атомының құрамы Хлор атомының құрамы
- 9. Оқытудың күтілетін нәтижелері Атомдағы электрондардың құрылысымен тереңірек танысады «электрон бұлты », «орбиталь», «энергетикалық деңгей», «энергетикалық деңгейше»,
- 10. Атом құрылысының бірінші кванттық теориясын Нильс Бор 1913 ж. ұсынған,кейіннен XX ғасырдың 20 – жылдарында Л.де
- 11. Атомның химиялық қасиеті – электрондық қабатының құрылысына тәуелді
- 12. Электрондар – микробөлшектер, олардың атомдағы қозғалысын кванттық механика зерттейді.Ол элементар бөлшектердің әрекеттесуі мен тәртібін қарастырады. Электронның
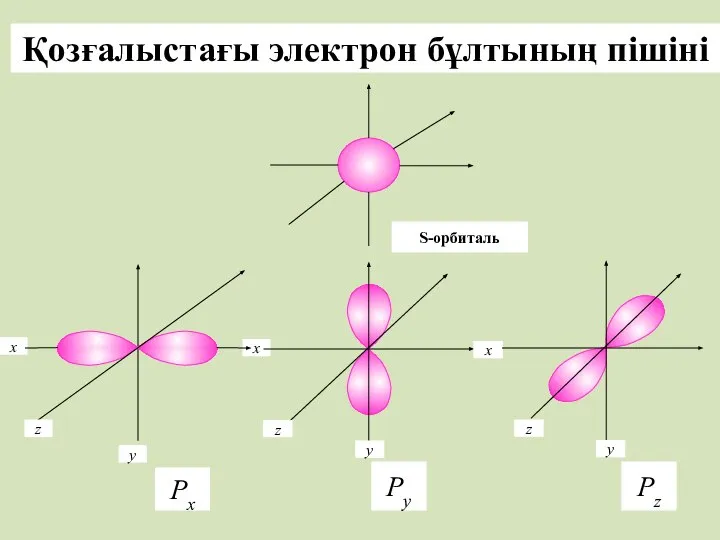
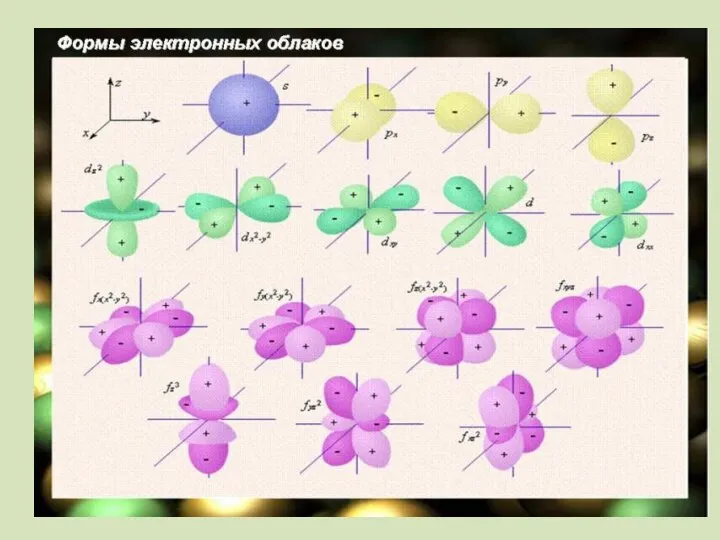
- 13. Электрондық бұлт Атомдағы электрондар қозғалысының траекториясы белгісіз,кванттық механикада ядро маңындағы кеңістікте электрондар болу ықтималдығын – электрондық
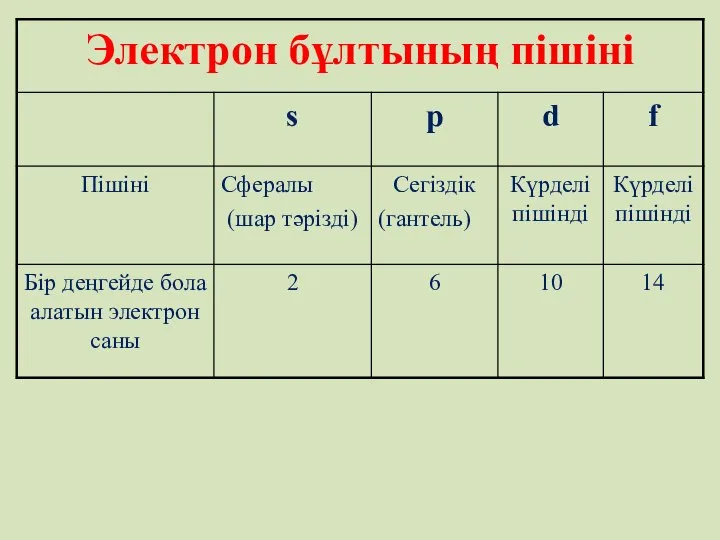
- 14. Электрон бұлты болатын кеңістікті орбиталь деп атаймыз. мөлшері жуық орбитальдардан электрондық қабаттар немесе энергетикалық деңгейлер қалыптасады.
- 15. Электрондық қабат деп– бір энергетикалық деңгейдегі электрондардың жиынтығын айтады. Орбитальдар бір- бірінен өздерінің энергиялары, пішіндері және
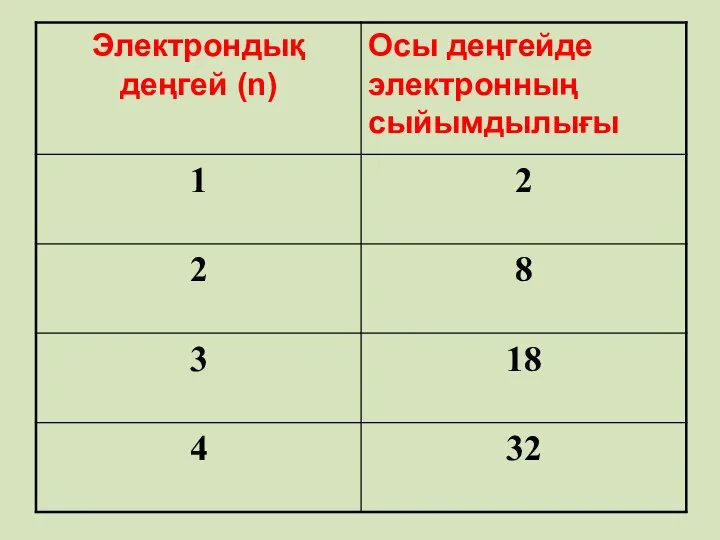
- 16. Энергетикалық деңгейде орналасқан электрон саны Егер n = 1 болса N = 2 n = 2
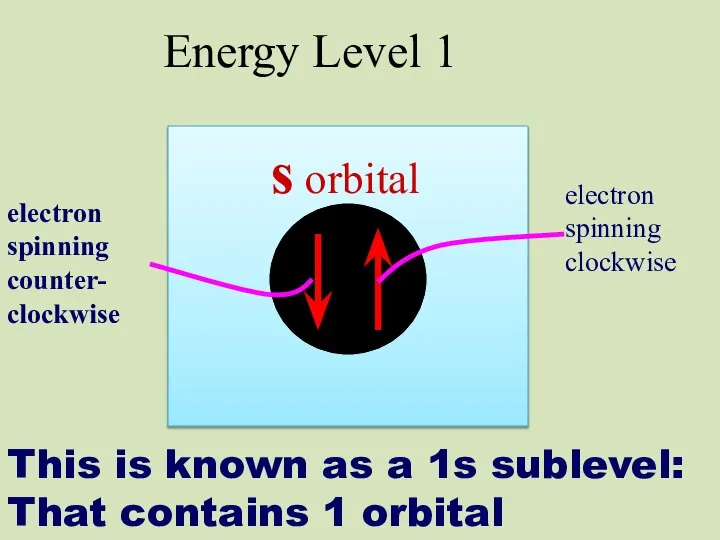
- 17. This is known as a 1s sublevel: That contains 1 orbital s orbital electron spinning clockwise
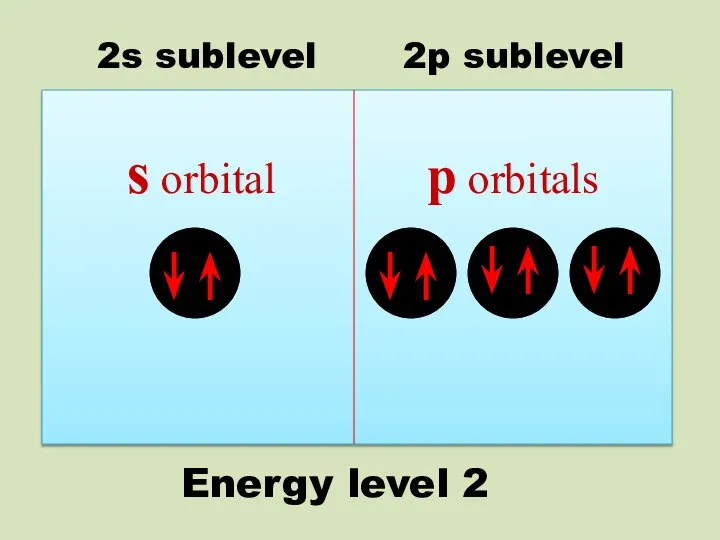
- 18. Energy level 2 s orbital p orbitals 2s sublevel 2p sublevel
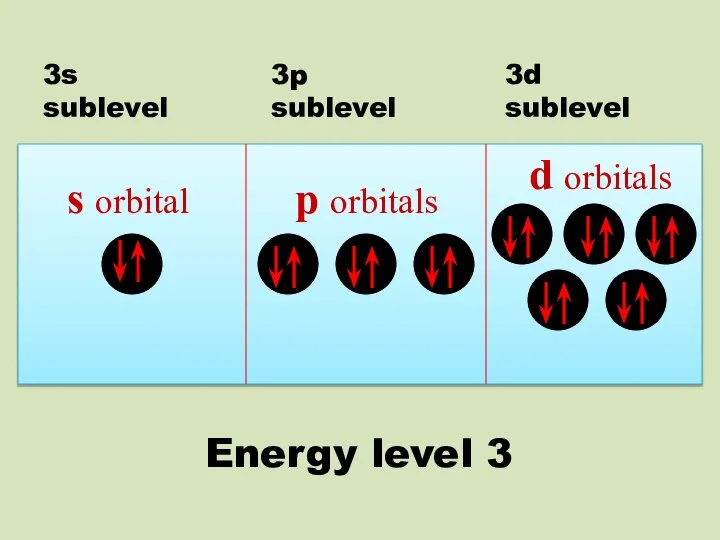
- 19. s orbital p orbitals d orbitals 3s sublevel 3p sublevel 3d sublevel Energy level 3
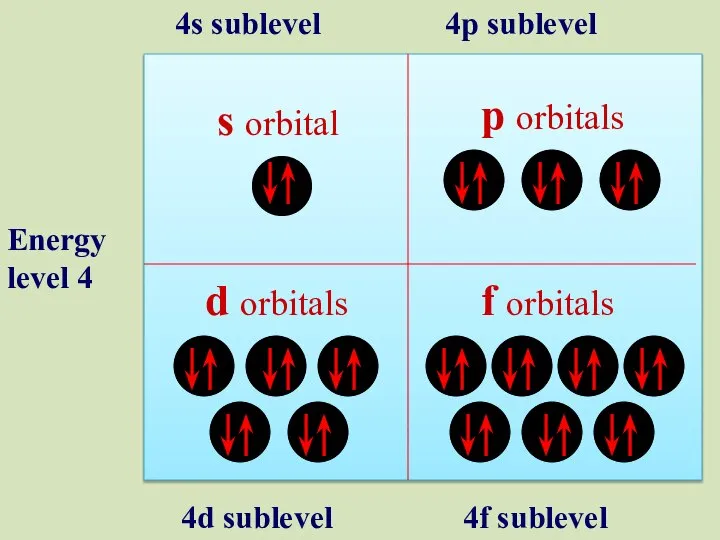
- 20. s orbital p orbitals d orbitals f orbitals Energy level 4 4s sublevel 4p sublevel 4d
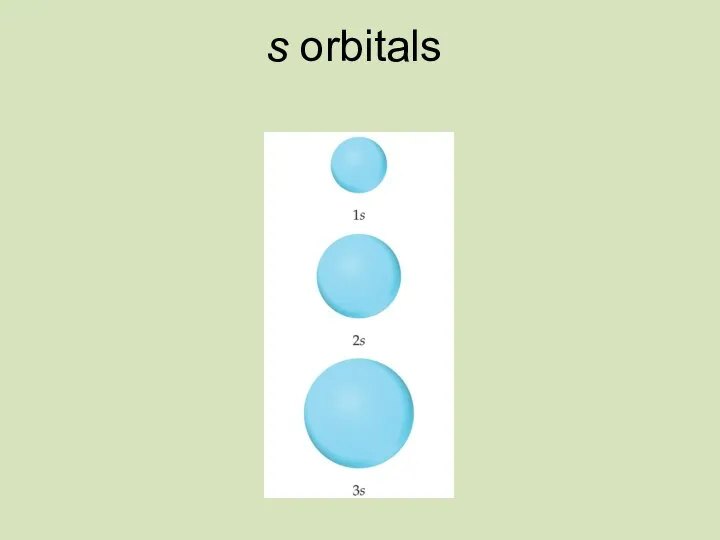
- 21. s orbitals
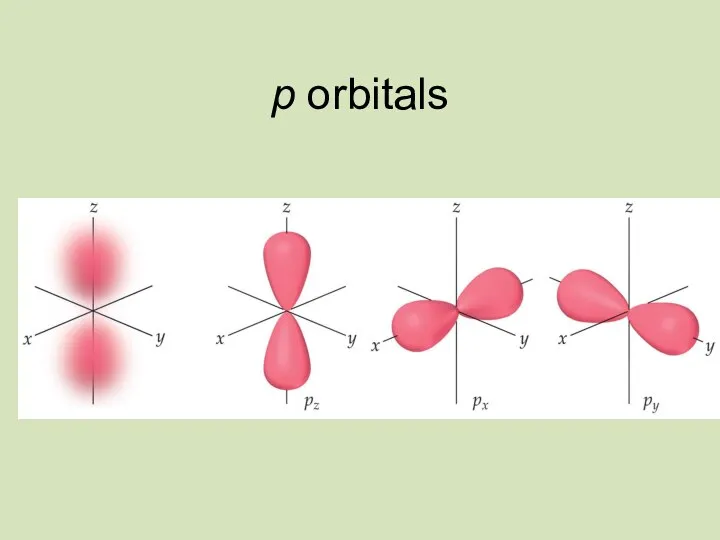
- 22. p orbitals
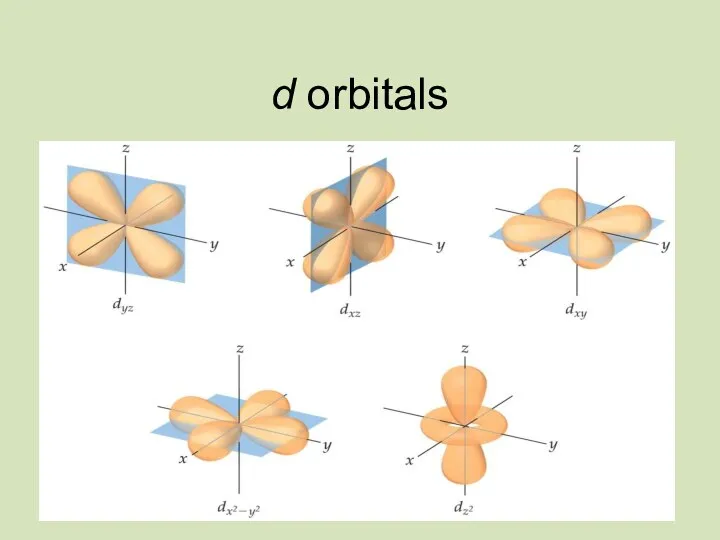
- 23. d orbitals
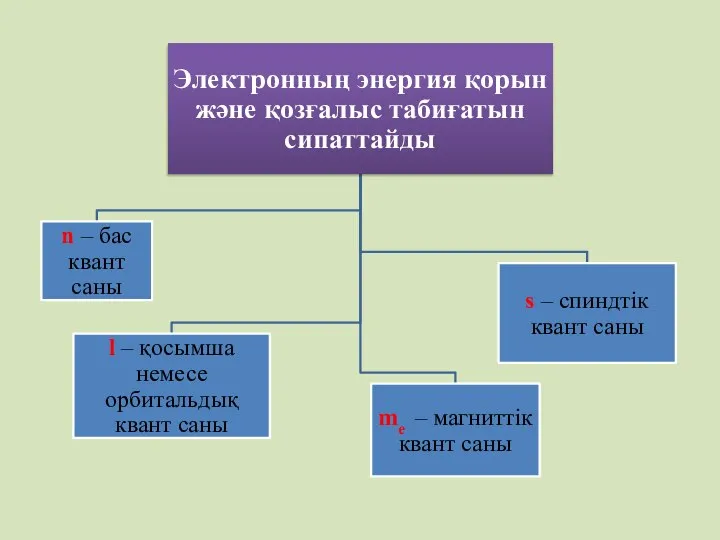
- 25. Электронның күйін 4 квант саны сипаттайды Бас квант саны – n электрондардың жалпы энергия қорын және
- 26. Бас квант сандары 1, 2 , 3, 4, 5, 6, 7; Энергетикалық деңгей K,L,M,N,O, P, Q
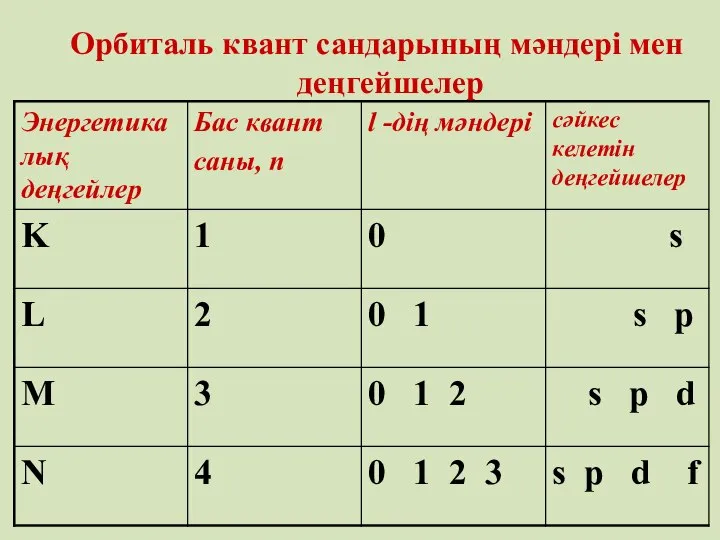
- 27. Орбиталь квант саны – l (қосымша квант саны) электронның энергетикалық күйін және орбитальдардың пішінін көрсетеді Қосымша
- 28. Орбиталь квант сандарының мәндері мен деңгейшелер
- 29. Магнит квант саны - ml пішіндері бірдей орбитальдардың кеңістікте орналасу бағытын көрсетеді. Магниттік квант саны орбиталь
- 30. Магнит квант сандарының мәндері
- 31. Спин квант саны – ms электронның өз осінен қай бағытта қозғалатынын көрсетеді.Электрон өз осінен сағат тілінің
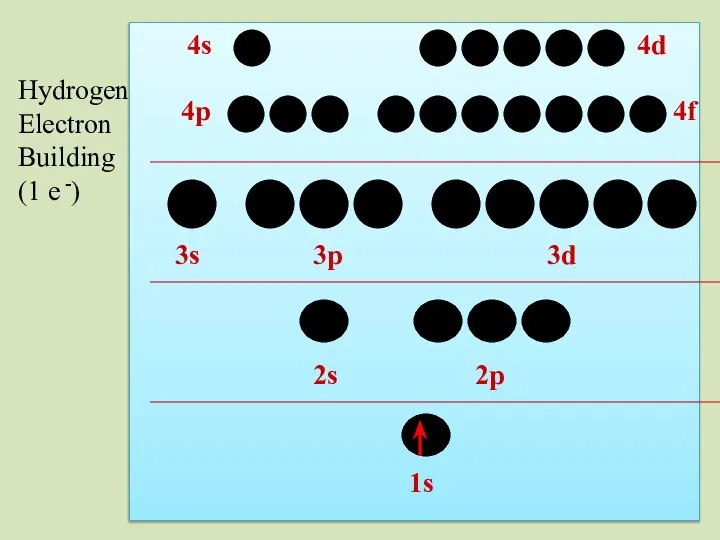
- 32. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Hydrogen Electron Building (1 e -)
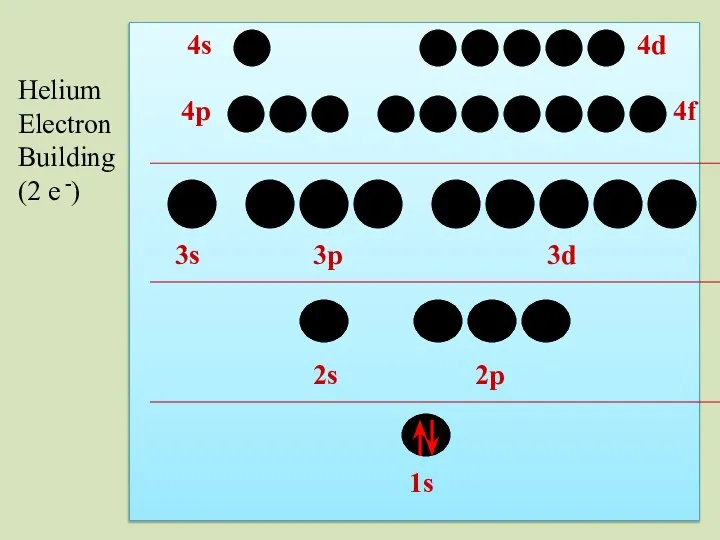
- 33. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Helium Electron Building (2 e -)
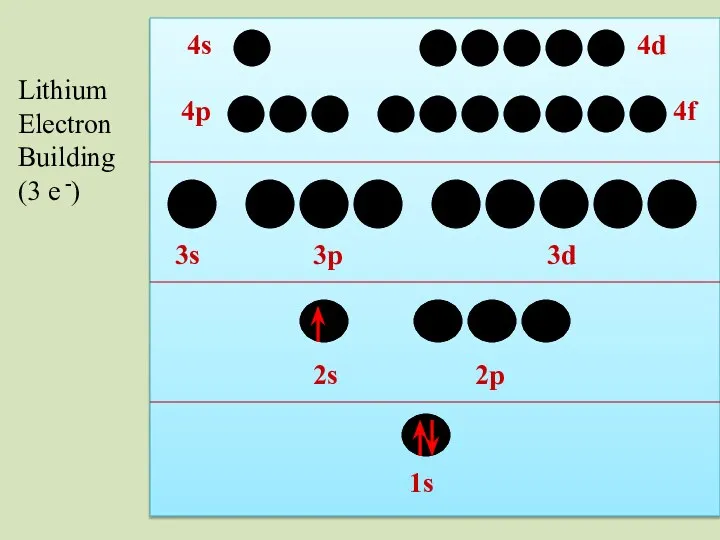
- 34. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Lithium Electron Building (3 e -)
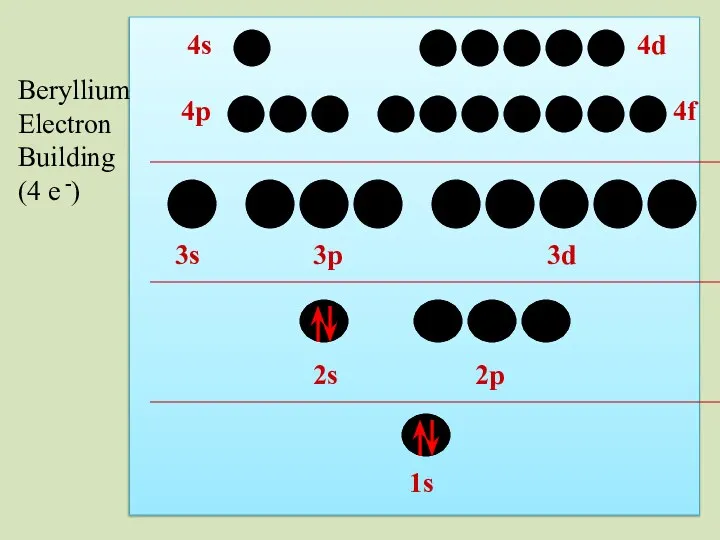
- 35. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Beryllium Electron Building (4 e -)
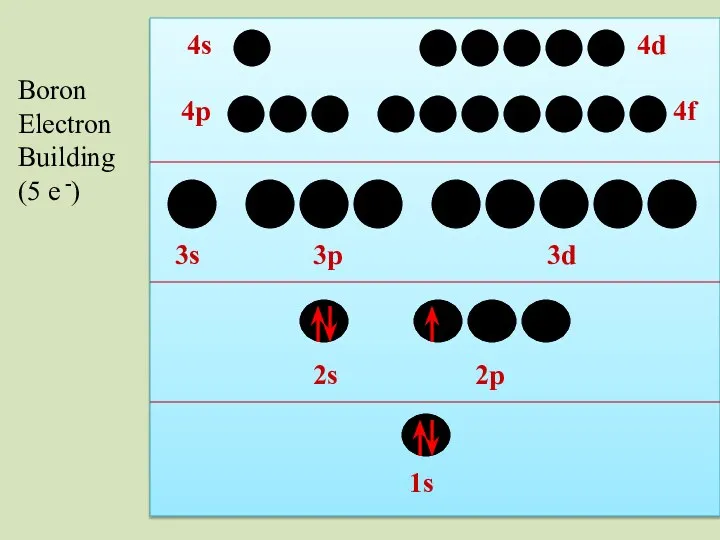
- 36. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Boron Electron Building (5 e -)
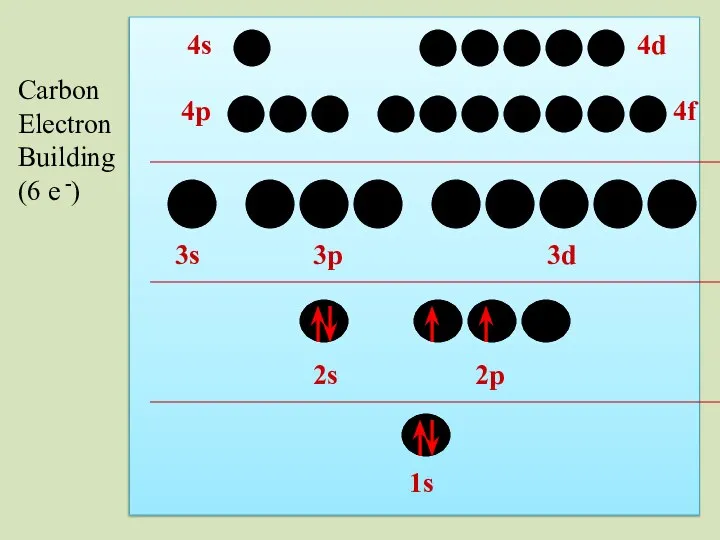
- 37. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Carbon Electron Building (6 e -)
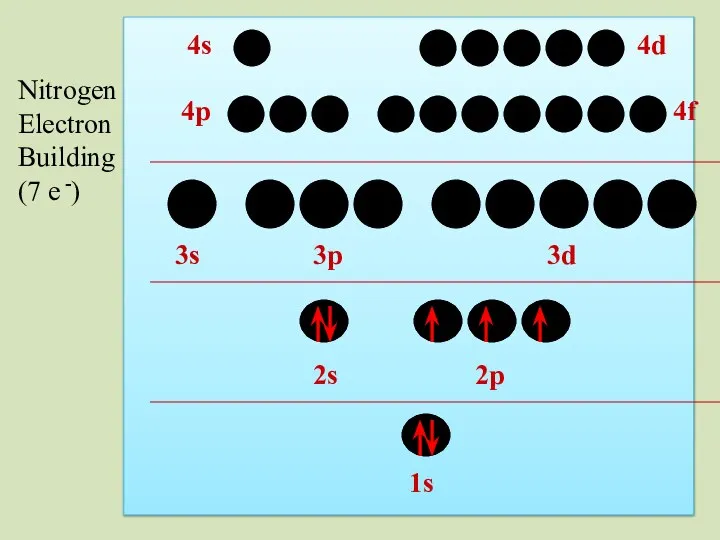
- 38. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Nitrogen Electron Building (7 e -)
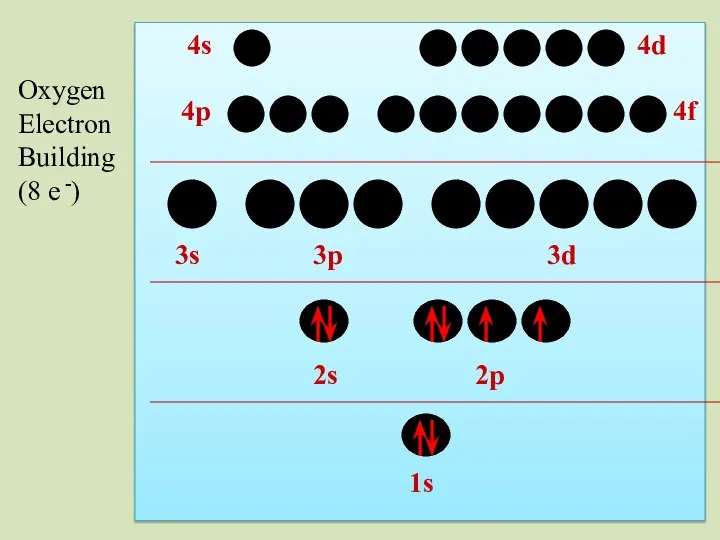
- 39. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Oxygen Electron Building (8 e -)
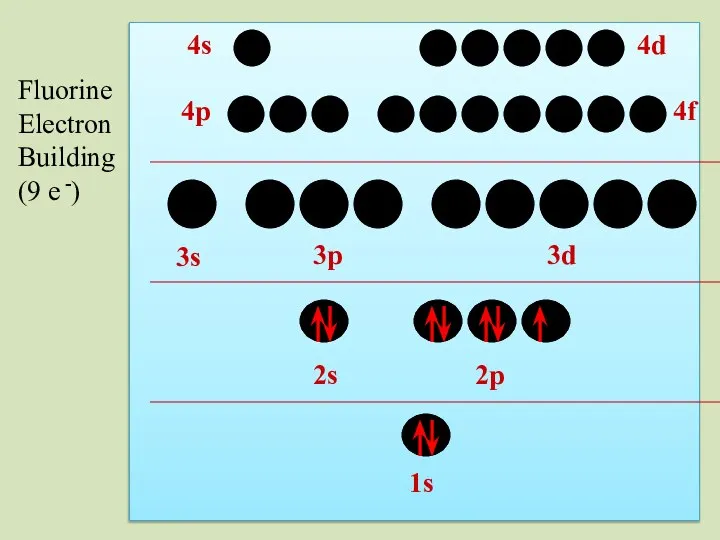
- 40. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Fluorine Electron Building (9 e -)
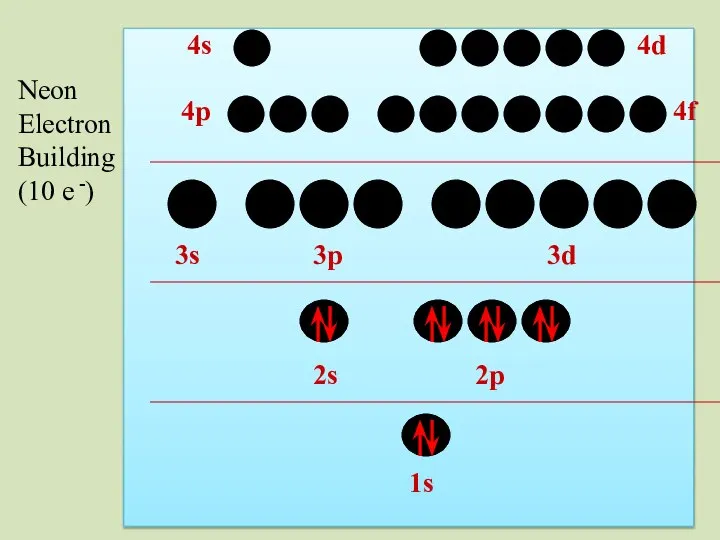
- 41. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Neon Electron Building (10 e -)
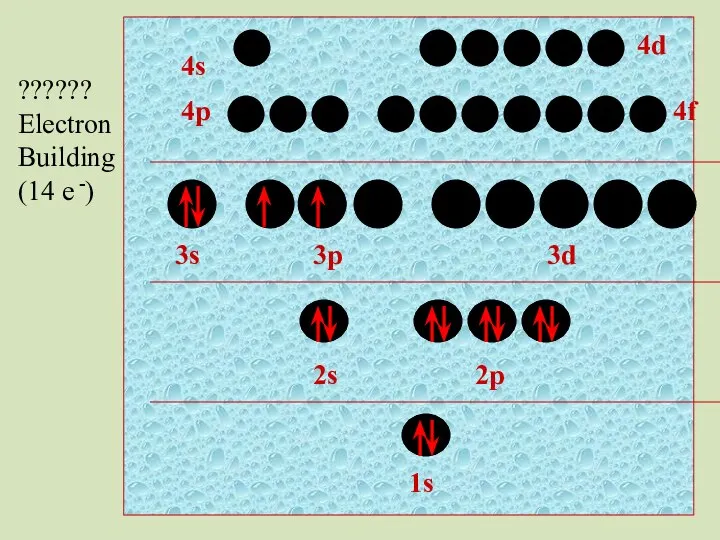
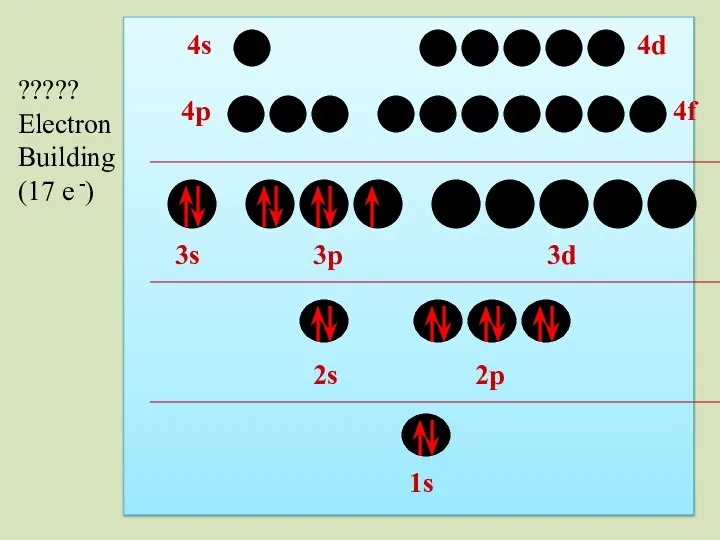
- 42. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f ?????? Electron Building (14 e -)
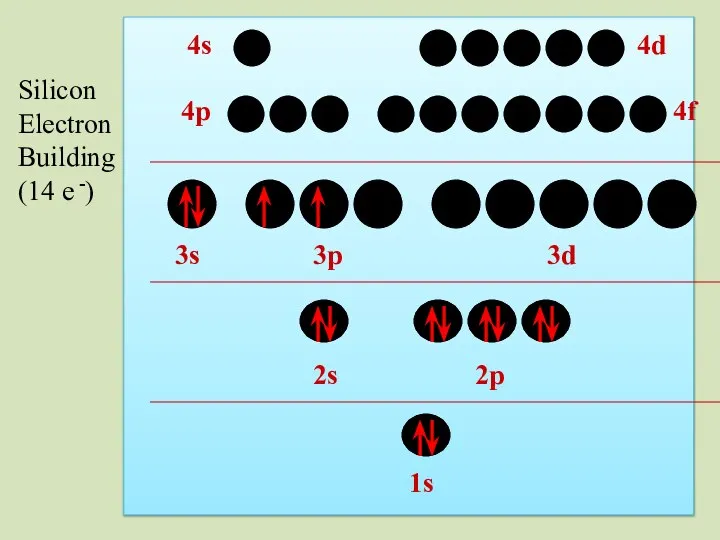
- 43. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Silicon Electron Building (14 e -)
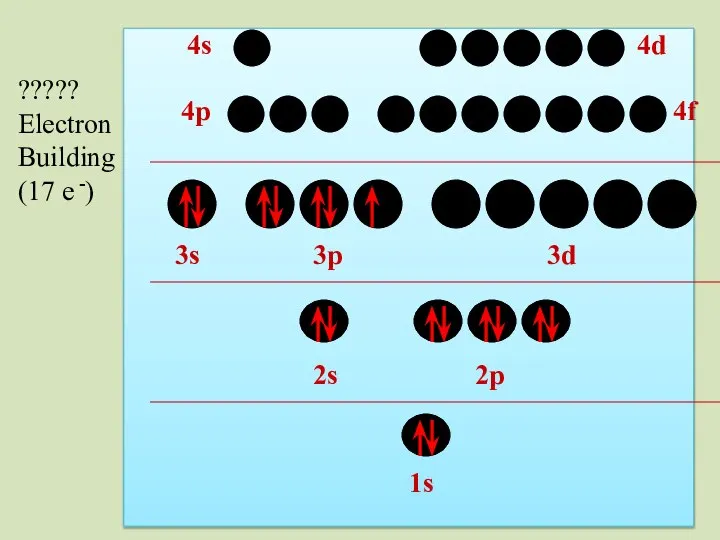
- 44. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f ????? Electron Building (17 e -)
- 45. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f ????? Electron Building (17 e -)
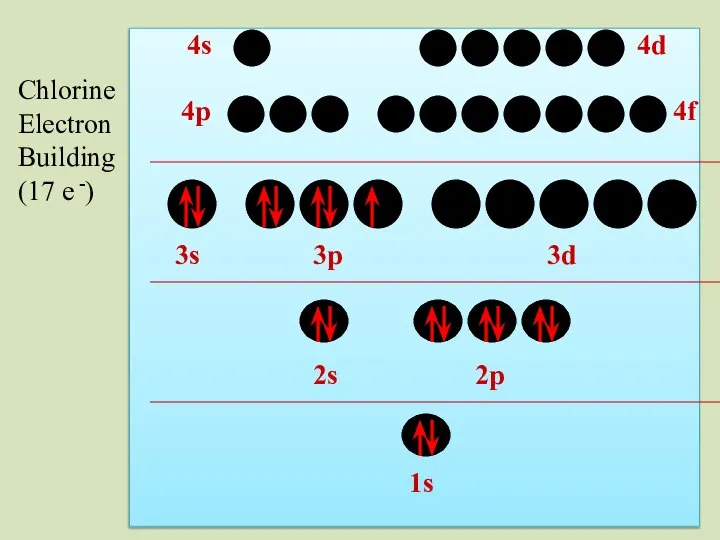
- 46. 2s 1s 2p 3s 3p 3d 4p 4s 4d 4f Chlorine Electron Building (17 e -)
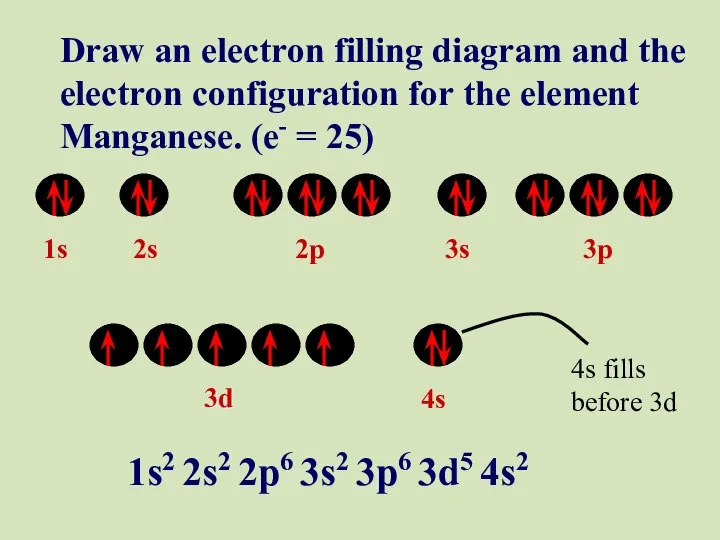
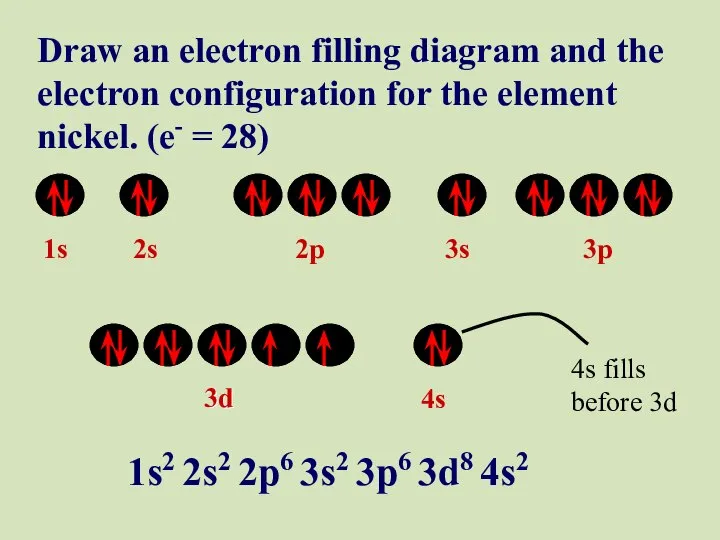
- 47. 1s 2s 2p 3s 3p 3d 4s Draw an electron filling diagram and the electron configuration
- 48. 1s 2s 2p 3s 3p 3d 4s Draw an electron filling diagram and the electron configuration
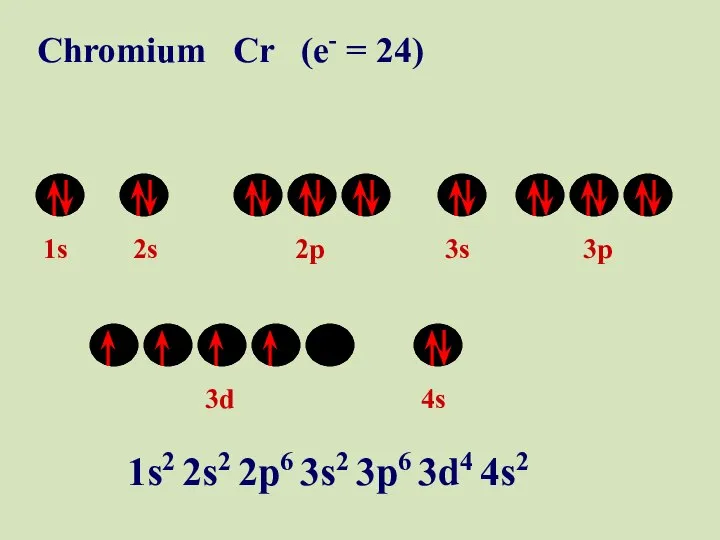
- 49. 1s 2s 2p 3s 3p 3d 4s Chromium Cr (e- = 24) 1s2 2s2 2p6 3s2
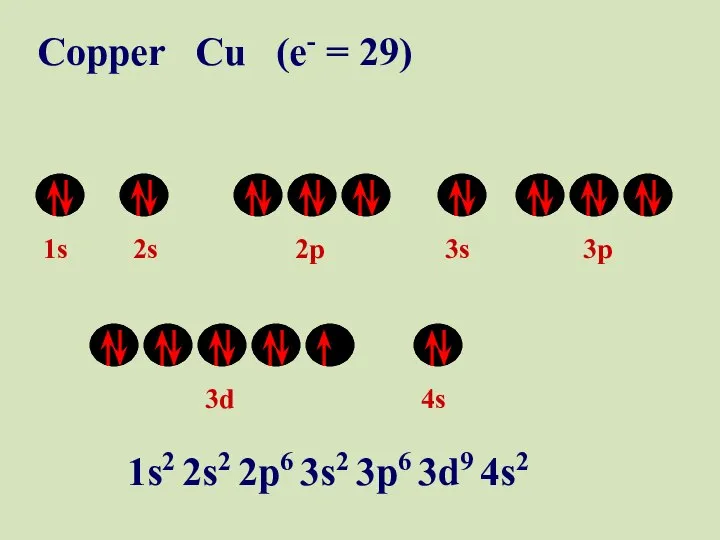
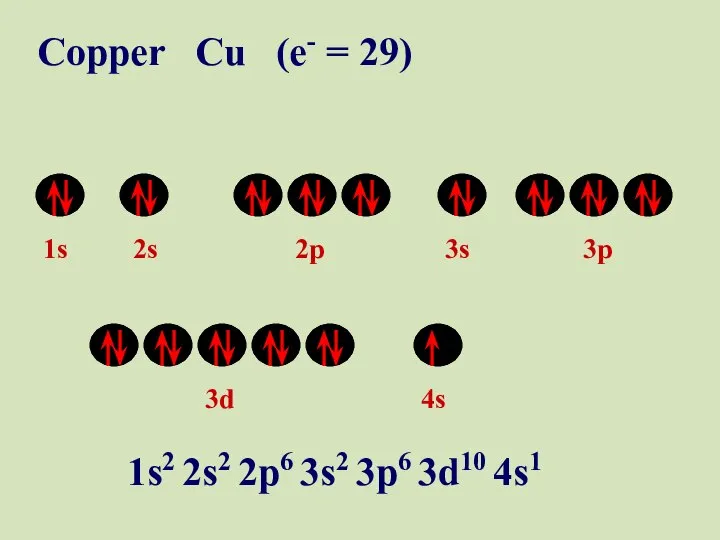
- 50. 1s 2s 2p 3s 3p 3d 4s Copper Cu (e- = 29) 1s2 2s2 2p6 3s2
- 51. 1s 2s 2p 3s 3p 3d 4s Copper Cu (e- = 29) 1s2 2s2 2p6 3s2
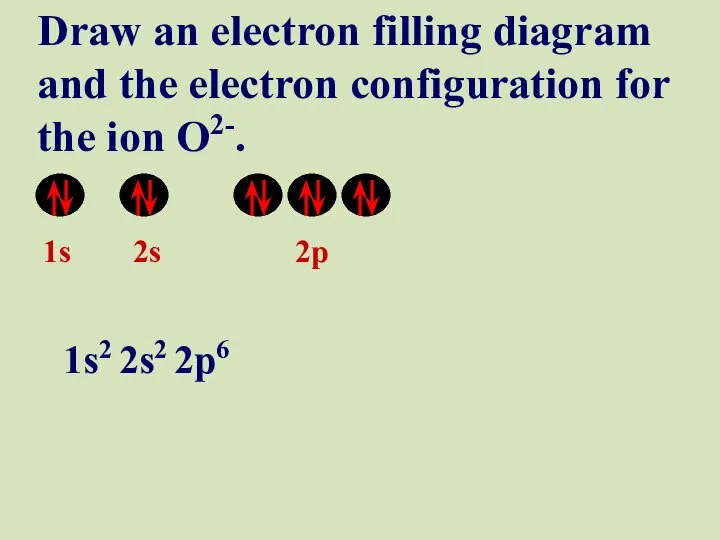
- 52. 1s 2s 2p Draw an electron filling diagram and the electron configuration for the ion O2-.
- 53. 1s 2s 2p Draw an electron filling diagram and the electron configuration for the ion Na+.
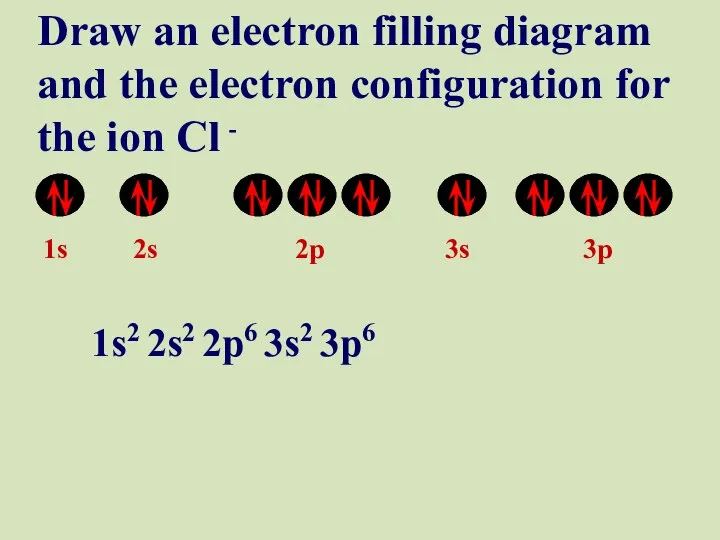
- 54. 1s 2s 2p 3s 3p Draw an electron filling diagram and the electron configuration for the
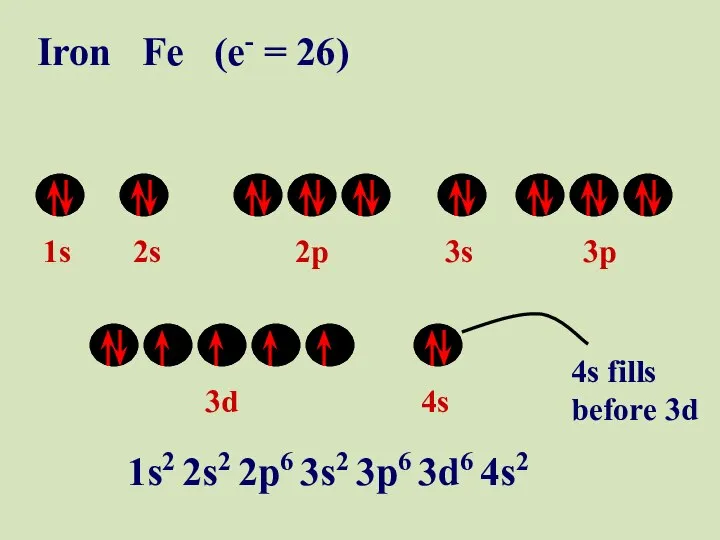
- 55. 1s 2s 2p 3s 3p 3d 4s Iron Fe (e- = 26) 1s2 2s2 2p6 3s2
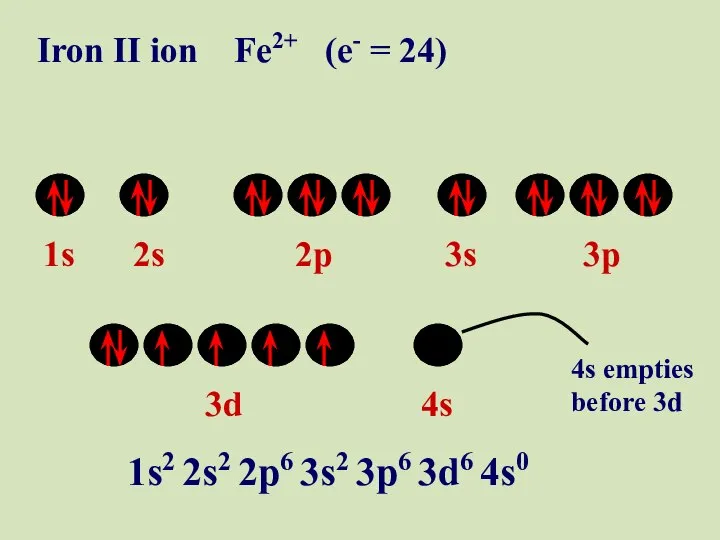
- 56. 1s 2s 2p 3s 3p 3d 4s Iron II ion Fe2+ (e- = 24) 1s2 2s2
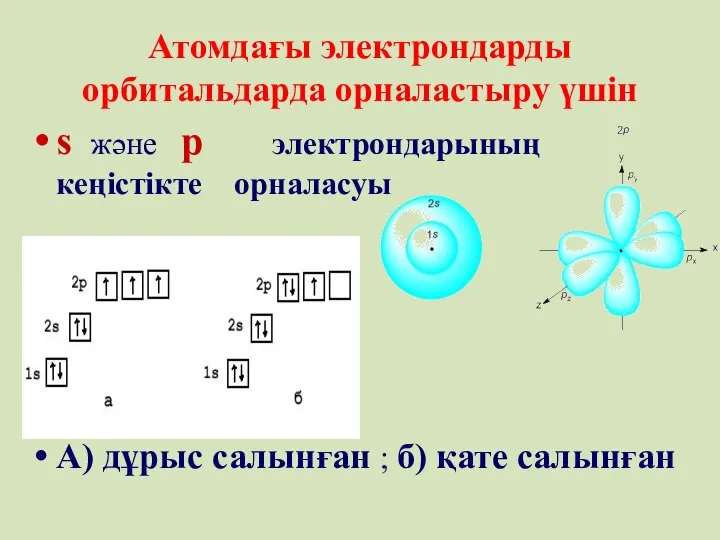
- 57. Атомдағы электрондарды орбитальдарда орналастыру үшін s және p электрондарының кеңістікте орналасуы А) дұрыс салынған ; б)
- 58. 1925ж Швейцария ғалымы В.Паули атомдардың спектрлерін зерттей келіп мынадай ереже немесе принцип ұсынды: атомда төрт квант
- 59. Хунд ережесі Бір деңгейшедегі орналасқан электрондардың спин квант сандарының қосындысы максималь болуы шарт; ол үшін электрондар
- 60. Бір орбитальда спиндері қарама –қарсы бағытталған екі электрон ғана орналасады мысалы: K (n=1) болғанда s (l=0)
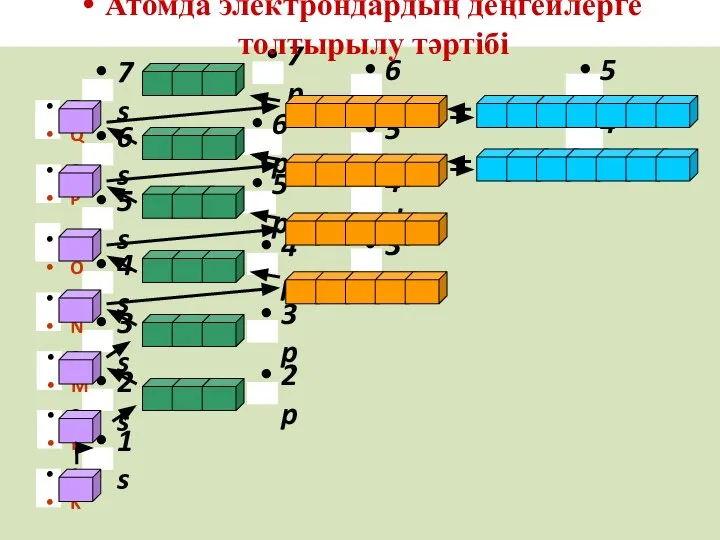
- 61. Атомдағы электрондардың энергетикалық деңгейлер мен деңгейшелерде орналасуы Клечковскийдің ережелеріне бағынады
- 62. Атомның электрондары оның деңгейлері мен деңгейшелерінде бас және орбиталь квант сандарының қосындысының (n + l) өсу
- 63. Мысалы: 3d мен 4s орбитальдарындағы электрондар үшін 4s (4+0=4) және 3d (3+2=5) біле отырып, алғашқысының энергиясы
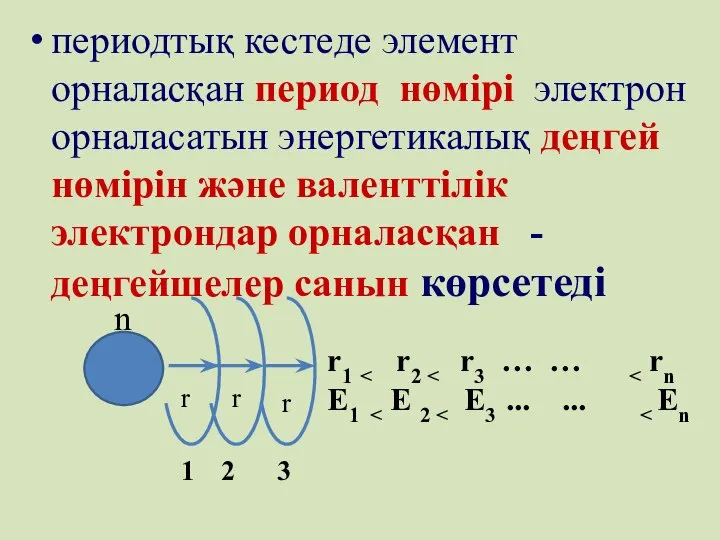
- 68. периодтық кестеде элемент орналасқан период нөмірі электрон орналасатын энергетикалық деңгей нөмірін және валенттілік электрондар орналасқан -
- 69. Атомдағы электрондардың деңгейлер мен деңгейшелер де орналасуы 1s 2s 2p 3s 3p 4s 3d 4p 5s
- 71. Тапсырма №1 Атомның электрондық формуласы берілген ол қай элементке сәйкес келеді: 1s2 2s2 2p6 3s2 3p6
- 72. Тапсырма № 2 Берілген электрондық конфигурацияның қайсысы үшінші периодтың екінші тобының элементіне сәйкес келеді: a) 1s2
- 73. Электрондық конфигурациясы... 3d5 4s1 болатын элемент a) Co; b) V; c) Cr; d)Mn; e)Fe; Мына электрондық
- 74. Октет ережесі - s- және p- элементтердің электрондарды қосып, беріп немесе жұптастыру нәтижесінде сыртқы энергетикалық қабатын
- 75. Үйге тапсырма: l = 0 орбитальдарының кеңістіктегі пішіні қандай және қалай аталады? l=1 орбитальдарының кеңістіктегі пішіні
- 77. Скачать презентацию


































 Презентация по Химии "Волшебный сад" - скачать смотреть
Презентация по Химии "Волшебный сад" - скачать смотреть  Соединения кремния Силикатная промышленность.
Соединения кремния Силикатная промышленность.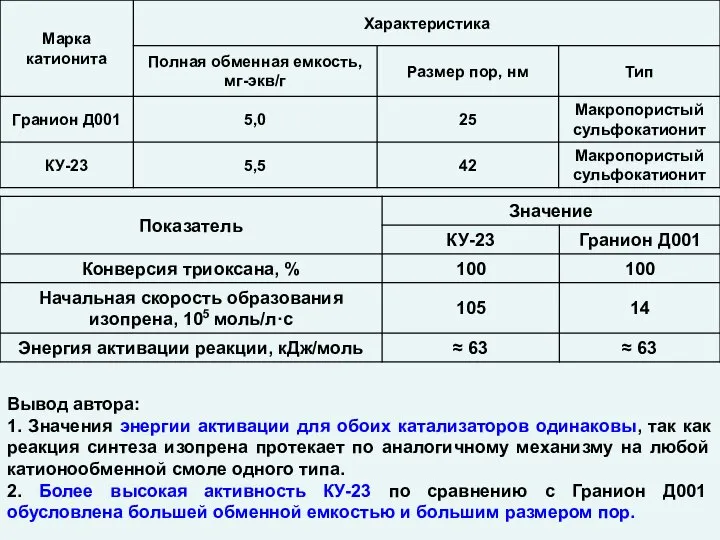 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Современная радиохимия
Современная радиохимия Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Нефть. Состав и свойства
Нефть. Состав и свойства Булану мен конденсация
Булану мен конденсация Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Ресурсосбережение и экология в переработке и применении пластмасс
Ресурсосбережение и экология в переработке и применении пластмасс Свободнорадикальные процессы в клетке
Свободнорадикальные процессы в клетке Пожарная безопасность в жилом доме
Пожарная безопасность в жилом доме  Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Общая радиохимия. Свойства радиоколлоидов
Общая радиохимия. Свойства радиоколлоидов Подготовка к ЕГЭ
Подготовка к ЕГЭ Строение электронных оболочек атомов
Строение электронных оболочек атомов Коррозия металлов
Коррозия металлов Получение и применение алкенов
Получение и применение алкенов Катаболизм жирных кислот. Метаболизм кетоновых тел. (Лекция 8)
Катаболизм жирных кислот. Метаболизм кетоновых тел. (Лекция 8) Химическая физика горения
Химическая физика горения Фуллерены Квазикристаллы Использование кристаллов
Фуллерены Квазикристаллы Использование кристаллов The ideal gas equation
The ideal gas equation Бензен
Бензен  Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Строение атома
Строение атома Каучуки. Гума
Каучуки. Гума Содержание витамина С (аскорбиновой кислоты) в натуральных и консервированных соках.
Содержание витамина С (аскорбиновой кислоты) в натуральных и консервированных соках. Окислительно-восстановительные реакции . Алканолы
Окислительно-восстановительные реакции . Алканолы Сшивка и контролируемая деструкция полиолефинов
Сшивка и контролируемая деструкция полиолефинов