Содержание
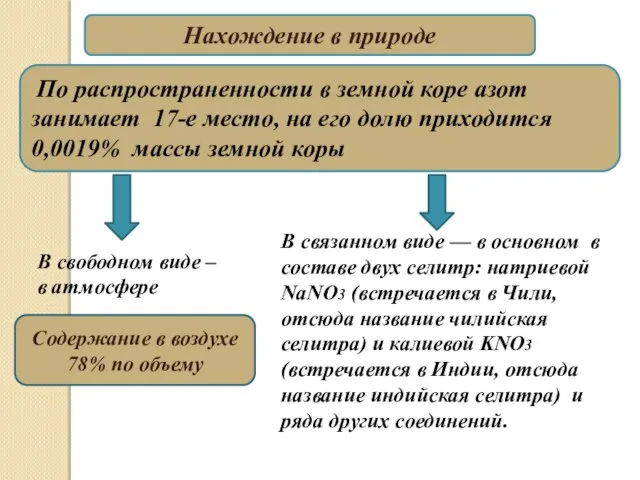
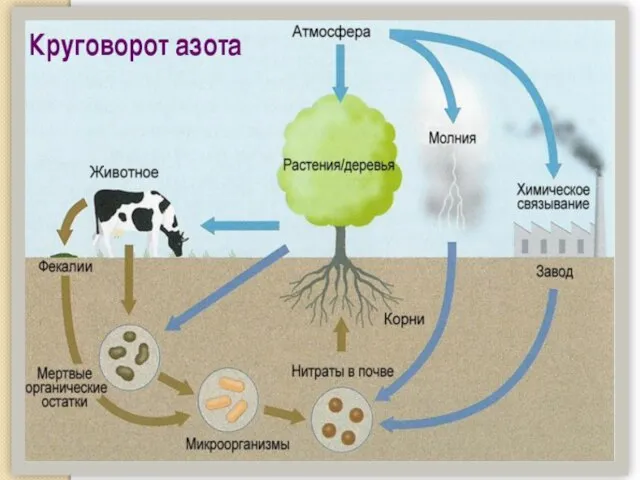
- 2. Нахождение в природе По распространенности в земной коре азот занимает 17-е место, на его долю приходится
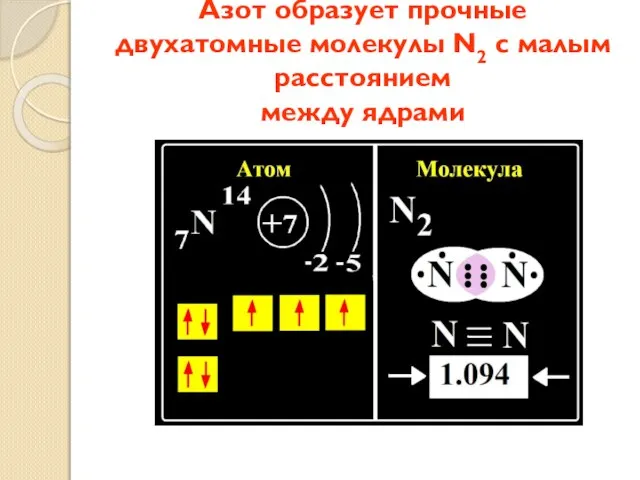
- 3. Азот образует прочные двухатомные молекулы N2 с малым расстоянием между ядрами
- 4. Молекула двухатомная и очень прочная Структурная формула N N В нем молекулярная решетка и ковалентная неполярная
- 5. Азот — газ без цвета, запаха и вкуса. Мало растворим в воде (в 100 объемах воды
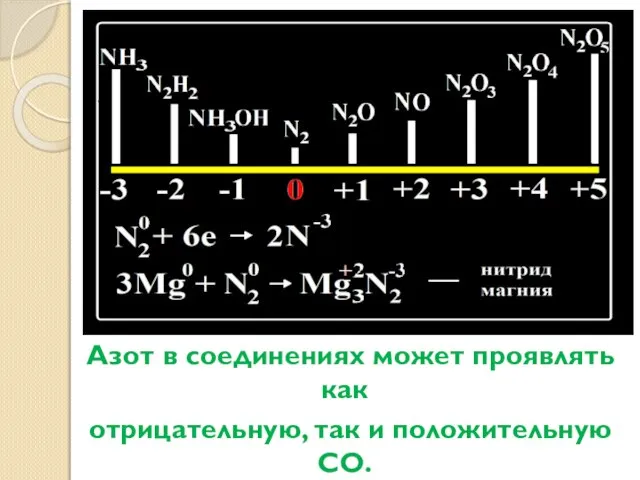
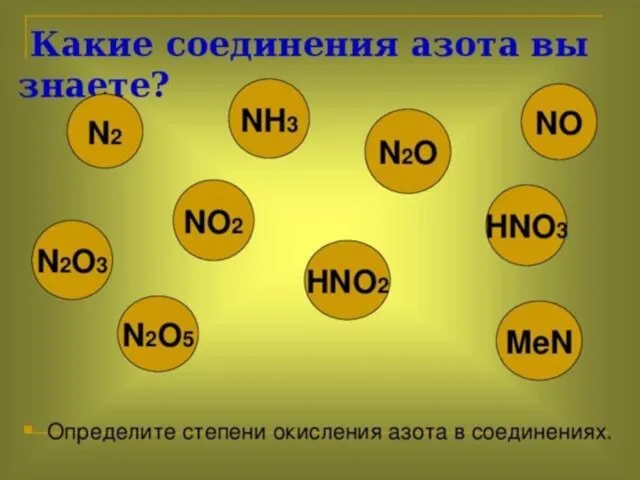
- 6. Азот в соединениях может проявлять как отрицательную, так и положительную СО.
- 7. Азот реагирует с кислородом (при температуре электрической дуги) N2 + O2 =2NO 2. Азот реагирует с
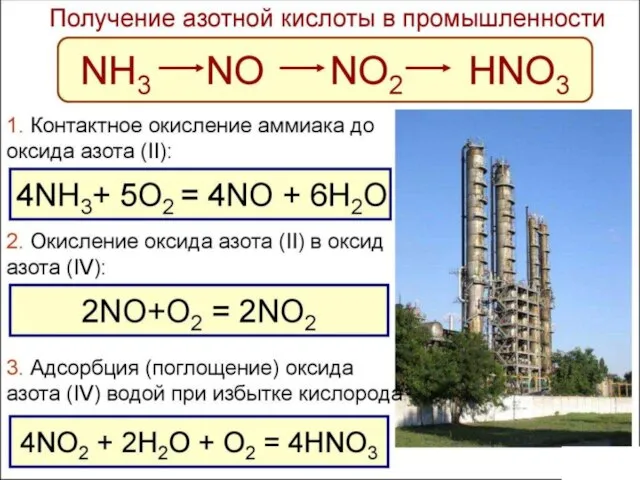
- 8. Завод по производству азота из жидкого воздуха ОАО «Невинномысский Азот" Получение азота в промышленности: Фракционной перегонкой
- 9. Получение азота в лаборатории (разложением солей аммония) 1. Разложением нитрита аммония NH4NO2=N2 + 2H2O 2. Разложением
- 10. Применение Как хладагент В косметологии Для создания инертной среды при опытах Для синтеза аммиака N2
- 11. Применение соединений азота производство минеральных удобрений производство взрывчатых веществ производство лекарственных препаратов
- 15. Оксид азота (I) N2O N2O – оксид азота (I), закись азота или «веселящий газ», возбуждающе действует
- 20. Оксид азота (V) N2O5 – оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл.= 410С).
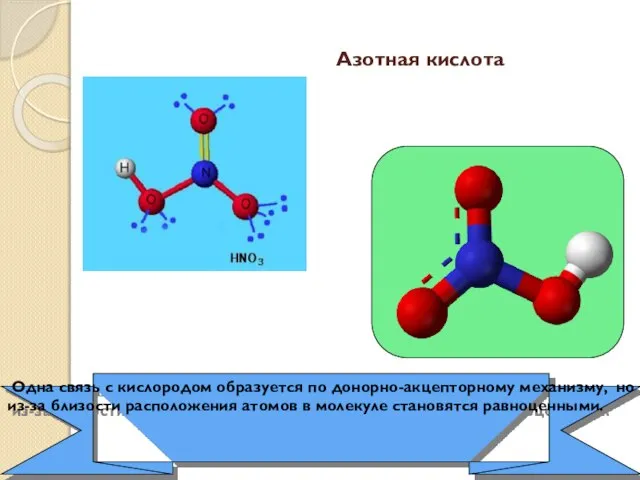
- 22. Одна связь с кислородом образуется по донорно-акцепторному механизму, но из-за близости расположения атомов в молекуле становятся
- 34. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
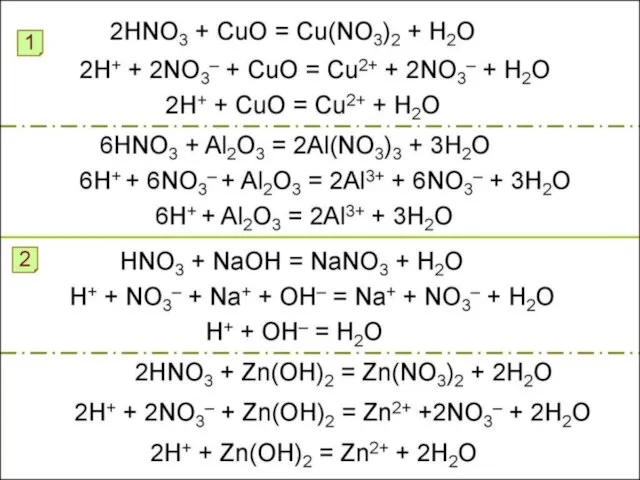
- 35. Соли азотной кислоты Как называются соли азотной кислоты? Нитраты K, Na, NH4+ называют селитрами Нитраты –
- 39. Скачать презентацию


























 Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Хімічний елемент Радій
Хімічний елемент Радій Химический состав пресных вод рыбохозяйственного назначения
Химический состав пресных вод рыбохозяйственного назначения Общее понятие о липидах. Переваривание и всасывание липидов
Общее понятие о липидах. Переваривание и всасывание липидов Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Реакции замещения и реакции обмена
Реакции замещения и реакции обмена Основания. Гидроксид
Основания. Гидроксид Презентация по Химии "Свойства воды" - скачать смотреть
Презентация по Химии "Свойства воды" - скачать смотреть 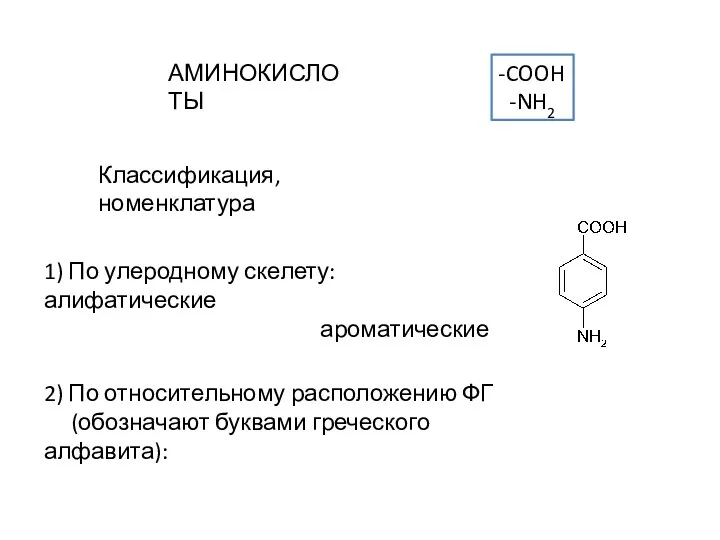 Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Синтез на основі бензену
Синтез на основі бензену Подготовка к ГИА. А8. Реакции ионного обмена и условия их осуществления
Подготовка к ГИА. А8. Реакции ионного обмена и условия их осуществления Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Коллоквиум №1. Аминокислоты. Пептиды. Белки. Липиды
Коллоквиум №1. Аминокислоты. Пептиды. Белки. Липиды Терпены и стероиды
Терпены и стероиды Влияние шампуня на состояние волос человека
Влияние шампуня на состояние волос человека Номенклатура органических соединений. Алканы
Номенклатура органических соединений. Алканы Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Оценка срока службы для полимерных материалов методами термического анализа
Оценка срока службы для полимерных материалов методами термического анализа Ферменттің қасиеті мен құрылысы
Ферменттің қасиеті мен құрылысы Презентация по Химии "В мире веществ и реакций" - скачать смотреть
Презентация по Химии "В мире веществ и реакций" - скачать смотреть  Биогеохимический цикл углерода на Земле
Биогеохимический цикл углерода на Земле 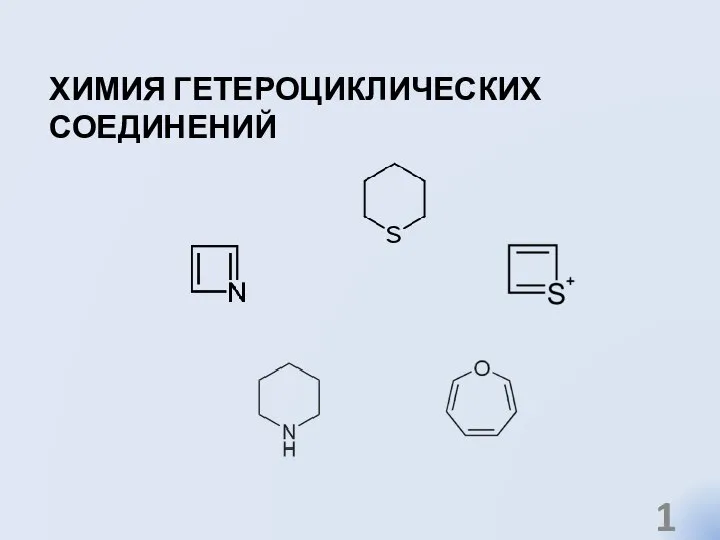 Химия гетероциклических соединений
Химия гетероциклических соединений Средства и методы стерилизации
Средства и методы стерилизации Все о витамине С и его определение в лекарственных растениях и продуктах питания
Все о витамине С и его определение в лекарственных растениях и продуктах питания Резиновое яйцо. Влияние кислоты (на примере уксусной) на кости и зубы человека
Резиновое яйцо. Влияние кислоты (на примере уксусной) на кости и зубы человека Структурні дослідження електрохімічних інтерфейсів методами малокутового розсіяння нейтронів та нейтронної рефлектометрії
Структурні дослідження електрохімічних інтерфейсів методами малокутового розсіяння нейтронів та нейтронної рефлектометрії Альдоль-кротоновая конденсация альдегидов и кетонов
Альдоль-кротоновая конденсация альдегидов и кетонов