Содержание
- 2. Радій - елемент головної підгрупи другої групи, сьомого періоду періодичної системи хімічних елементів Д. І. Менделєєва,
- 3. Радій невідривно пов'язаний з відкрили його подружжям Кюрі. Тоді, в 1886 році, вченим А. бекерелів були
- 4. Радій досить рідкісний. За минулий з моменту його відкриття час - понад століття - у всьому
- 5. Фізичні властивості Атомна маса для найстійкішого ізотопу 226Ra (період напіврозпаду бл. 1620 років) — 226,0254. Сріблясто-білий
- 6. Добування Радій виділяють з уранових руд хімічним методом. Металевий радій отримують електролізом розчину RaCl2 на ртутному
- 7. Застосування На початку XX ст. радій вважався не лише безпечним, але й корисним елементом. Його додавали
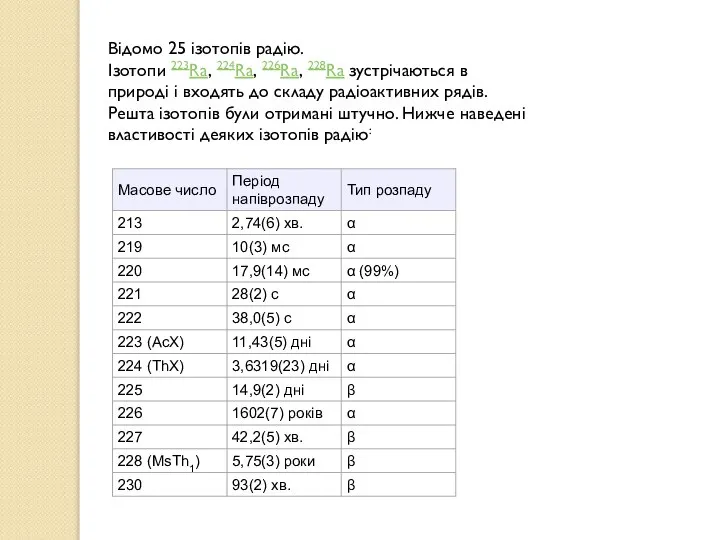
- 8. Відомо 25 ізотопів радію. Ізотопи 223Ra, 224Ra, 226Ra, 228Ra зустрічаються в природі і входять до складу
- 10. Скачать презентацию
Радій - елемент головної підгрупи другої групи, сьомого періоду періодичної системи хімічних елементів Д. І. Менделєєва,
Радій - елемент головної підгрупи другої групи, сьомого періоду періодичної системи хімічних елементів Д. І. Менделєєва,
Ступіньокиснення +2
Позначається символом Ra ( лат. Radium ). Проста речовина радій --- блискучий лужноземельний метал сріблясто-білого кольору. Має високу хімічну активність. Радіоактивний; найбільш стійкий нуклід 226 Ra (період напіврозпаду близько 1600 років).
Радій невідривно пов'язаний з відкрили його подружжям Кюрі. Тоді, в 1886
Радій невідривно пов'язаний з відкрили його подружжям Кюрі. Тоді, в 1886
Радій досить рідкісний. За минулий з моменту його відкриття час -
Радій досить рідкісний. За минулий з моменту його відкриття час -
Фізичні властивості
Атомна маса для найстійкішого ізотопу 226Ra (період напіврозпаду бл. 1620 років) — 226,0254.
Фізичні властивості
Атомна маса для найстійкішого ізотопу 226Ra (період напіврозпаду бл. 1620 років) — 226,0254.
Хімічні властивості
Реагує з водою з утворенням сильного лугу Ra(OH)2. На повітрі легко окиснюється з утворенням RaO, сполучаючись з N, дає нітрид Ra3N2.
3Ra + N2 Ra3N2
2Ra + O2 2RaO
Ra+2H2O=Ra(ОН) 2+H2↑
Добування
Радій виділяють з уранових руд хімічним методом. Металевий радій отримують електролізом розчину RaCl2 на ртутному катоді.
Отримати
Добування
Радій виділяють з уранових руд хімічним методом. Металевий радій отримують електролізом розчину RaCl2 на ртутному катоді.
Отримати
Застосування
На початку XX ст. радій вважався не лише безпечним, але й
Застосування
На початку XX ст. радій вважався не лише безпечним, але й
Радій застосовується як джерело альфа-частинок для приготування Ra-Be джерел нейтронів, для виготовлення світних фарб, у медицині — для радіотерапії та дефектоскопії, в техніці — для отримання радійберилієвих джерел нейтронів, як джерело гамма-випромінення. Радій також використовується в геохімії як індикатор змішування і циркуляції вод океанів.
Відомо 25 ізотопів радію. Ізотопи 223Ra, 224Ra, 226Ra, 228Ra зустрічаються в природі і входять до складу
Відомо 25 ізотопів радію. Ізотопи 223Ra, 224Ra, 226Ra, 228Ra зустрічаються в природі і входять до складу






 Химический брейн-ринг
Химический брейн-ринг Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева Характеристика и технология производства основных катализаторов нефтепереработки
Характеристика и технология производства основных катализаторов нефтепереработки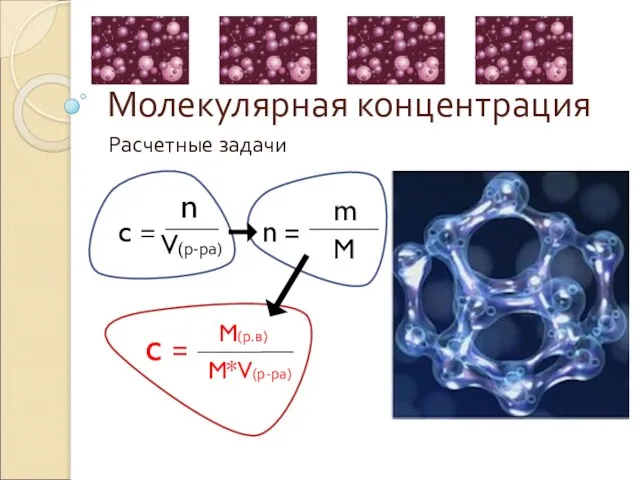 Молекулярная концентрация Расчетные задачи
Молекулярная концентрация Расчетные задачи Презентация по Химии "Мир кристаллов медного купороса" - скачать смотреть
Презентация по Химии "Мир кристаллов медного купороса" - скачать смотреть  Основные химические понятия
Основные химические понятия Закон действующих масс и его использование в расчетах. (Лекциии 4-6)
Закон действующих масс и его использование в расчетах. (Лекциии 4-6) XIII конференция ИХТРЭМС «Научно-практические проблемы в области химии и химических технологий»
XIII конференция ИХТРЭМС «Научно-практические проблемы в области химии и химических технологий» Презентация по Химии "Основные классы неогранических соединений" - скачать смотреть
Презентация по Химии "Основные классы неогранических соединений" - скачать смотреть  Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Классификация элементов. Электрохимическая цепь
Классификация элементов. Электрохимическая цепь История получения алюминия и его применение
История получения алюминия и его применение Поняття ПРО СИНТЕТИЧНІ ЛІКАРСЬКІ ЗАСОБИ НА ПРИКЛАДІ АСПІРИНУ
Поняття ПРО СИНТЕТИЧНІ ЛІКАРСЬКІ ЗАСОБИ НА ПРИКЛАДІ АСПІРИНУ Введение в органическую химию. 10 класс
Введение в органическую химию. 10 класс Green chemistry application to intermolecular forces
Green chemistry application to intermolecular forces Основы химической термодинамики
Основы химической термодинамики Поверхностная активность и поверхностно активное вещество
Поверхностная активность и поверхностно активное вещество Титан. История открытия титана
Титан. История открытия титана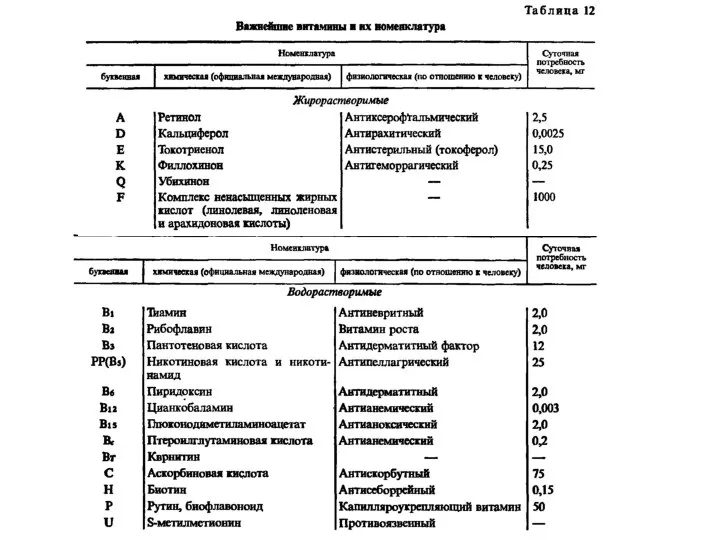 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Железоуглеродистый сплав чугун
Железоуглеродистый сплав чугун Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Презентация по Химии "Белки" - скачать смотреть бесплатно_
Презентация по Химии "Белки" - скачать смотреть бесплатно_ Понятие синтетических лекарственных препаратов
Понятие синтетических лекарственных препаратов  Фосфор в природе
Фосфор в природе Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних
Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних Презентация по Химии "Теория строения химических соединений А.М. Бутлерова" - скачать смотреть
Презентация по Химии "Теория строения химических соединений А.М. Бутлерова" - скачать смотреть  Электролиз Цель: изучить сущность процесса электролиза Задачи: раскрыть принцип работы электролизёра суть катодных и анодных
Электролиз Цель: изучить сущность процесса электролиза Задачи: раскрыть принцип работы электролизёра суть катодных и анодных