Содержание
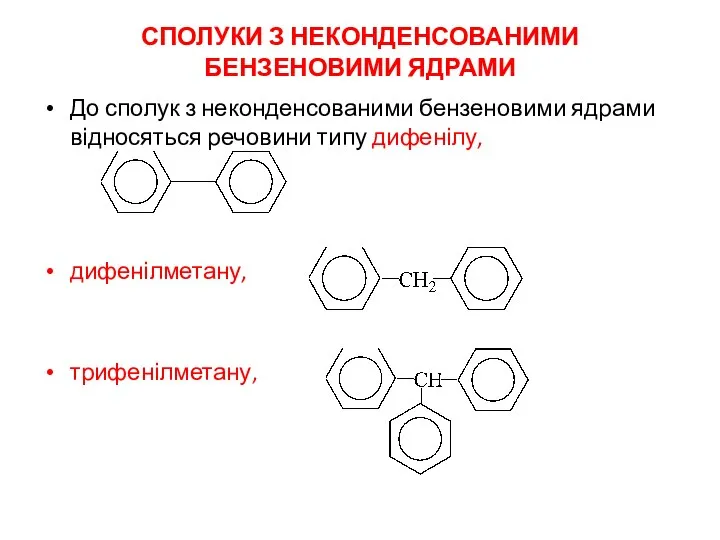
- 2. СПОЛУКИ З НЕКОНДЕНСОВАНИМИ БЕНЗЕНОВИМИ ЯДРАМИ До сполук з неконденсованими бензеновими ядрами відносяться речовини типу дифенілу, дифенілметану,
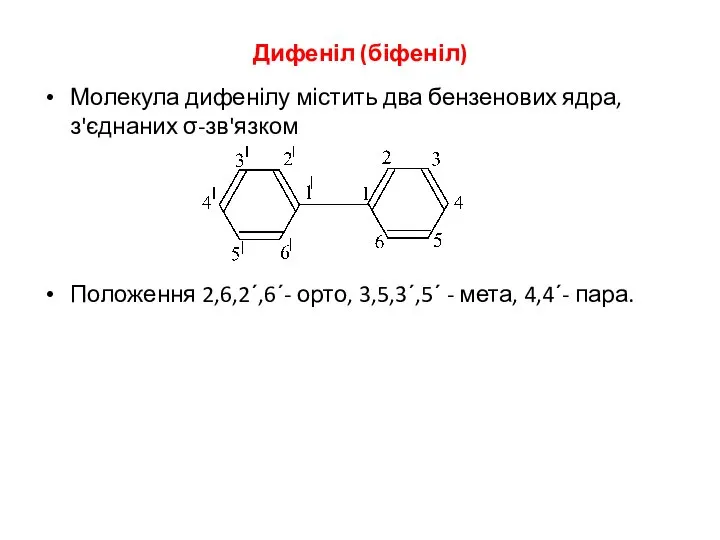
- 3. Дифеніл (біфеніл) Молекула дифенілу містить два бензенових ядра, з'єднаних σ-зв'язком Положення 2,6,2΄,6΄- орто, 3,5,3΄,5΄ - мета,
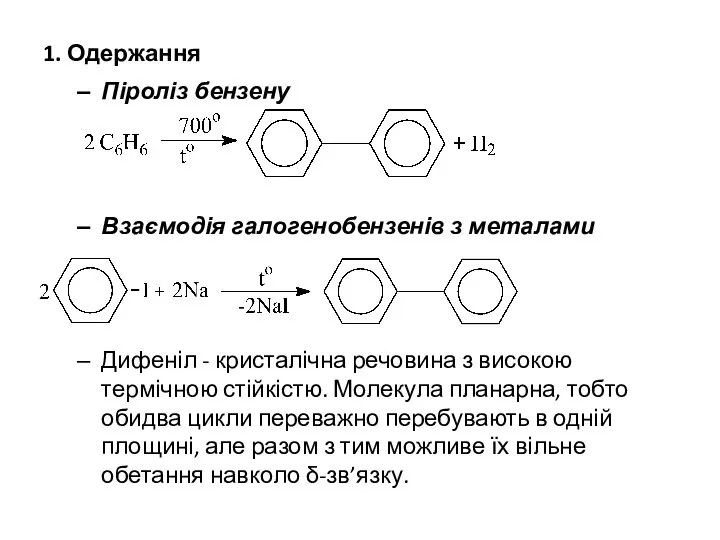
- 4. 1. Одержання Піроліз бензену Взаємодія галогенобензенів з металами Дифеніл - кристалічна речовина з високою термічною стійкістю.
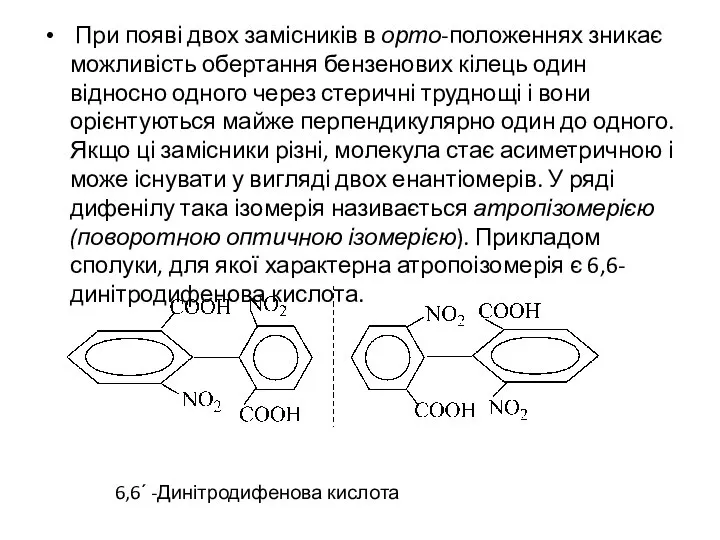
- 5. При появі двох замісників в орто-положеннях зникає можливість обертання бензенових кілець один відносно одного через стеричні
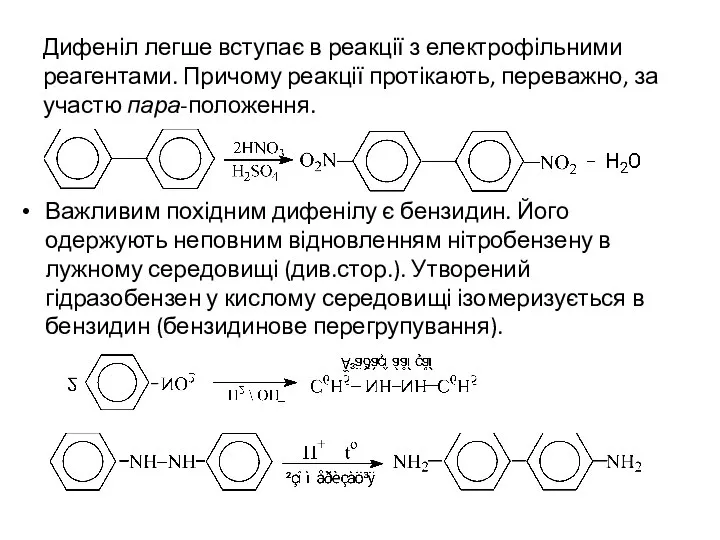
- 6. Дифеніл легше вступає в реакції з електрофільними реагентами. Причому реакції протікають, переважно, за участю пара-положення. Важливим
- 7. Дифенілметан Одержують за реакцією Фріделя-Крафтса При окисненні дифенілметан легко переходить у бензофенон За своїми хімічними властивостями
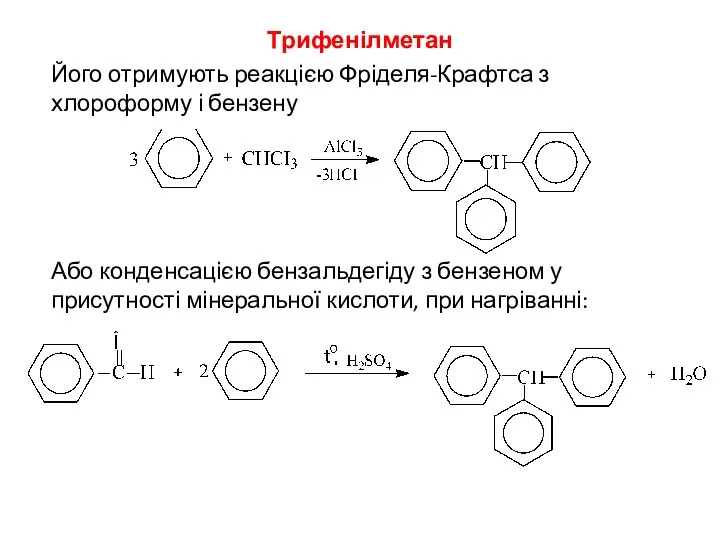
- 8. Трифенілметан Його отримують реакцією Фріделя-Крафтса з хлороформу і бензену Або конденсацією бензальдегіду з бензеном у присутності
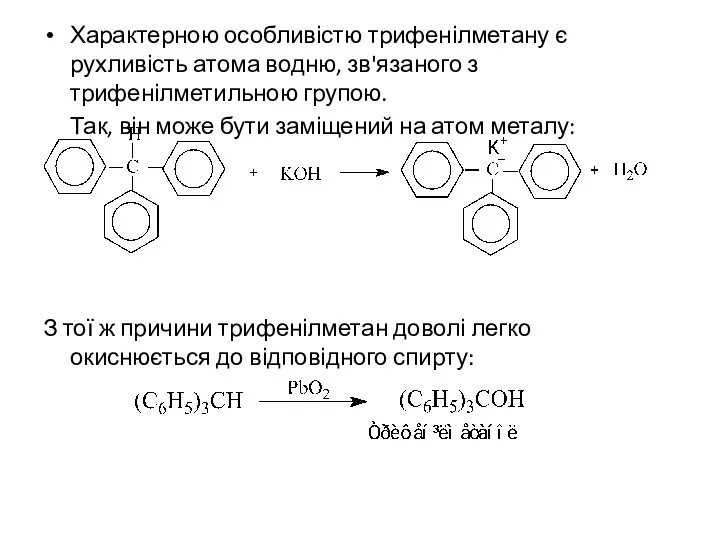
- 9. Характерною особливістю трифенілметану є рухливість атома водню, зв'язаного з трифенілметильною групою. Так, він може бути заміщений
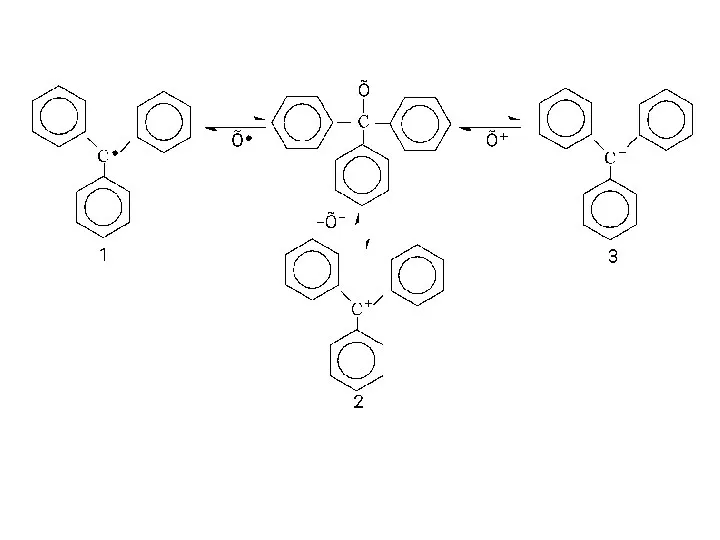
- 10. Сполуки трифенілметрильного ряду типу (С6Н5)С—Х легко дисоціюють за рахунок розриву зв’язку С—Х. В залежності від способу
- 12. Очевидно, що стабілізації вільного радикалу (1) та карбокатіону (2) буде сприяти наявність в о- або п-положеннях
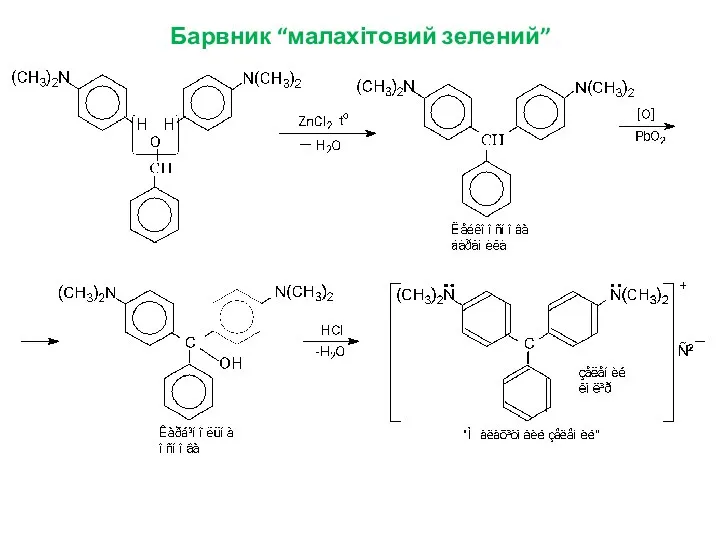
- 13. Виникнення забарвлення зумовлене утворенням спряженого трифенілметильного карбокатіону. Таке явище, коли безбарвна сполука утворює при дисоціації забарвлений
- 14. Барвник “малахітовий зелений”
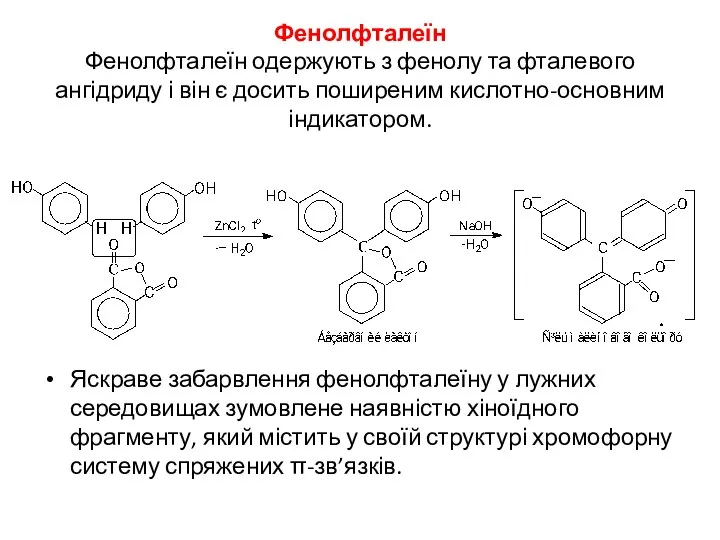
- 15. Фенолфталеїн Фенолфталеїн одержують з фенолу та фталевого ангідриду і він є досить поширеним кислотно-основним індикатором. Яскраве
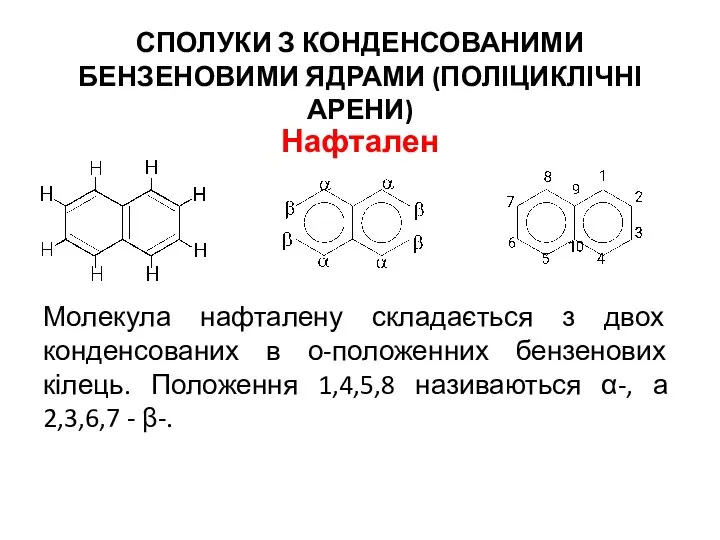
- 16. СПОЛУКИ З КОНДЕНСОВАНИМИ БЕНЗЕНОВИМИ ЯДРАМИ (ПОЛІЦИКЛІЧНІ АРЕНИ) Нафтален Молекула нафталену складається з двох конденсованих в о-положенних
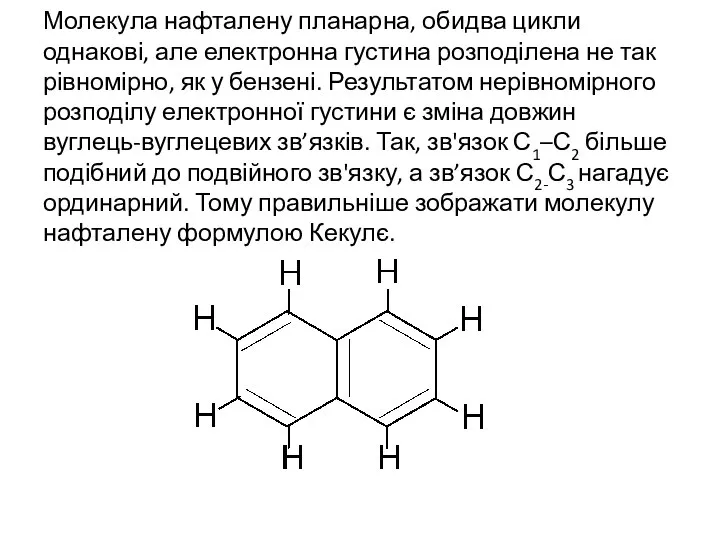
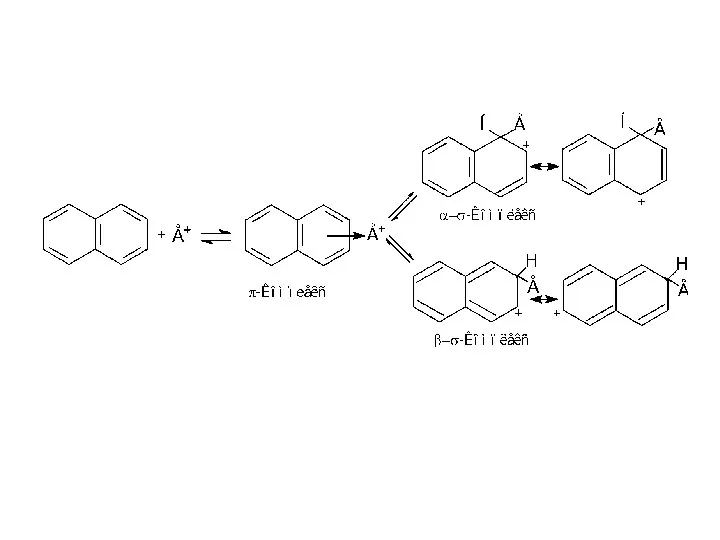
- 17. Молекула нафталену планарна, обидва цикли однакові, але електронна густина розподілена не так рівномірно, як у бензені.
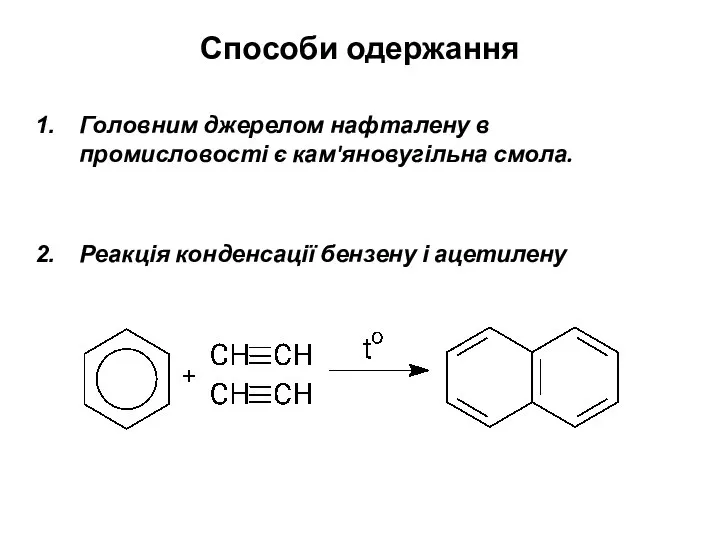
- 18. Способи одержання Головним джерелом нафталену в промисловості є кам'яновугільна смола. Реакція конденсації бензену і ацетилену
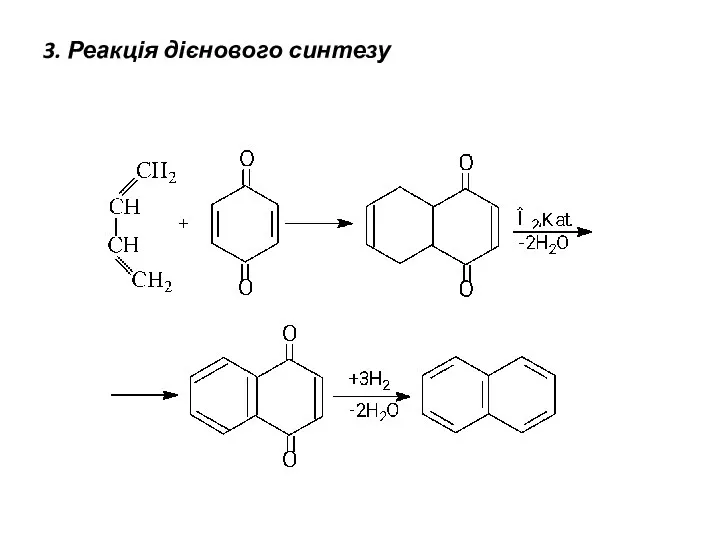
- 19. 3. Реакція дієнового синтезу
- 20. Хімічні властивості Для нафталену характерні реакції SE, а також реакції приєднання, які проходять легше, ніж для
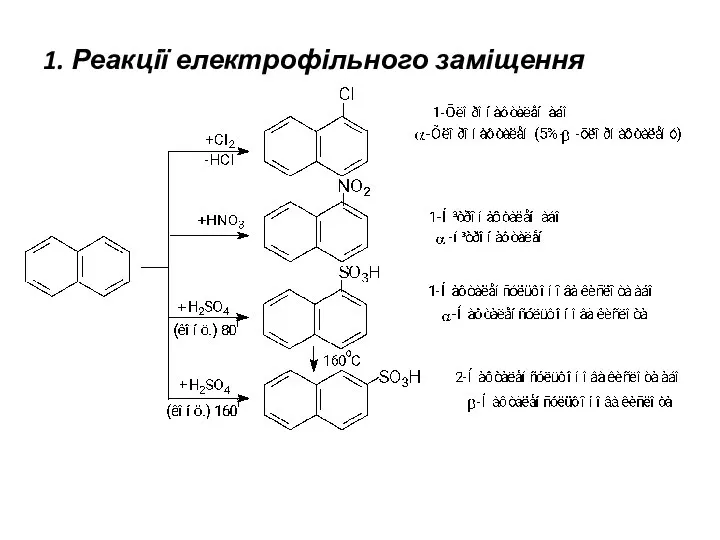
- 22. 1. Реакції електрофільного заміщення
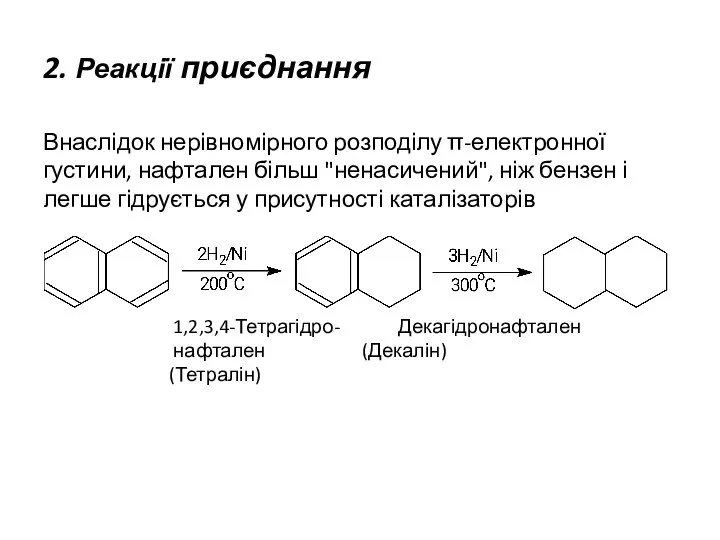
- 23. 2. Реакції приєднання Внаслідок нерівномірного розподілу π-електронної густини, нафтален більш "ненасичений", ніж бензен і легше гідрується
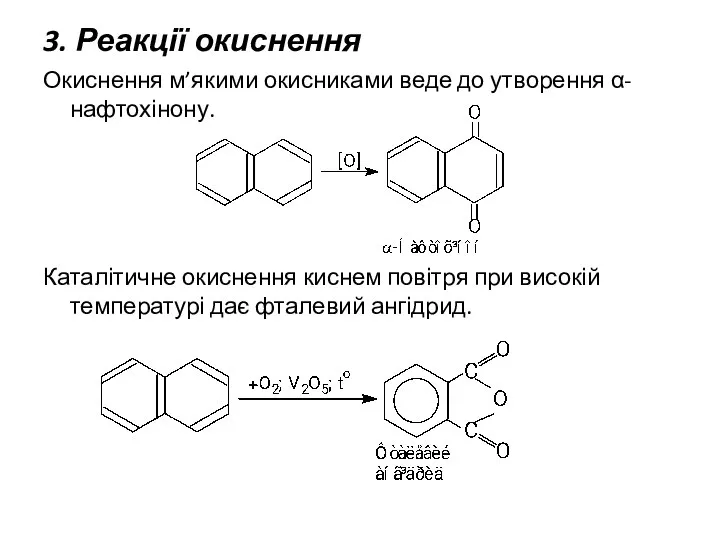
- 24. 3. Реакції окиснення Окиснення м’якими окисниками веде до утворення α-нафтохінону. Каталітичне окиснення киснем повітря при високій
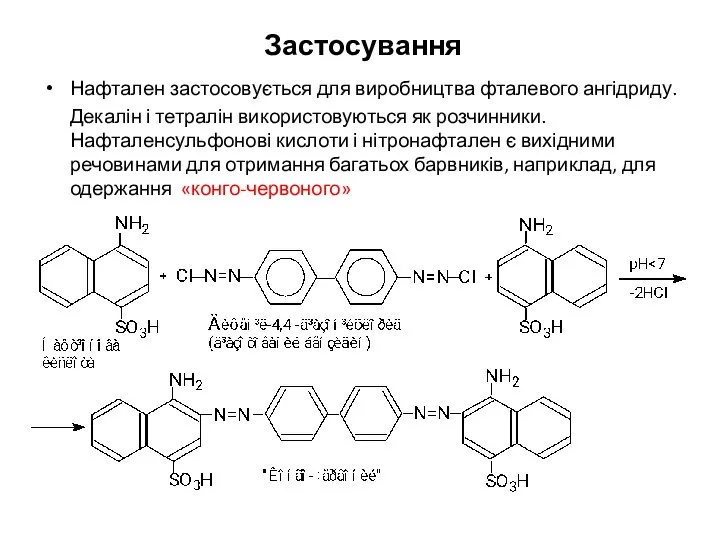
- 25. Застосування Нафтален застосовується для виробництва фталевого ангідриду. Декалін і тетралін використовуються як розчинники. Нафталенсульфонові кислоти і
- 27. Скачать презентацию





 Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Химические волокна
Химические волокна  Использование технологии критического мышления на уроках химии
Использование технологии критического мышления на уроках химии Известны три вида моделей XTС
Известны три вида моделей XTС Лужноземельні метали
Лужноземельні метали Предмет химии. Вещества и их физические свойства. (8 класс)
Предмет химии. Вещества и их физические свойства. (8 класс) Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Окислительно-восстановительные реакции. (Лекция 18)
Окислительно-восстановительные реакции. (Лекция 18) Жиры - липиды
Жиры - липиды Якісні реакції органічних речовин
Якісні реакції органічних речовин Влияние давления на скорость химических реакций с участием газов
Влияние давления на скорость химических реакций с участием газов Номенклатура органических соединений
Номенклатура органических соединений Презентация по Химии "Природные запасы углеводородов Уголь" - скачать смотреть
Презентация по Химии "Природные запасы углеводородов Уголь" - скачать смотреть  Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) Углеводы
Углеводы Формалин және оның негізгі қасиеттері
Формалин және оның негізгі қасиеттері Составление формул по валентности
Составление формул по валентности Диоксиндер, полихлорланған бифинилдер және басқа да полигалогенделген көмірсулар. Тағам өнімдерін ластау көзі ретінде
Диоксиндер, полихлорланған бифинилдер және басқа да полигалогенделген көмірсулар. Тағам өнімдерін ластау көзі ретінде Солі амонію
Солі амонію  Непредельные углеводороды. (Лекция 6)
Непредельные углеводороды. (Лекция 6) Возникновение и развитие понятия валентность в период с 1850 по 1865 гг
Возникновение и развитие понятия валентность в период с 1850 по 1865 гг Кислотоустойчивость пробиотических культур
Кислотоустойчивость пробиотических культур Этот удивительный песок
Этот удивительный песок Кислотные дожди
Кислотные дожди  Презентація на тему «Основи»
Презентація на тему «Основи»  «Теллур»
«Теллур» Кристаллические решётки
Кристаллические решётки Ovqatlanish biokimyosi
Ovqatlanish biokimyosi