Содержание
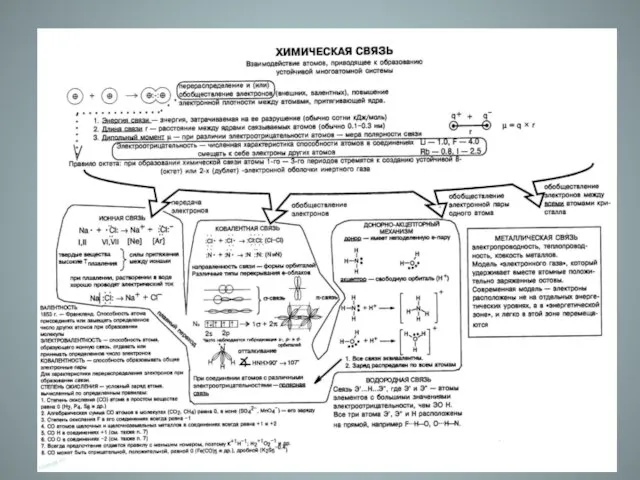
- 3. Ионная связь- прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей,
- 4. Электроотрицательность - способность атомов одних химических элементов притягивать электроны в соединениях от атомов других химических элементов
- 5. Запомни!!! полного перехода электронов при образовании ионной химической связи не происходит. Об этом свидетельствуют величины эффективных
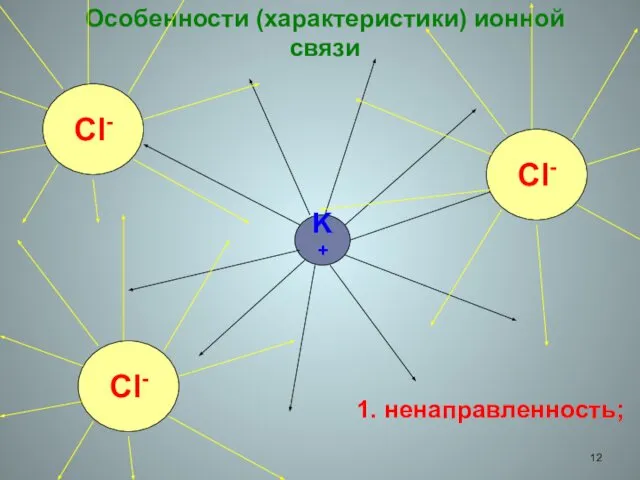
- 12. Особенности (характеристики) ионной связи K+ Cl- Cl- Cl- 1. ненаправленность;
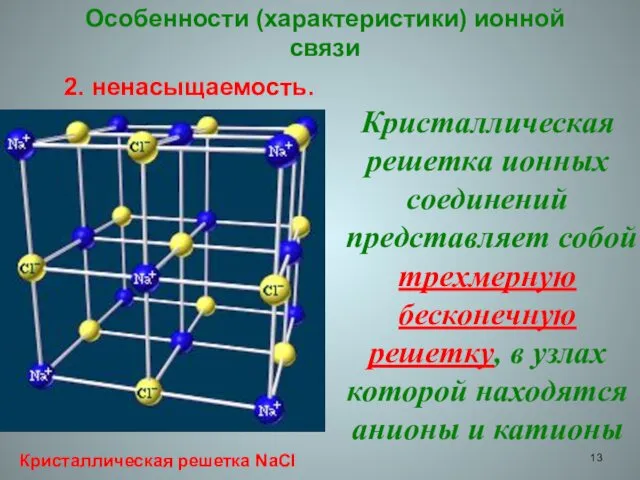
- 13. Особенности (характеристики) ионной связи 2. ненасыщаемость. Кристаллическая решетка ионных соединений представляет собой трехмерную бесконечную решетку, в
- 14. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщенности. Поэтому
- 15. Вещества с ионной связью образуют ионную кристаллическую решетку. Вещества с ионной кристаллической решеткой имеют прочную химическую
- 18. Металлическая связь.
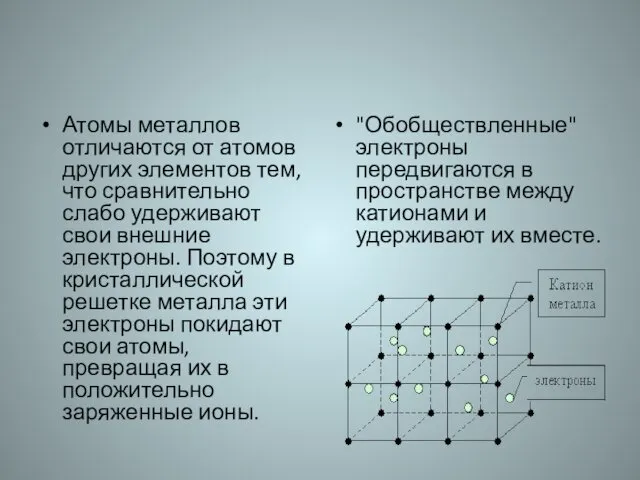
- 21. Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому
- 22. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи
- 25. Самый пластичный металл- золото. Из 1 г золота можно вытянуть проволоку длиной 2,4 км. Самая большая
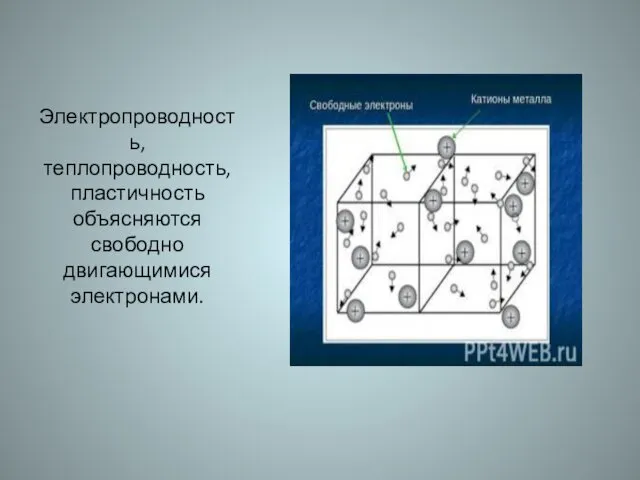
- 27. Электропроводность, теплопроводность, пластичность объясняются свободно двигающимися электронами.
- 28. Водородная связь -форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным
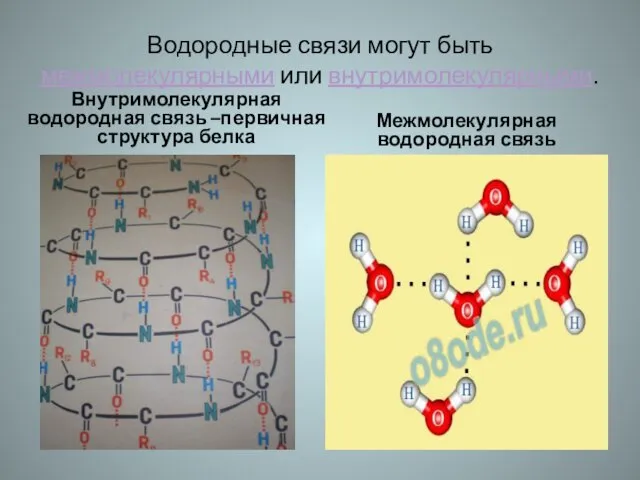
- 29. Водородные связи могут быть межмолекулярными или внутримолекулярными. Внутримолекулярная водородная связь –первичная структура белка Межмолекулярная водородная связь
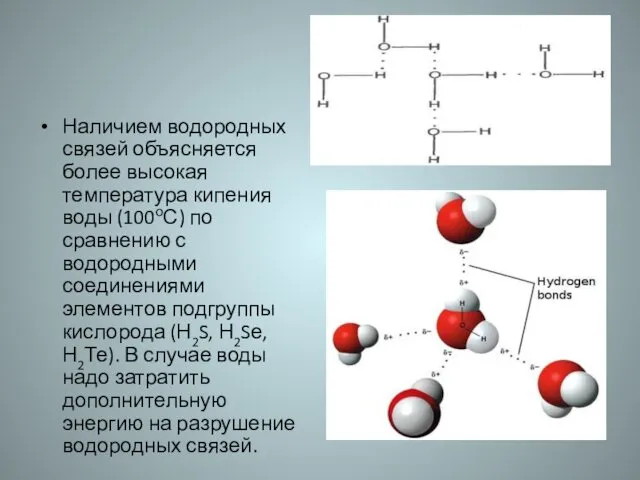
- 31. Наличием водородных связей объясняется более высокая температура кипения воды (100оС) по сравнению с водородными соединениями элементов
- 34. Водородная связь оказывает влияние на свойства многих веществ. Так, благодаря водородной связи фтороводород в обычных условиях
- 36. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии
- 37. Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную
- 39. Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную
- 40. Вопрос: Сравните температуры кипения соответствующих (по числу атомов С) алканов, спиртов, альдегидов и карбоновых кислот. Какие
- 41. Водородная связь в ряду рассматриваемых соединений – это межмолекулярная связь между кислородом одной молекулы и гидроксильным
- 42. Справочная информация: электроотрицательность атомов: С – 2,5; Н – 2,1; О – 3,5. Распределение электронной плотности
- 43. В ы в о д. В гомологических рядах спиртов и карбоновых кислот отсутствуют газообразные вещества и
- 44. Что можно сказать о растворимости спиртов, альдегидов и карбоновых кислот в воде? Чем объясняется растворимость этих
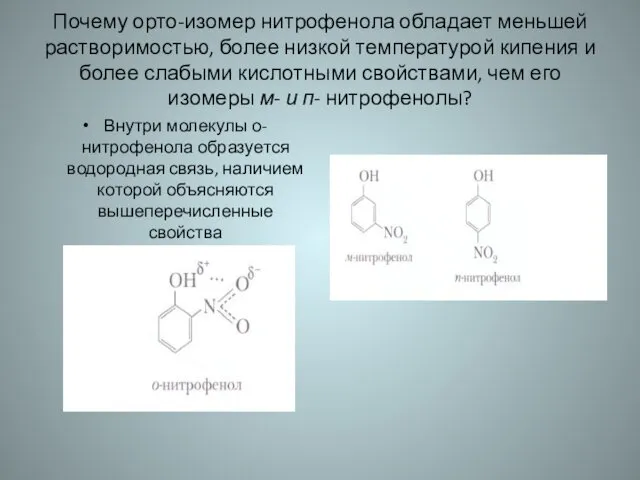
- 45. Почему орто-изомер нитрофенола обладает меньшей растворимостью, более низкой температурой кипения и более слабыми кислотными свойствами, чем
- 46. ВЫВОД:
- 48. Скачать презентацию




































 Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Химия в сельском хозяйстве.
Химия в сельском хозяйстве.  Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті
Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Методы анализа вещества
Методы анализа вещества Типы химических реакций в неорганической и органической химии
Типы химических реакций в неорганической и органической химии Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана
Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана Проект – дослідження мило Dove Роботу виконала учениця 11 класу Бабенко Аліна Віталіївна
Проект – дослідження мило Dove Роботу виконала учениця 11 класу Бабенко Аліна Віталіївна  Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Многоликая уксусная кислота
Многоликая уксусная кислота Распознавание химических соединений
Распознавание химических соединений Формирование ответственного отношения школьников к окружающей среде родного края на уроках химии и во внеурочное время.
Формирование ответственного отношения школьников к окружающей среде родного края на уроках химии и во внеурочное время.  Бионеорганическая химия. Комплексообразование в организме. (Лекция 3)
Бионеорганическая химия. Комплексообразование в организме. (Лекция 3) Глюкоза, ее строение и свойства
Глюкоза, ее строение и свойства Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Презентация по Химии "ЛИПИДНЫЙ ОБМЕН" - скачать смотреть бесплатно
Презентация по Химии "ЛИПИДНЫЙ ОБМЕН" - скачать смотреть бесплатно Строение атома
Строение атома Коррозия железа
Коррозия железа Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман
Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман  Искусственные или технические битумы
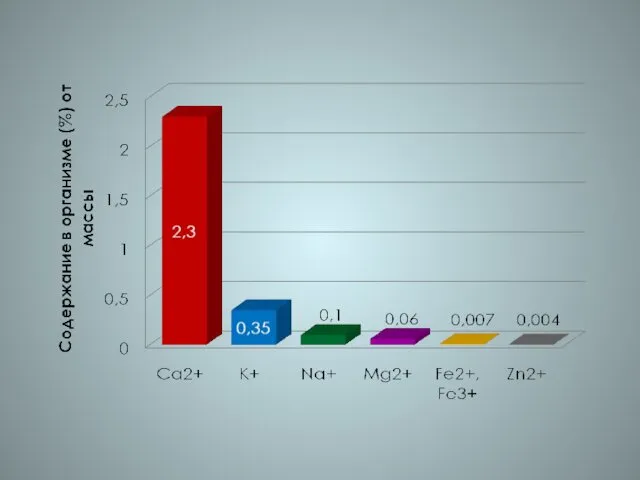
Искусственные или технические битумы Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Оксид фосфора P2O5
Оксид фосфора P2O5 Методы выращивания кристаллов
Методы выращивания кристаллов Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Химические свойства алкадиенов и алкинов
Химические свойства алкадиенов и алкинов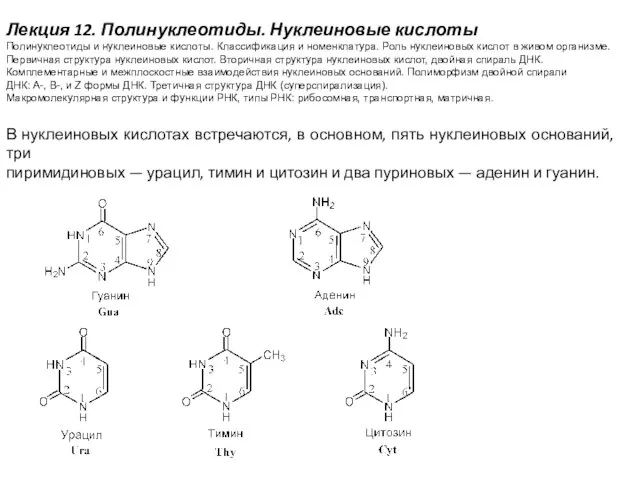 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты