Содержание
- 2. 1 14.09.2016 Урок 9 класса. Электролитическая диссоциация.
- 3. 2 Электролиты 14.09.2016 Когда электролит попадает в воду он «разваливается» на составляющие его катионы и анионы.
- 4. 3 Растворение 14.09.2016 NaCl = Na+ + Cl- Долгое время считалось, что процесс растворения имеет только
- 5. 4 Вода как растворитель 14.09.2016 Почему вода растворитель?
- 6. 5 Вода как растворитель 14.09.2016
- 7. 1 15.09.2016 Урок 9 класса. Электролитическая диссоциация. Продолжение…
- 8. 6 Вода как растворитель 15.09.2016
- 9. 7 Вода как растворитель 16.09.2016 Вещества с какой связь лучше будут растворяться в воде? С ковалентной
- 10. 8 Правило растворимости 15.09.2016 Подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу.
- 11. 9 Гидратация 15.09.2016 Гидратация – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют
- 12. 10 Гидратация 15.09.2016 Кристаллогидраты – кристаллические вещества, в состав которых входит химически связанная вода. Такую воду
- 13. 11 Основные положения электролитической диссоциации 15.09.2016 Основные положения теории электролитической диссоциации: Электролиты при растворении или плавлении
- 14. 12 Диссоциация разных веществ 15.09.2016 Диссоциировать могут соли, кислоты, щелочки. Наиболее хорошо диссоцируют вещества с ионной
- 15. 13 Диссоциация кислот 15.09.2016 Кислоты – такие вещества, при диссоциации в водных растворах которых в качестве
- 16. 14 Диссоциация кислот 15.09.2016 H2SO4 HSO4- + H+ HSO4- SO42- + H+ H3PO4 H+ +H2PO4- H2PO4-
- 17. 15 Диссоциация щелочей 15.09.2016 Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы
- 18. 16 Диссоциация солей 15.09.2016 Соли – сложные вещества, которые в водных растворах диссоциируют на катионы металлов
- 19. 17 Сильные и слабые электролиты 15.09.2016 Бывают электролиты распадающиеся полностью, например: NaOH Na+ + OH- Бывают
- 20. 18 Степень диссоциации 15.09.2016 Различить слабые электролиты и сильные электролиты помогает показатель степень диссоциации (α).
- 22. Скачать презентацию



















 Кинетика химических реакций. (Лекция 12)
Кинетика химических реакций. (Лекция 12) Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений
Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура соединений Исследование химического состава шоколада и способов его приготовления
Исследование химического состава шоколада и способов его приготовления Природные источники углеводородов
Природные источники углеводородов Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ
Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ Химические свойства карбокатионов
Химические свойства карбокатионов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла Химия переходных элементов
Химия переходных элементов ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале
ОКСИДИ – це бінарні сполуки , що складаються з двох елементів , одним з яких є Оксиген . Загальна формула оксидів : E2On n – вале Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие
Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Презентация по Химии "Азотная кислота" - скачать смотреть
Презентация по Химии "Азотная кислота" - скачать смотреть  Історія виникнення мила Розмаїтого Дмитра, 9-Б клас
Історія виникнення мила Розмаїтого Дмитра, 9-Б клас  Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Тривиальные названия неорганических соединений
Тривиальные названия неорганических соединений Структура аминокислот
Структура аминокислот Дифференцированный подход в обучении химии
Дифференцированный подход в обучении химии Физико-химические методы анализа
Физико-химические методы анализа Кинетические методы анализа
Кинетические методы анализа Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы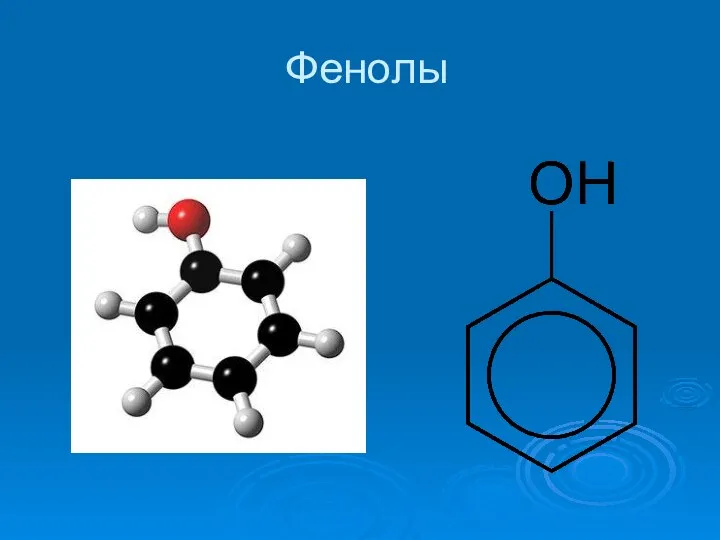 Фенолы. Физические свойства. Получение
Фенолы. Физические свойства. Получение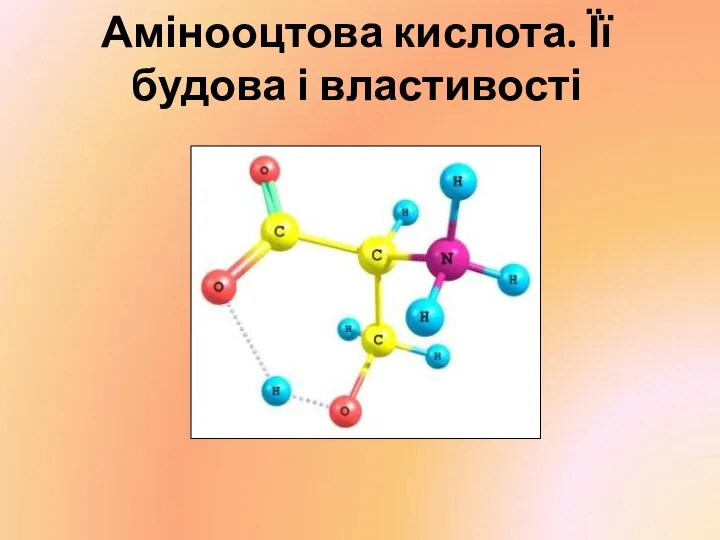 Амінооцтова кислота. Її будова і властивості
Амінооцтова кислота. Її будова і властивості Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері Пища, с точки зрения химика
Пища, с точки зрения химика Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией  Классификация минералов по химическому принципу
Классификация минералов по химическому принципу