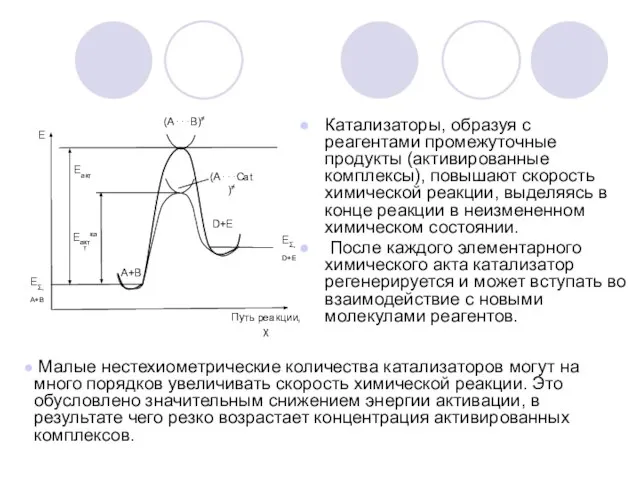
Для индикаторной реакции nA + mB ⇔ AnBm
связь между скоростью реакции
и концентрацией реагирующих веществ выражается в виде:
Где: k – наблюдаемая скорость реакции, τ - время, [A], [B] – концентрации реагентов А и В; n, m – стехиометрические коэффициенты.
Внимание! Перед производной ставится знак «+», если индикаторное вещество образуется в ходе реакции, а «−», если оно расходуется.
Если [B]>>[A] , то [B]=const, тогда
где k’=k⋅[B].
Интегрируем:
- Основное уравнение кинетических методов.
Обычно используются уравнения первого порядка (n=1).





 Регуляция углеводного обмена
Регуляция углеводного обмена Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть
Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть  Синтез липидов
Синтез липидов Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева
Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Ароматические амины
Ароматические амины Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Липиды. Классификация липидов
Липиды. Классификация липидов Бензин. Производство бензина
Бензин. Производство бензина Химическая связь
Химическая связь Семь интересных фактов о метиловом спирте
Семь интересных фактов о метиловом спирте Альдегиды: химические свойства и применение
Альдегиды: химические свойства и применение Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф
Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф Алкины. Этин (Ацетилен)
Алкины. Этин (Ацетилен) Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Дисперсные системы и растворы
Дисперсные системы и растворы Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай
Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай  Роль отечественных и зарубежных ученых в развитии неорганической химии
Роль отечественных и зарубежных ученых в развитии неорганической химии Презентация по Химии "Золото" - скачать смотреть
Презентация по Химии "Золото" - скачать смотреть  Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно
Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно Васильева Е.А. – учитель географии МОУ СОШ п. Солидарность Елецкого муниципального района Липецкой области
Васильева Е.А. – учитель географии МОУ СОШ п. Солидарность Елецкого муниципального района Липецкой области Химическая кинетика
Химическая кинетика Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Промышленная очистка воды
Промышленная очистка воды Хімія та обмін ліпідів
Хімія та обмін ліпідів Электролитическая диссоциация
Электролитическая диссоциация Коллигативные свойства растворов
Коллигативные свойства растворов