Содержание
- 2. Электролиз - это совокупность процессов, которые протекают на электродах при прохождении постоянного электрического тока через растворы
- 3. Для проведения процесса электролиза используют специальные устройства – электролизеры.
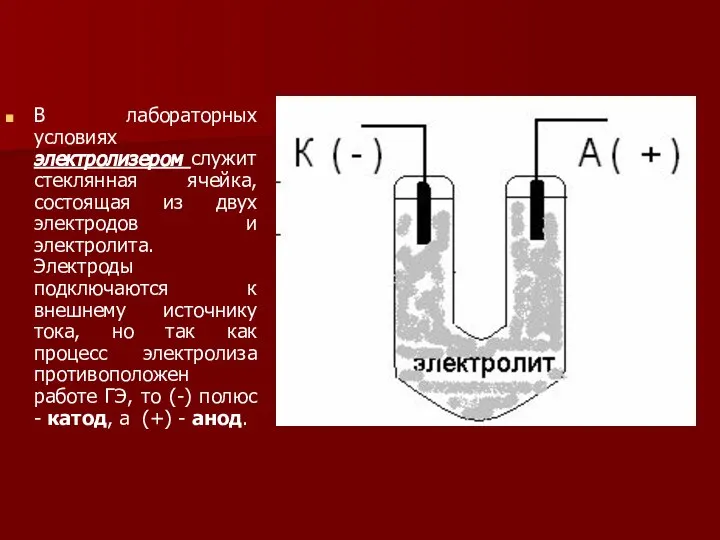
- 4. В лабораторных условиях электролизером служит стеклянная ячейка, состоящая из двух электродов и электролита. Электроды подключаются к
- 5. На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно
- 6. Аноды могут быть: растворимые, активные, когда в процессе электролиза окисляется материал анода (Zn, Fe,Cu); нерастворимые, инертные,
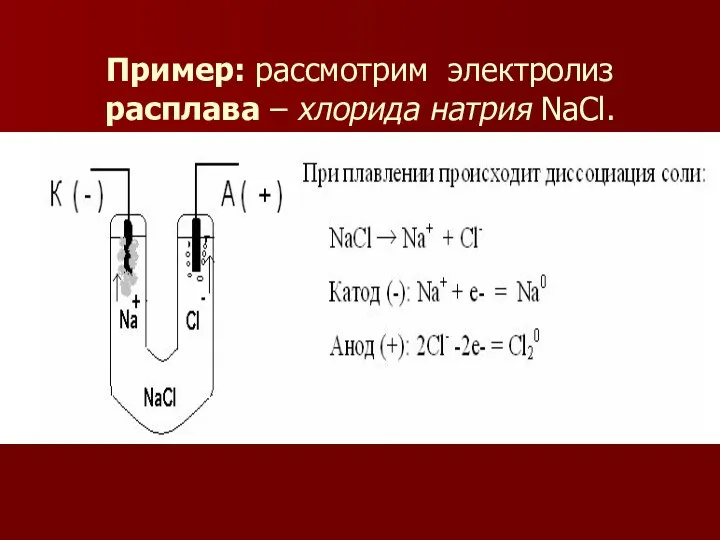
- 7. Пример: рассмотрим электролиз расплава – хлорида натрия NaCl.
- 8. На катоде - идет процесс восстановления катионов Na+ электронами внешнего источника тока. Одновременно на аноде протекает
- 9. Растворы электролитов В случае электролиза растворов электролита следует учитывать, что кроме ионов электролита МеА → Ме(+)
- 10. В водных растворах процессы осложняются за счет конкуренции воды, электродной поляризации (перенапряжение) и вторичных процессов. Электродная
- 11. Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами. Перенапряжение металлов настолько мало, что им
- 12. ПОСЛЕДОВАТЕЛЬНОСТЬ ПРОТЕКАНИЯ ЭЛЕКТРОДНЫХ ПРОЦЕССОВ: На электродах в первую очередь протекают те процессы, которые требуют меньшей затраты
- 13. Рассмотрим восстановление катионов из водных растворах на К (-):
- 14. Рассмотрим окисление анионов из водных растворах на А (+):
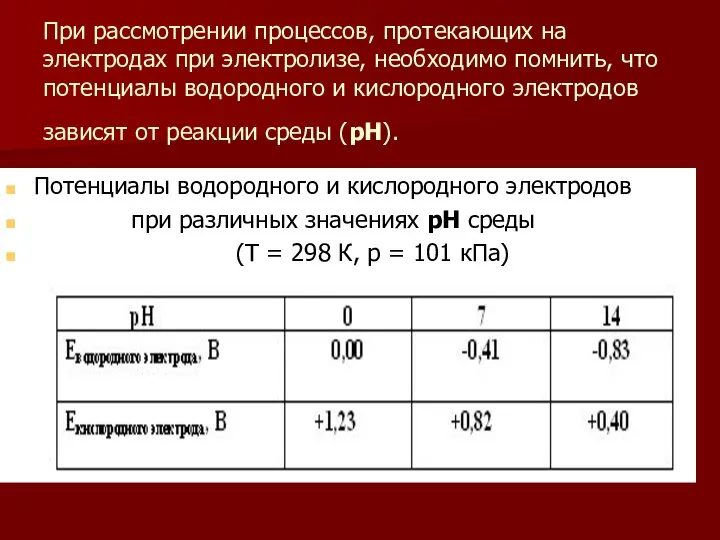
- 15. При рассмотрении процессов, протекающих на электродах при электролизе, необходимо помнить, что потенциалы водородного и кислородного электродов
- 16. Пример: рассмотрим электролиз водного раствора – хлорида натрия NaCl На аноде окисляются анионы Сl−, а не
- 17. Рассмотрим пример электролиза раствора электролита (К2SO4) с инертным анодом:
- 18. При таком соотношении потенциалов в первую очередь будет восстанавливаться вода: . По соотношению потенциалов на аноде
- 19. 3. Электролиз раствора с активным анодом Cu - активный анод, в качестве электролита - водный раствор
- 20. На аноде могут окисляться три вещества: анионы электролита, молекулы воды и сам активный анод. По соотношению
- 21. В силу диффузии ионы меди из анодного пространства, где их концентрация высока, будут перемещаться к катоду.
- 22. ЗАКОНЫ ЭЛЕКТРОЛИЗА Законы Фарадея Законы Фарадея являются количественными законами электролиза. Первый закон Фарадея: Масса вещества, выделяющегося
- 23. Второй закон Фарадея: При прохождении через расплав или раствор электролита 96500 Кл электричества на электродах выделяется
- 24. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Широко используется в различных областях промышленности. В химической промышленности распространенным является электролиз раствора NaCl
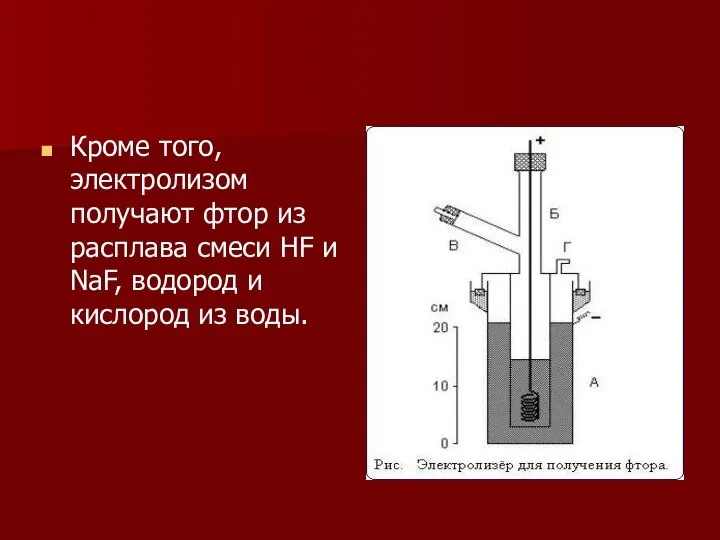
- 25. Кроме того, электролизом получают фтор из расплава смеси HF и NaF, водород и кислород из воды.
- 27. Скачать презентацию




















 Химический элемент кремний
Химический элемент кремний Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит
Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит Строение атома
Строение атома Органическая химия. Тема №12
Органическая химия. Тема №12 Лекарственные растения и сырье, содержащие дубильные вещества
Лекарственные растения и сырье, содержащие дубильные вещества Кремень –камень 1824г.Я. Берцелиус
Кремень –камень 1824г.Я. Берцелиус  Химическая термодинамика и биоэнергетика. Второй закон термодинамики
Химическая термодинамика и биоэнергетика. Второй закон термодинамики Азотистый обмен. Взаимосвязь обменов
Азотистый обмен. Взаимосвязь обменов Стехиометрия. Стехиометрические расчеты
Стехиометрия. Стехиометрические расчеты Важнейшие понятия химии и их взаимосвязь
Важнейшие понятия химии и их взаимосвязь Аттестационная работа. Проектно-исследовательская деятельность по предмету химия
Аттестационная работа. Проектно-исследовательская деятельность по предмету химия Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары
Мұнай қалдықтарын гидроөңдеу процестері. Катализаторлары Введение в биохимию
Введение в биохимию Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Алкины и их свойства
Алкины и их свойства Электрохимические технологии неорганических веществ
Электрохимические технологии неорганических веществ Отношение масс элементов в веществе. Массовые доли элементов в веществе
Отношение масс элементов в веществе. Массовые доли элементов в веществе Тема: Серная кислота, строение, свойства. Выполнила: учитель химии Конохова Елена Дмитриевна
Тема: Серная кислота, строение, свойства. Выполнила: учитель химии Конохова Елена Дмитриевна  Простые вещества
Простые вещества КАРБАМІД
КАРБАМІД  Презентация по Химии "Коррозия металлов" - скачать смотреть
Презентация по Химии "Коррозия металлов" - скачать смотреть  Инфракрасная спектроскопия. Спирты и фенолы
Инфракрасная спектроскопия. Спирты и фенолы Ovqatlanish biokimyosi
Ovqatlanish biokimyosi Лабораторная №5. Карбоновые кислоты
Лабораторная №5. Карбоновые кислоты Простейшие операции с веществом (химический практикум). Приёмы обращения с лабораторным оборудованием
Простейшие операции с веществом (химический практикум). Приёмы обращения с лабораторным оборудованием Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Белки, или протеины
Белки, или протеины