Электролиз Цель: изучить сущность процесса электролиза Задачи: раскрыть принцип работы электролизёра суть катодных и анодных
Содержание
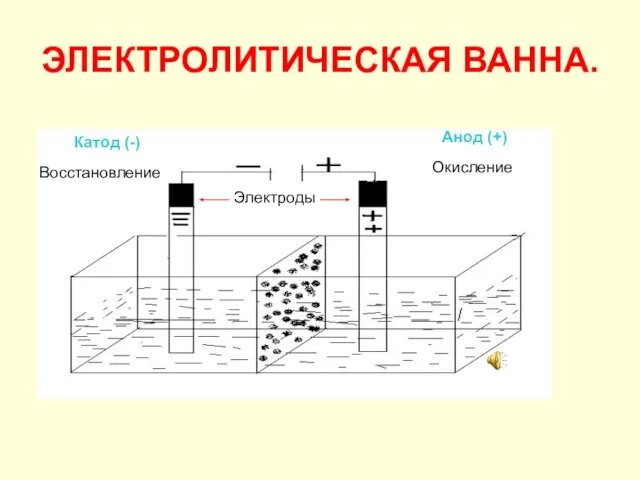
- 2. ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА. Катод (-) Анод (+) Восстановление Окисление Электроды
- 3. Электролиз. Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или
- 4. Процессы на катоде 1. Катионы активных металлов: Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+, Mg2+, Al3+,
- 5. Процессы на катоде 2. Катионы металлов средней активности Mn2+, Zn2+, Cr3+, Fe2+, Co2+, Ni2+, Sn2+, Pb2+
- 6. Процессы на катоде 3. Катионы водородаH+ Ионы H+ восстанавливаются только при электролизе растворов кислот: 2H++ 2ē
- 7. Процессы на катоде 4. Катионы малоактивных металлов: Cu2+, Hg2+, Ag+, Pt2+, Au3+ Восстанавливаются только катионы металлов:
- 8. Процессы на аноде 1-2 1) Анионы бескислородных кислот: I–, Br–, S2–, Cl– Окисляются кислотные остатки Am–
- 9. Процессы на аноде 3-4. 3) Анионы кислородсодержащих кислот: SO42–, NO3–, CO32–, PO43– Окисляются молекулы воды: 2H2O
- 10. Если анод растворимый Анод растворимый (активный), изготовлен из Cu, Ag, Zn, Ni, Fe и др. металлы.
- 11. Электролиз расплавов Расплав KOH = K+ + OH– (–) Катод: K+ + 1ē = Ko │х
- 12. Электролиз раствора NaCl Раствор NaCl (–) Катод ← Na+ Cl– → (+) Анод H2O H2O (–)
- 13. Если анод растворимый Анод растворимый. Электролиз раствора AgNO3 (анод растворимый – из Ag) (–) Катод: Ag+
- 14. Законы электролиза. Законы Фарадея. Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшее через
- 16. Скачать презентацию












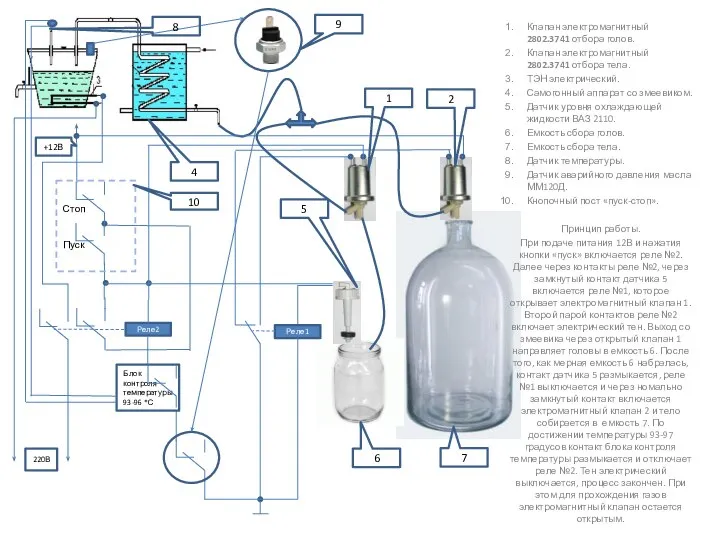 Самогонный аппарат
Самогонный аппарат Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Равновесия в гетерогенных системах
Равновесия в гетерогенных системах AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары
Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары Презентация по Химии "Органические вещества. Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Органические вещества. Нуклеиновые кислоты" - скачать смотреть  Презентация по Химии "Природные источники углеводородов" - скачать смотреть
Презентация по Химии "Природные источники углеводородов" - скачать смотреть  Техника безопасности при работе с серной кислотой
Техника безопасности при работе с серной кислотой Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы
Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы Гетероциклді қосылыстар. Алкалоидтар
Гетероциклді қосылыстар. Алкалоидтар Теория растворов. Механизм растворения газов, жидкостей и твердых тел. Способы выражения концентраций растворов
Теория растворов. Механизм растворения газов, жидкостей и твердых тел. Способы выражения концентраций растворов Химия элементов IVA группы
Химия элементов IVA группы Базальты. Классификация основных пород
Базальты. Классификация основных пород Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23)
Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23) Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Характеристика химического элемента S
Характеристика химического элемента S Химическое сопротивление эластомеров. Резины. Дерево
Химическое сопротивление эластомеров. Резины. Дерево Вольтамперометрия
Вольтамперометрия Строение атома углерода Валентные состояния атома углерода
Строение атома углерода Валентные состояния атома углерода Алкены. Свойства. 10 класс
Алкены. Свойства. 10 класс Способы выражения состава раствора
Способы выражения состава раствора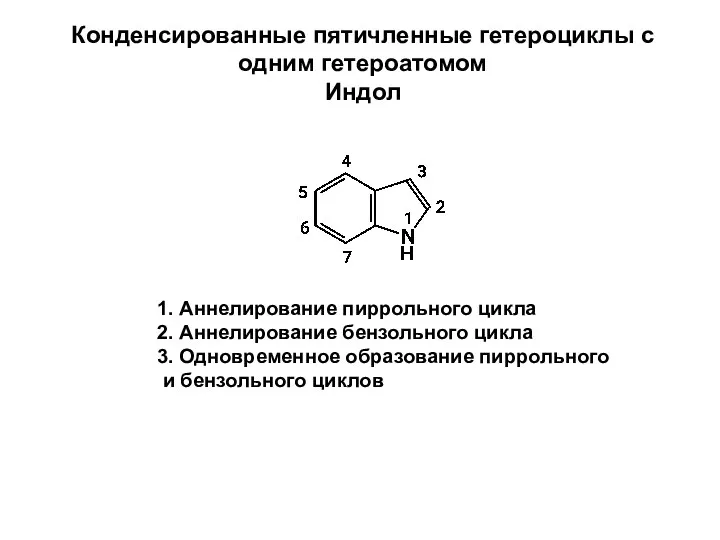 Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол
Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол Гетерогенные реакции в растворах электролитов
Гетерогенные реакции в растворах электролитов Пищевые отравления солями тяжелых металлов Zn, Cu, Pb, Hg, Cd. Гигиенические требования к посуде пищевого назначения
Пищевые отравления солями тяжелых металлов Zn, Cu, Pb, Hg, Cd. Гигиенические требования к посуде пищевого назначения Ковалентная химическая связь. 11 класс
Ковалентная химическая связь. 11 класс Классификация химических веществ СГС
Классификация химических веществ СГС Альдегиды. (10 класс)
Альдегиды. (10 класс) Anti-food. Classification of food additives
Anti-food. Classification of food additives