Содержание
- 2. План характеристики на примере S Положение элемента и строение его атомов (S – находится во 3
- 3. План характеристики на примере S Состав высшего гидроксида, его характер (H2SO4 – кислородосодержащая кислота) Состав летучего
- 4. На таблице отметить изменение свойств Заряд ядра Число энергетических уровней Число электронов на внешнем уровне Радиус
- 5. Восстановительные и окислительные свойства: Вос. Свойства – способность отдавать е Окис. Свойства – способность притягивать е
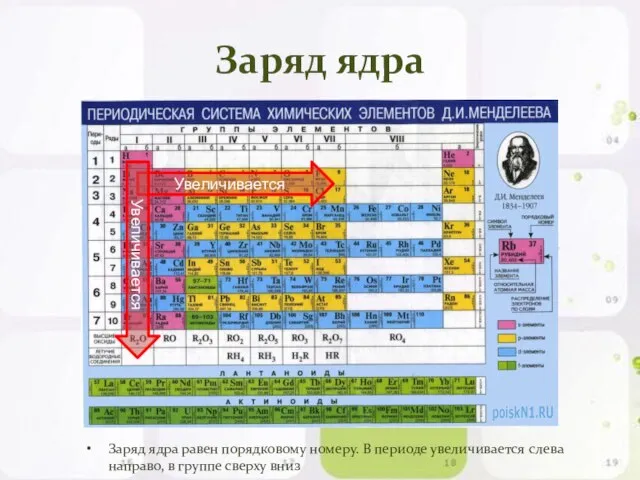
- 6. Заряд ядра Заряд ядра равен порядковому номеру. В периоде увеличивается слева направо, в группе сверху вниз
- 7. Число энергетических уровней Число энергетических (электронных) уровней равно номеру периода В периоде не изменяется Увеличивается
- 8. Число электронов на внешнем уровне Число электронов на внешнем уровне равно номеру группы (у побочной подгруппы
- 9. Электроотрицательность ЭО – способность элемента притягивать к себе электроны. Есть ряд электроотрицательности Увеличивается Увеличивается
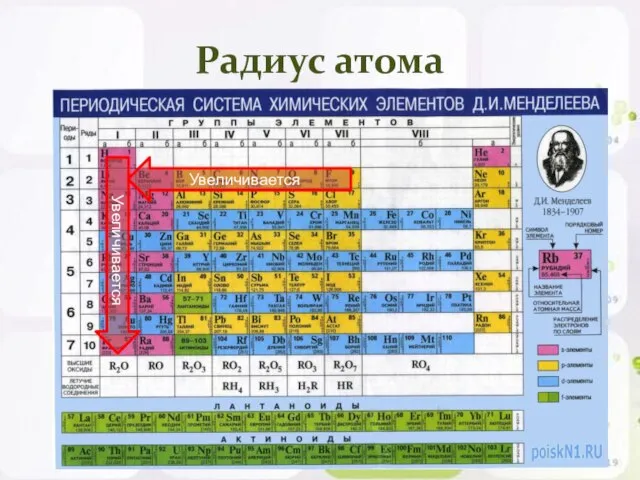
- 10. Радиус атома Увеличивается Увеличивается
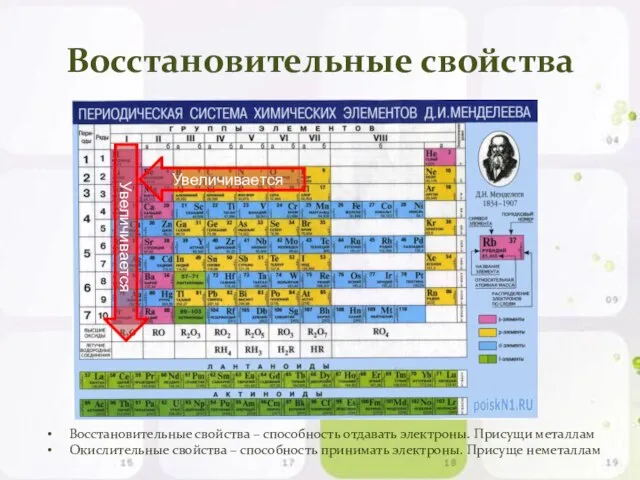
- 11. Восстановительные свойства Восстановительные свойства – способность отдавать электроны. Присущи металлам Окислительные свойства – способность принимать электроны.
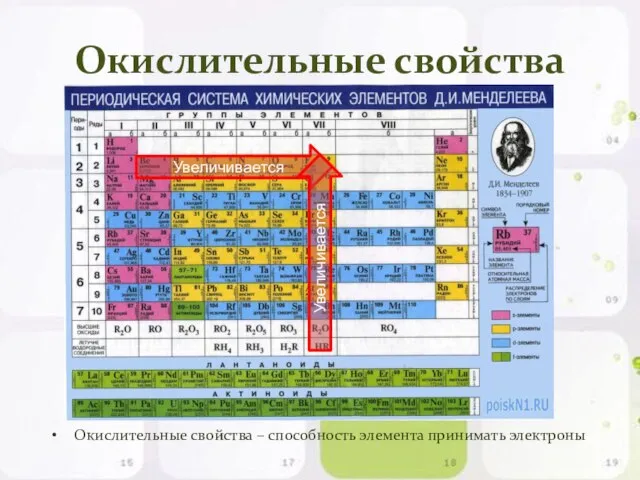
- 12. Окислительные свойства Окислительные свойства – способность элемента принимать электроны Увеличивается Увеличивается
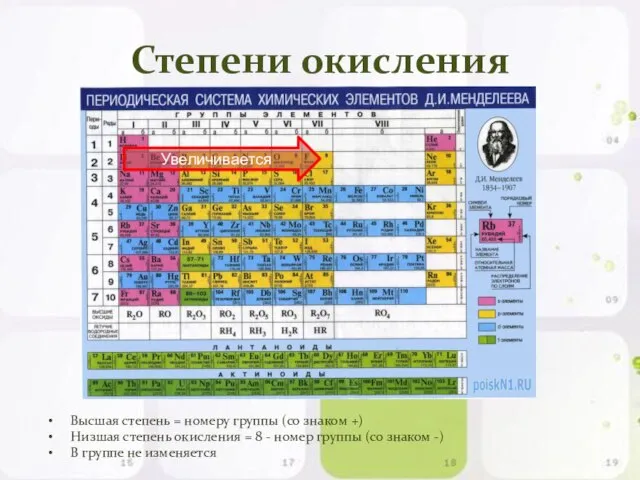
- 13. Степени окисления Высшая степень = номеру группы (со знаком +) Низшая степень окисления = 8 -
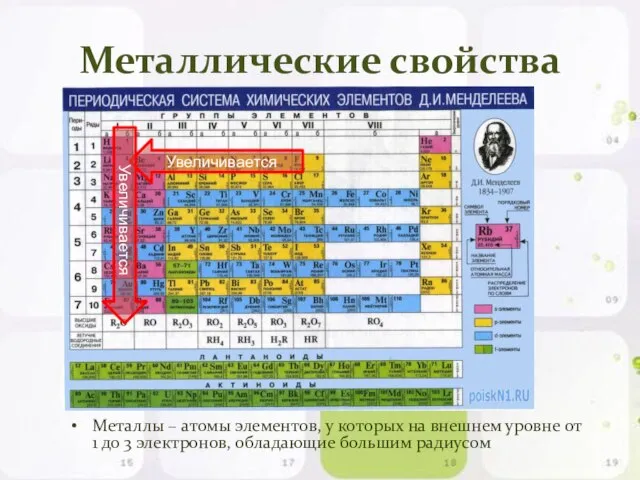
- 14. Металлические свойства Металлы – атомы элементов, у которых на внешнем уровне от 1 до 3 электронов,
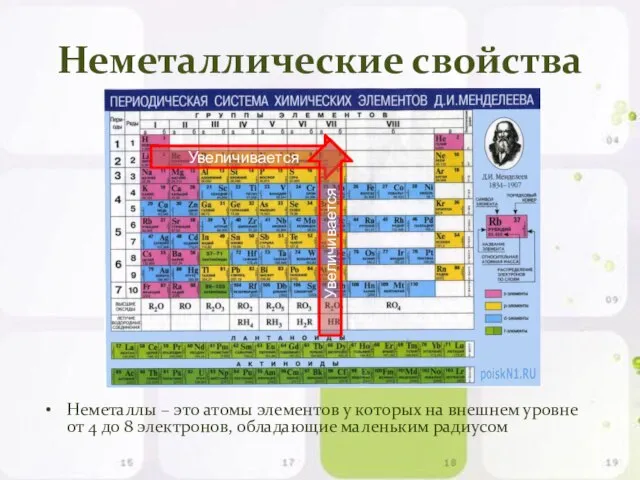
- 15. Неметаллические свойства Неметаллы – это атомы элементов у которых на внешнем уровне от 4 до 8
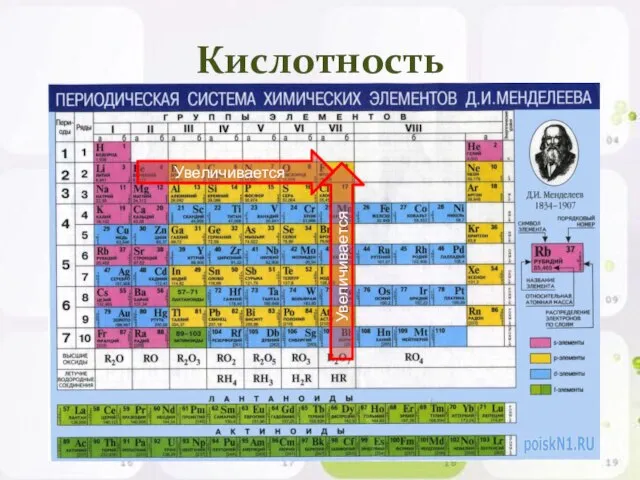
- 16. Кислотность Увеличивается Увеличивается
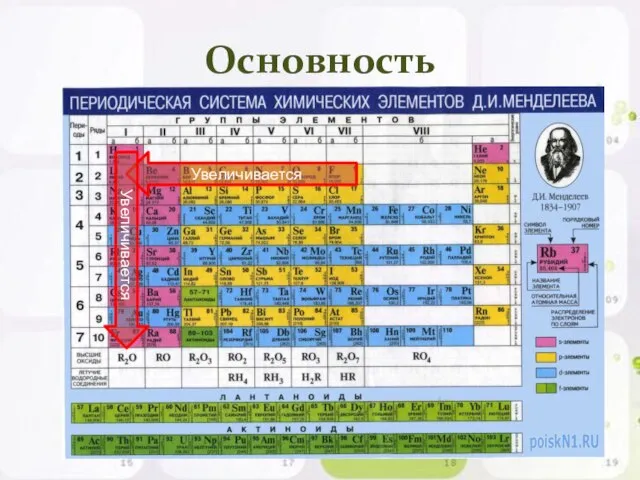
- 17. Основность Увеличивается Увеличивается
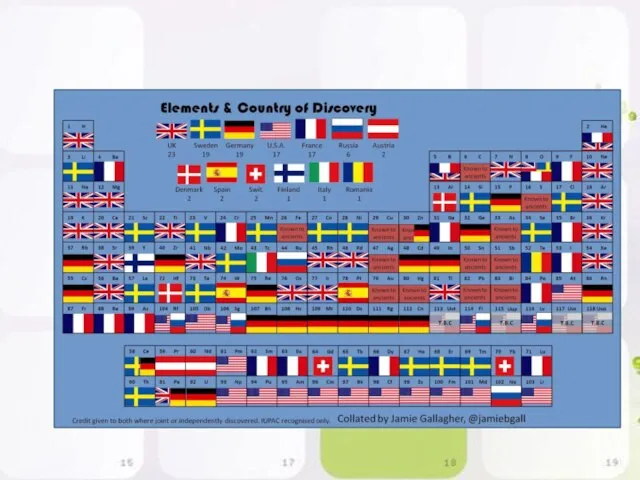
- 18. Виды таблиц
- 23. Скачать презентацию









 Синильная Кислота - циановодород
Синильная Кислота - циановодород Глюкоза – это спирт, альдегид или альдегидоспирт?
Глюкоза – это спирт, альдегид или альдегидоспирт? Хімічні явища в побуті
Хімічні явища в побуті Валентность химических элементов. 1.Валентность водорода равна единице
Валентность химических элементов. 1.Валентность водорода равна единице Биохимия как наука
Биохимия как наука Кадмий
Кадмий Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Аминокилоты. Свойства
Аминокилоты. Свойства Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Водород
Водород Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Свинец. Полезный металл, яд и глобальный загрязнитель
Свинец. Полезный металл, яд и глобальный загрязнитель Предельные углеводороды
Предельные углеводороды Липидтер. Сабынданатын және сабынданбайтын липидтер
Липидтер. Сабынданатын және сабынданбайтын липидтер КАЛЬЦІЙ (Са) Виконала учениця 10-В класу Рахімова Алла
КАЛЬЦІЙ (Са) Виконала учениця 10-В класу Рахімова Алла  Альдегиды и кетоны
Альдегиды и кетоны Презентация по Химии "Уран" - скачать смотреть
Презентация по Химии "Уран" - скачать смотреть  Термодинамічні умови формування природного водню
Термодинамічні умови формування природного водню Многоатомные спирты
Многоатомные спирты Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Алканы. Циклоалканы
Алканы. Циклоалканы Урок-игра. История развития химии
Урок-игра. История развития химии Углеводы. Глюкоза. Простые эфиры. Димедрол
Углеводы. Глюкоза. Простые эфиры. Димедрол Обмен витаминов
Обмен витаминов План выполнения домашней работы по теме «Алкадиены»
План выполнения домашней работы по теме «Алкадиены» Щелочноземельные металлы
Щелочноземельные металлы Витамин A
Витамин A