Содержание
- 2. Проверим домашнее задание 2 1 2 3 1 2 3 ? 1 3 Н2SO4
- 3. Вопросы № 1 (теоретические) Назвать физические свойства серной кислоты Назвать химические свойства серной кислоты Перечислите отрасли
- 4. Вопросы № 2 (практические) Написать уравнения реакций простейшего способа получения серной кислоты Написать уравнение химической реакции,
- 5. Вопросы № 3 (разные) Что произойдёт, если смешать серную кислоту с гидроксидом серы? Как правильно смешать
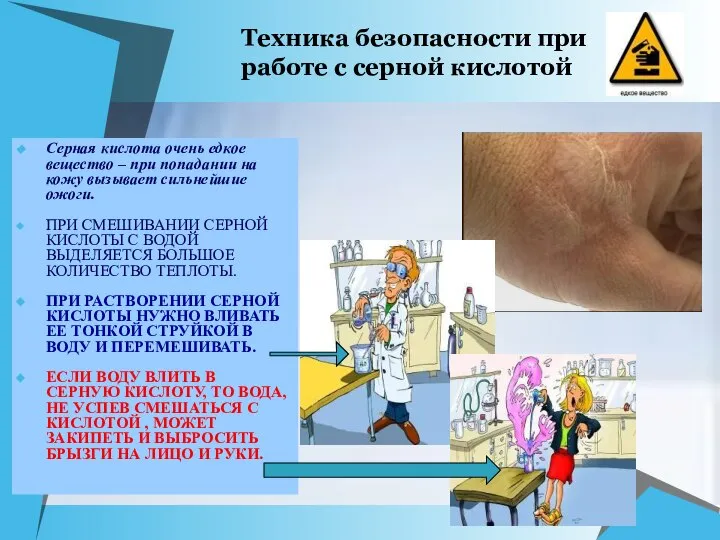
- 6. Техника безопасности при работе с серной кислотой Серная кислота очень едкое вещество – при попадании на
- 7. Оцени работу свою и товарища
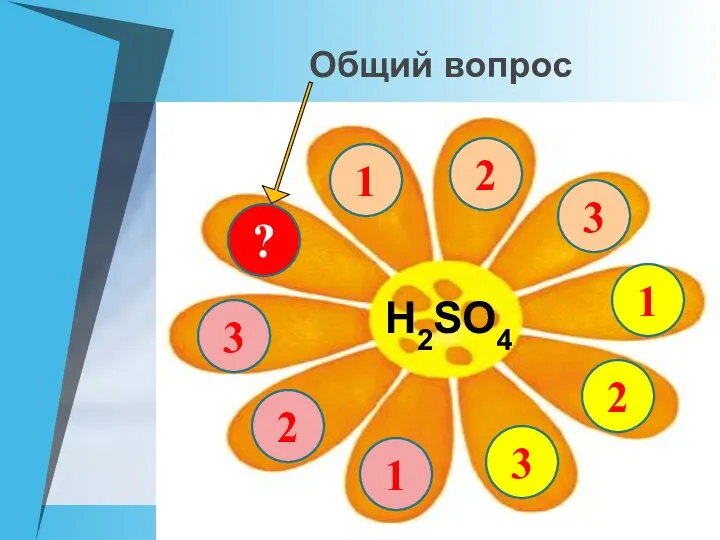
- 8. Общий вопрос 2 1 2 3 1 2 3 ? 1 3 Н2SO4
- 9. Тема урока?
- 10. Бинарные соединения серы
- 11. Цель урока - познакомиться с бинарными соединениями серы
- 12. Задачи урока: Выяснить о бинарных соединениях серы (H2S, SO2, SO3): Название Строение Получение Физические свойства Химические
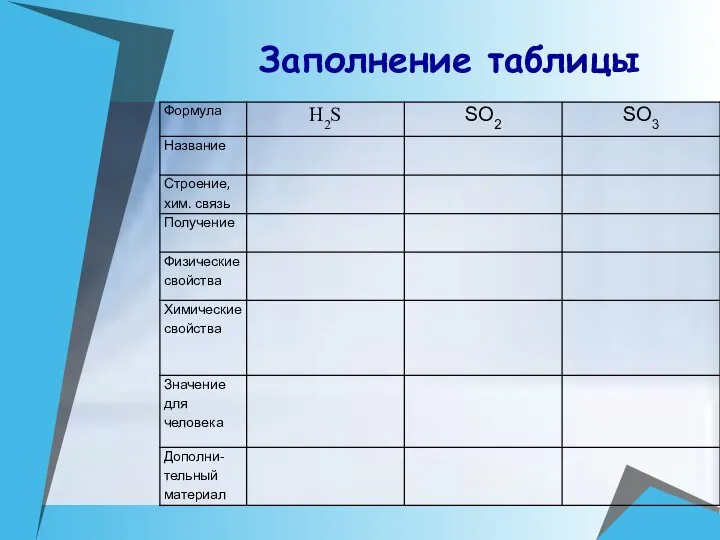
- 13. Заполнение таблицы
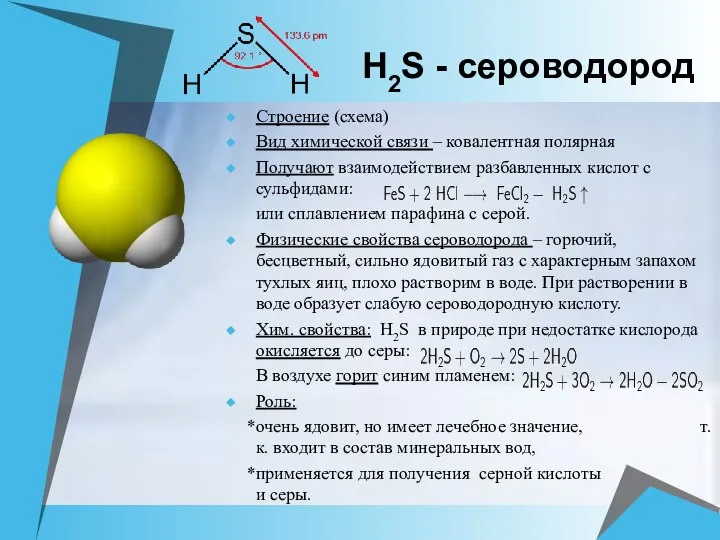
- 14. H2S - сероводород Строение (схема) Вид химической связи – ковалентная полярная Получают взаимодействием разбавленных кислот с
- 15. H2S - сероводород Образуется: в результате вулканической деятельности; при гниении белков животных и растений; при работе
- 16. SО2 - сернистый газ Строение (схема) Вид химической связи – ковалентная полярная Получают в лаборатории воздействием
- 17. SО2 - сернистый газ При растворении в воде образуется слабая сернистая кислота, которая является основой кислотных
- 18. SО3 – серный ангидрид Строение (схема) Вид химической связи – ковалентная полярная Получают термическим разложением сульфатов
- 19. SО3 – серный ангидрид
- 20. Объясни причину: Во многих лесах по всему миру можно найти целые области высохших как хворост стволов
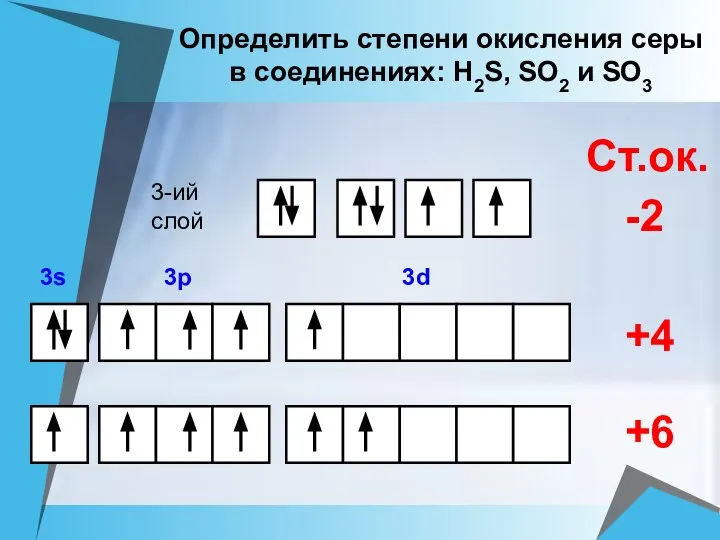
- 21. +4 +6 Ст.ок. -2 3-ий слой Определить степени окисления серы в соединениях: Н2S, SO2 и SO3
- 22. Отгадай загадки: Когда пирит в печи горит, То в горле от меня першит. А мой гидрат
- 23. Задачи урока: Выяснить о бинарных соединениях серы (H2S, SO2, SO3): название строение получение физические свойства химические
- 24. Оцени работу свою и товарища
- 25. Химическая сказка Как-то раз в семье газов появилась бесцветная дымящая жидкость SO3. Девочка росла и ничего
- 26. Домашнее задание?
- 27. Домашнее задание: Пересказ стр. 100-101, повторить записи Сообщения о бинарных соединениях серы Творческое задание на тему
- 29. Скачать презентацию





















 Производство геля для душа и его состав
Производство геля для душа и его состав Основные понятия и законы химии
Основные понятия и законы химии Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Методические рекомендации к уроку по теме Скорость химических реакций в 11классе
Методические рекомендации к уроку по теме Скорость химических реакций в 11классе Железо и его соединения
Железо и его соединения Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика
Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика Стани води
Стани води Функціональні матеріали в аналітичній хімії. Лекція 1
Функціональні матеріали в аналітичній хімії. Лекція 1 Презентация по Химии "Кислородсодержащие органические вещества. Фенолы" - скачать смотреть
Презентация по Химии "Кислородсодержащие органические вещества. Фенолы" - скачать смотреть  Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения Витамины и коферменты
Витамины и коферменты Диаграмма состояния железо–углерод
Диаграмма состояния железо–углерод Перспективы использования оксигенатов в моторных топливах
Перспективы использования оксигенатов в моторных топливах Многоатомные спирты
Многоатомные спирты Предельные спирты и фенолы
Предельные спирты и фенолы Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки
Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева (урок 1 - 2)
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева (урок 1 - 2) Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері
Пестицидтердің қоршаған ортаға зиян-ын тигізбеу жүйесі. Пестицидтерді қолданудың физикалық-химиялық негіздері Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Строение и свойства углеводов и липидов
Строение и свойства углеводов и липидов КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ УГЛЕВОДЫ И ЛИПИДЫ. ИХ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ КЛЕТКИ Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Беша
УГЛЕВОДЫ И ЛИПИДЫ. ИХ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ КЛЕТКИ Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Беша Дәнді-дақылдар тыңайтқыштары
Дәнді-дақылдар тыңайтқыштары Тепловой эффект сгорания топлива
Тепловой эффект сгорания топлива Предмет и метод термодинамики. Химическая термодинамика
Предмет и метод термодинамики. Химическая термодинамика Лягушачье золото
Лягушачье золото Оценка солености воды реки Цны и питьевой бутилированной воды
Оценка солености воды реки Цны и питьевой бутилированной воды