Содержание
- 2. Цель дисциплины «Общая и неорганическая химия» – формирование у студентов основных представлений о взаимосвязи между природой
- 3. ЛЕКЦИЯ ЭНЕРГЕТИКА И НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ. Раздел химии, изучающий энергетику и направление химических реакций, называется термодинамикой.
- 5. ВАЖНЕЙШЕЙ ТЕРМОДИНАМИЧЕСКОЙ ФУНКЦИЕЙ СИСТЕМЫ ЯВЛЯЕТСЯ ВНУТРЕННЯЯ ЭНЕРГИЯ (U). ПОД ВНУТРЕННЕЙ ЭНЕРГИЕЙ ПОНИМАЮТ ВСЕ ВИДЫ ЭНЕРГИЙ ТЕПЛОВОГО
- 6. В любом процессе соблюдается закон сохранения энергии -1 начало термодинамики. Это обобщенный результат работы великих ученых:
- 7. Первое начало термодинамики: Q = ∆ U + A Теплота Q, подведенная к системе, расходуется на
- 8. 1. В любой изолированной системе запас энергии остается постоянным. 2. Разные формы энергии переходят друг в
- 9. Химические процессы, как правило, протекают при постоянном давлении (p – сonst изобарный процесс), либо при постоянном
- 10. Сумму U + pV = H называют энтальпией (в переводе с греческого языка - нагреваться). Энтальпия
- 11. Для изохорного процесса, изменения объёма не происходит, работа расширения равна нулю, поэтому: Qv = U2 -
- 12. Тепловые эффекты реакций определяют как экспериментально (калориметрическим методом), так и с помощью термохимических расчетов. В основе
- 13. Из закона Гесса вытекает ряд следствий ПЕРВОЕ СЛЕДСТВИЕ: Тепловой эффект реакции равен сумме теплот образования (∆Н0обр.
- 14. ВТОРОЕ СЛЕДСТВИЕ: Тепловой эффект реакции равен сумме теплот сгорания исходных веществ (∆Нсгор.) за вычетом суммы теплот
- 15. Под стандартной теплотой образования Н0обр 298 понимают тепловой эффект образования 1 моль вещества из простых веществ
- 16. Химические реакции, протекающие с выделением теплоты называются экзотермическими. При этом энтальпия уменьшается, значение ∆H отрицательно (∆H
- 17. Запись химической реакции с указанием теплового эффекта называется ТЕРМОХИМИЧЕСКИМ УРАВНЕНИЕМ: ½ Н2 (г) + ½ Cl2
- 18. Для решения вопросов о направлении химической реакции используют второе начало термодинамики. Основоположником считается французский физик Карно
- 19. Формулировка химика Клаузиса 1850 г. Теплота не может самопроизвольно переходить от более холодного тела к более
- 20. Вывод: Протекание самопроизвольных процессов в изолированной системе сопровождается рассеиванием тепловой энергии. Для характеристики рассеянной энергии в
- 21. Необходимо учитывать факторы, способствующие самопроизвольному течению реакции, так как частицам присуще стремление к беспорядочному хаотичному движению,
- 22. Физический смысл энтропии был дан членом Венской АН Людвигом Больцманом, который в 1872г. представил в виде
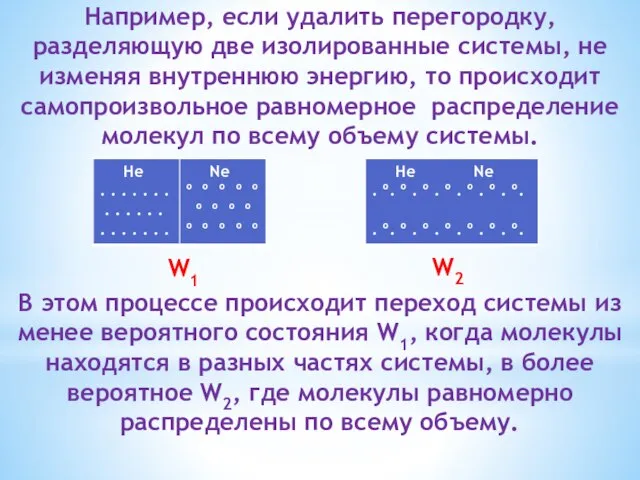
- 23. Например, если удалить перегородку, разделяющую две изолированные системы, не изменяя внутреннюю энергию, то происходит самопроизвольное равномерное
- 24. S = S2 – S1 = K·ln W2 / W1 W2 > W1 → ∆S >
- 25. Критерием самопроизвольного протекания процесса является энергия Гиббса. Направление химических реакций определяется одновременным действием двух факторов: тенденцией
- 26. По изменению энергии Гиббса можно судить о возможности протекания процесса. Если: ∆G > 0, то самопроизвольного
- 27. При расчетах используется стандартный изобарно–изотермический потенциал ∆G0обр.298 , т.е. изменение энергии Гиббса при образовании 1 моль
- 28. Для экзотермических процессов ∆H раств. ∆H гидр. > ∆H кр.р. наблюдается при растворении газов (∆H кр.р.
- 29. Теплоты растворения: 1) интегральная (изменение энтальпии при растворении 1 моль в-ва в n моль р-ля). HCl
- 30. Возможность самопроизвольного растворения определяют, рассчитав энергию Гиббса: ∆G0раств. = ∆H раств. - T∆S раств. ∆G д.б.
- 31. ПРИМЕРЫ тестовых заданий: Изолированной системой называют такую систему, которая: 1) не обменивается с окружающей средой ни
- 32. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле? 1) закрытой 2) открытой 3)
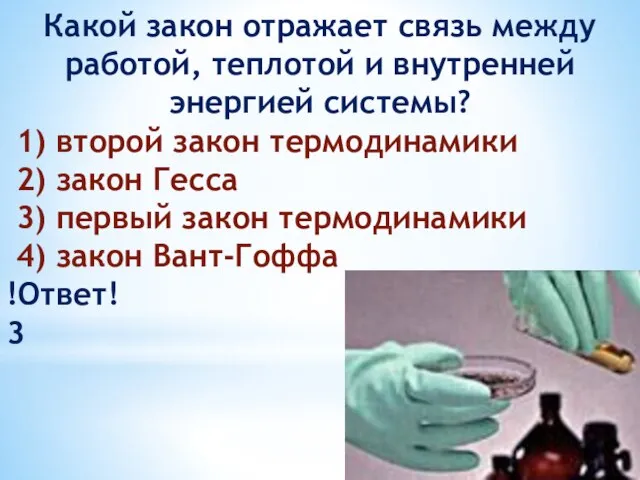
- 33. Какой закон отражает связь между работой, теплотой и внутренней энергией системы? 1) второй закон термодинамики 2)
- 34. Какие процессы называют экзотермическими? 1) для которых ΔН отрицательно 2) для которых ΔG отрицательно 3) для
- 35. Рассчитайте изменение энергии Гиббса энтальпии и энтропии для стандартного состояния реакции горения метанола: СН4(г)+2О2(г) → СО2(г)+2Н2О(г).
- 36. Выделением или поглощением тепла сопровождается реакция каталитического окисления этанола в присутствии каталазы: С2Н5ОН(ж)+Н2О2(ж)→ СН3СОН(г)+Н2О(ж)? 1) ΔН0
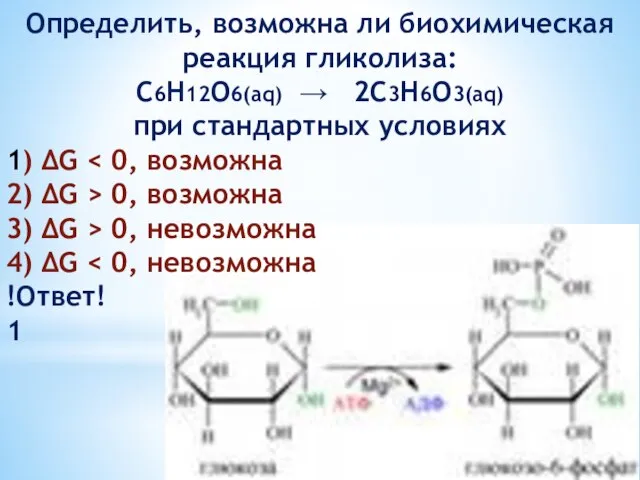
- 37. Определить, возможна ли биохимическая реакция гликолиза: С6Н12О6(aq) → 2C3H6O3(aq) при стандартных условиях 1) ΔG 2) ΔG
- 38. Вычислите тепловой эффект реакции при стандартных условиях, используя стандартные теплоты сгорания веществ: С6Н12О6 (к) → 2С2Н5ОН
- 40. Скачать презентацию


































 Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь Наномедицина и биотехнология. Фантастика становится реальностью
Наномедицина и биотехнология. Фантастика становится реальностью Предельные углеводороды. Метан как представитель предельных углеводородов
Предельные углеводороды. Метан как представитель предельных углеводородов Спирты. Лекция
Спирты. Лекция Презентация по Химии "Великие русские учёные-химики" - скачать смотреть
Презентация по Химии "Великие русские учёные-химики" - скачать смотреть  Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ Робота учениці 10-Б Єлісєєвої Марії
КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ Робота учениці 10-Б Єлісєєвої Марії  Гидроксид натрия
Гидроксид натрия Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Органические и неорганические вещества. Нуклеиновые кислоты
Органические и неорганические вещества. Нуклеиновые кислоты Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов
Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов Углеводы. Глюкоза-представитель моносахаридов
Углеводы. Глюкоза-представитель моносахаридов  Опыты по химии
Опыты по химии Полупроводниковые твердые растворы
Полупроводниковые твердые растворы Технология производства химических волокон. Свойства химических волокон. 7 класс
Технология производства химических волокон. Свойства химических волокон. 7 класс Бытовая химия в квартире
Бытовая химия в квартире Виробництво біогазу
Виробництво біогазу Кислоты. (8 класс.)
Кислоты. (8 класс.) Селективное каталитическое восстановление оксидов азота
Селективное каталитическое восстановление оксидов азота Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т
Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т Практикум по неорганической химии
Практикум по неорганической химии Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД)
Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД) Успехи естественных наук XIX века
Успехи естественных наук XIX века Активна реакція водних розчинів
Активна реакція водних розчинів Обратимость химических реакций. Химическое равновесие, условия его смещения
Обратимость химических реакций. Химическое равновесие, условия его смещения Аккредитованная образовательная программа бакалавриата Химия
Аккредитованная образовательная программа бакалавриата Химия CaSO4:Tb3+ кристалында радиациялық ақаулардың пайда болуының нәтижелерін теориялық мәләметтерге сәйкестігін зерттеу
CaSO4:Tb3+ кристалында радиациялық ақаулардың пайда болуының нәтижелерін теориялық мәләметтерге сәйкестігін зерттеу