Содержание
- 2. Цель урока: Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики.
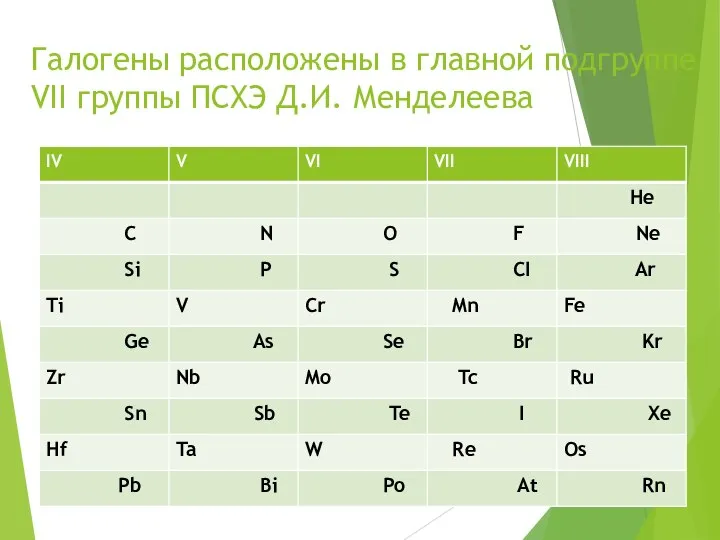
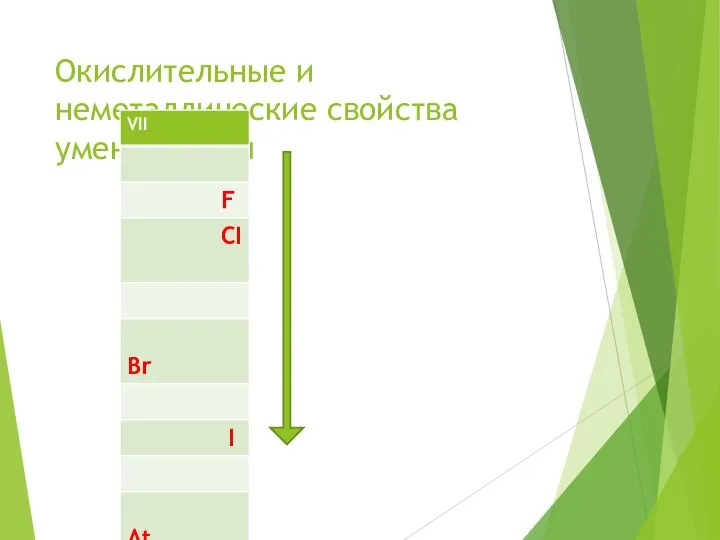
- 4. Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева
- 5. Галогены «рождающие соли» F CI Br I At
- 6. Распространенность галогенов в природе
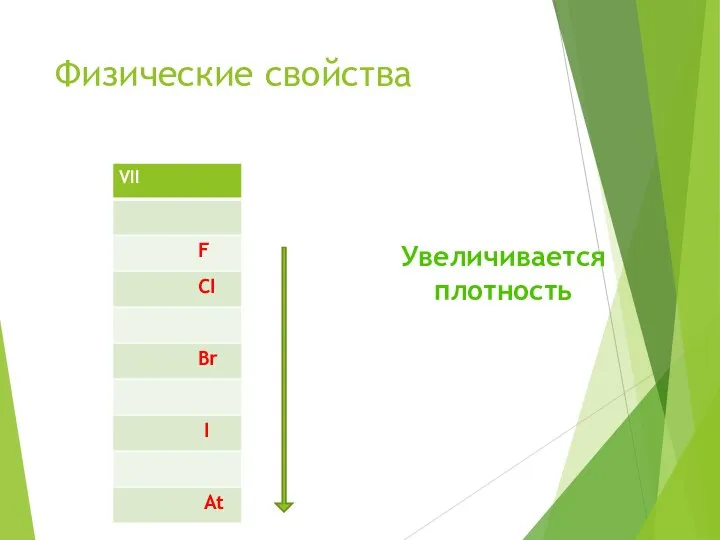
- 7. Физические свойства Увеличивается плотность
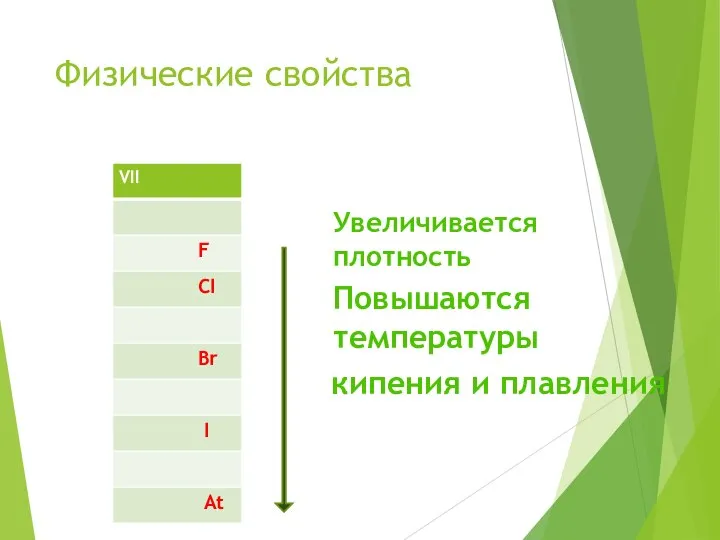
- 8. Физические свойства Увеличивается плотность Повышаются температуры кипения и плавления
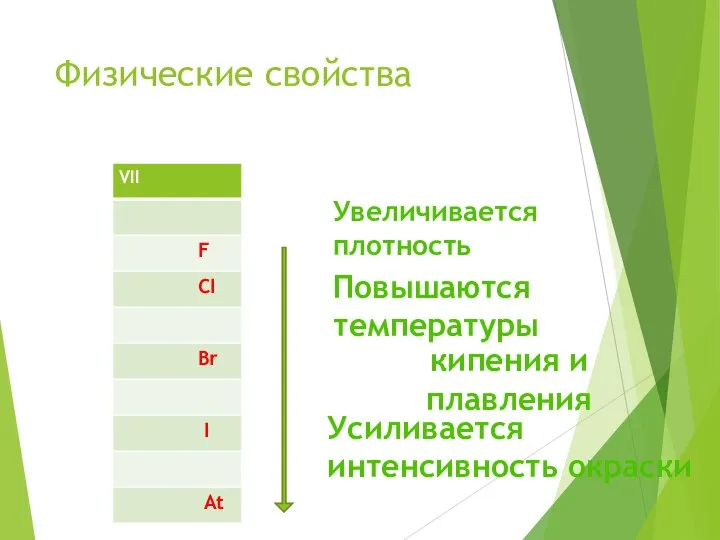
- 9. Физические свойства Увеличивается плотность Повышаются температуры кипения и плавления Усиливается интенсивность окраски
- 10. Фтор F2 Ядовитый газ светло- зелёного цвета
- 11. Хлор CI2 - Ядовитый газ жёлто-зеленого цвета
- 12. Бром Br2 Токсичная тяжёлая жидкость красно- бурого цвета
- 13. йод I2 – Твёрдое кристаллическое вещество с металлическим блеском При нагревании образует пары фиолетового цвета
- 14. Ответьте на вопросы. Число электронов на внешнем энергетическом уровне атома; Изменение радиуса атомов и окислительно-восстановительных свойств
- 15. Проверка: На внешнем энергетическом уровне галогены содержат 7 электронов. В главной подгруппе с увеличением зарядов ядер,
- 16. Химические свойства F) ) 2 7 Г°+1е = Г¯ - Галогены- окислители
- 17. Окислительные и неметаллические свойства уменьшаются
- 18. Более активный галоген вытесняет менее активный из его соединений с металлами и водородом 2KI + Br2
- 19. Летучие водородные соединения HF HCI HBr HI Сила кислот увеличивается
- 20. Л. О. №2 Вытеснение одних галогенов другими из их соединений Оформите результаты работы в виде таблицы
- 21. Л. О. №3 Растворимость йода в органических растворителях Оформите результаты работы в виде таблицы Запишите уравнения
- 22. Вопросы и задания Перечислите галогены. Где в ПСХЭ располагаются галогены? Чему равно число валентных электронов в
- 23. Вопросы и задания Сопоставьте : Хлор красно – бурая жидкость Бром светло – зеленый газ Йод
- 24. Вопросы и задания Дополните: Самый сильный неметалл – Самая сильная бескислородная кислота – Как изменяются окислительные
- 26. Скачать презентацию


















 Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения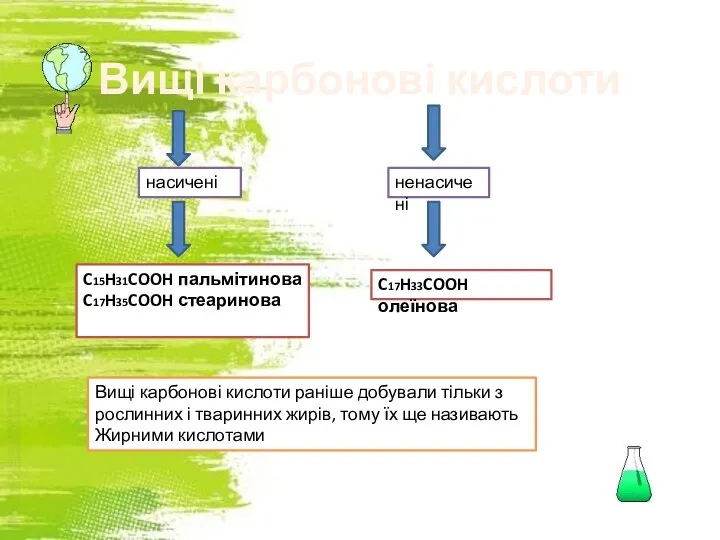 Вищі карбонові кислоти C17H33COOH олеїнова
Вищі карбонові кислоти C17H33COOH олеїнова  Нефть в США. История. Запасы и прогноз
Нефть в США. История. Запасы и прогноз Корреляция структуры ксенобиотика и его токсичности. Топологические индексы
Корреляция структуры ксенобиотика и его токсичности. Топологические индексы Презентація на тему: “Охорона навколишнього середовища під час виробництва і застосування металів”. Виконала учениця 10 класу Каленчук Марія.
Презентація на тему: “Охорона навколишнього середовища під час виробництва і застосування металів”. Виконала учениця 10 класу Каленчук Марія.  Урок химии в 9-ом классе Тема урока "Сера"
Урок химии в 9-ом классе Тема урока "Сера" Сложные эфиры R-COOR'
Сложные эфиры R-COOR' Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф
Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф Дисперсные системы
Дисперсные системы Лекарственное растительное сырье, содержащее витамины
Лекарственное растительное сырье, содержащее витамины Формирование химического состава, структуры и свойств поверхностных слоев систем Ме-С при ионно-лучевых воздействиях
Формирование химического состава, структуры и свойств поверхностных слоев систем Ме-С при ионно-лучевых воздействиях Введение в биохимию
Введение в биохимию Гетероциклы. Шестичленные гетероциклы с одним гетероатомом
Гетероциклы. Шестичленные гетероциклы с одним гетероатомом Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов.  Коррозия металлов. Ржа ест железо
Коррозия металлов. Ржа ест железо Классификация неорганических веществ
Классификация неорганических веществ Занимательная химия. Дидактические игры
Занимательная химия. Дидактические игры Степень окисления
Степень окисления Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Методология, принципы и методы изучения МПИ
Методология, принципы и методы изучения МПИ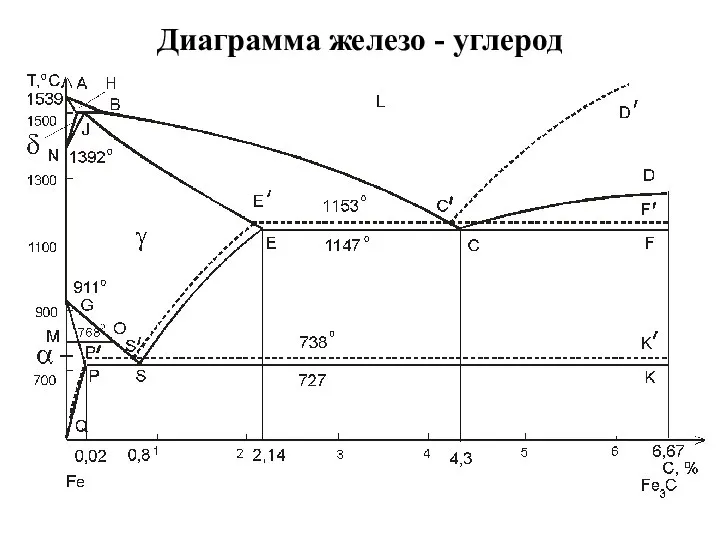 Диаграмма железо - углерод
Диаграмма железо - углерод Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров
Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров Исследовательская (проектная) работа Вулкан в домашних условиях
Исследовательская (проектная) работа Вулкан в домашних условиях Почему вода в море солёная
Почему вода в море солёная Координационные комплексные соединения
Координационные комплексные соединения Синтетические органические соединения
Синтетические органические соединения Нептуний
Нептуний