Содержание
- 2. Результат: прямые потери массы металла; косвенные потери - утрата важнейших свойств. Коррозия – рыжая крыса, Грызёт
- 3. Коррозия - самопроизвольное разрушение поверхности металлов (сплавов) под влиянием химического и электрохимического воздействия окружающей среды. окислительно-восстановительный
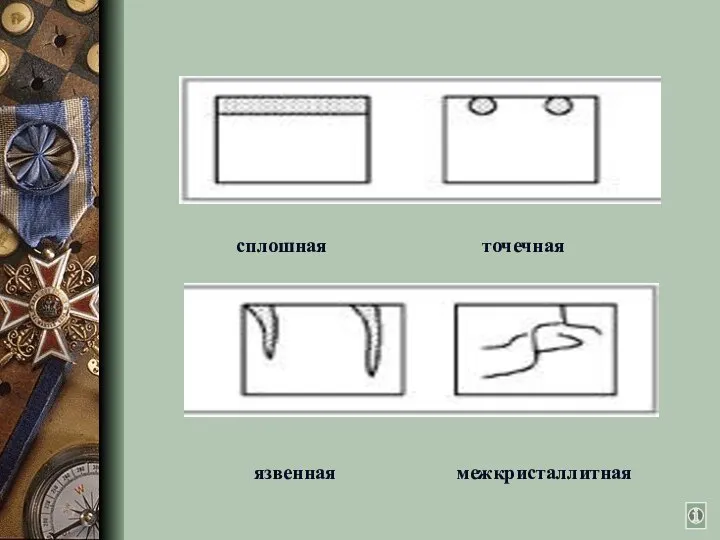
- 4. По характеру разрушения сплошная (общая): равномерная, неравномерная локальная(местная): точечная, пятнами, язвами, подповерхностная, сквозная и др. Виды
- 5. язвенная межкристаллитная сплошная точечная
- 6. Причины коррозии - химические и электрохимические процессы окисления, происходящие на поверхности металлических тел при их взаимодействии
- 7. Химическая коррозия - металл разрушается в результате его химического взаимодействия с агрессивной средой (сухими газами, жидкостями-неэлектролитами).
- 8. Коррозия металла на влажном воздухе Образующиеся на аноде ионы Fe2+ окисляются до Fe3+ : 4Fe2+ (водн.)
- 9. Электрохимическая коррозия - в среде электролита возникает электрический ток при контакте двух металлов (или на поверхности
- 10. Защита от коррозии Изоляция металла от среды Изменение состава металла (сплава) Изменение среды
- 11. Барьерная защита - механическая изоляция поверхности при использовании поверхностных защитных покрытий : неметаллических (лаки, краски, смазки,
- 12. Изменение состава металла (сплава) Протекторная защита - добавление в материал покрытия порошковых металлов, создающих с металлом
- 13. Изменение состава металла (сплава) Введение в металл легирующих добавок: Cr, Ni, Ti, Mn, Mo, V, W
- 14. Пассивация поверхности Введение веществ, замедляющих коррозию (ингибиторов): для кислотной коррозии: азотсодержащие органические основания, альдегиды, белки, серосодержащие
- 15. Пассивация поверхности Удаление веществ, вызывающих коррозию – деаэрация: нагревание воды; пропускание воды через железные стружки; химическое
- 16. Домашнее задание: Составить конспект в тетради.
- 18. Скачать презентацию














 Альдегиды
Альдегиды Химия в быту
Химия в быту Презентация по химии Строение атома
Презентация по химии Строение атома  Основные понятия и законы химии
Основные понятия и законы химии Спирты. Классификация спиртов
Спирты. Классификация спиртов Диеновые углеводороды (алкадиены или диолефины)
Диеновые углеводороды (алкадиены или диолефины)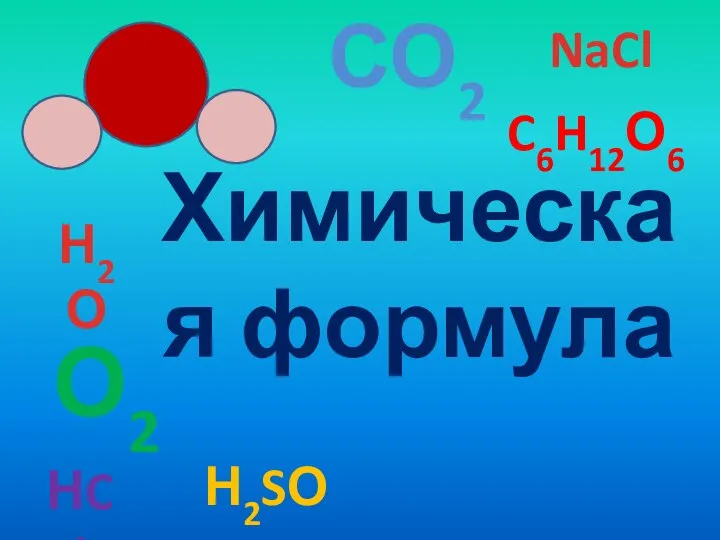 Химическая формула
Химическая формула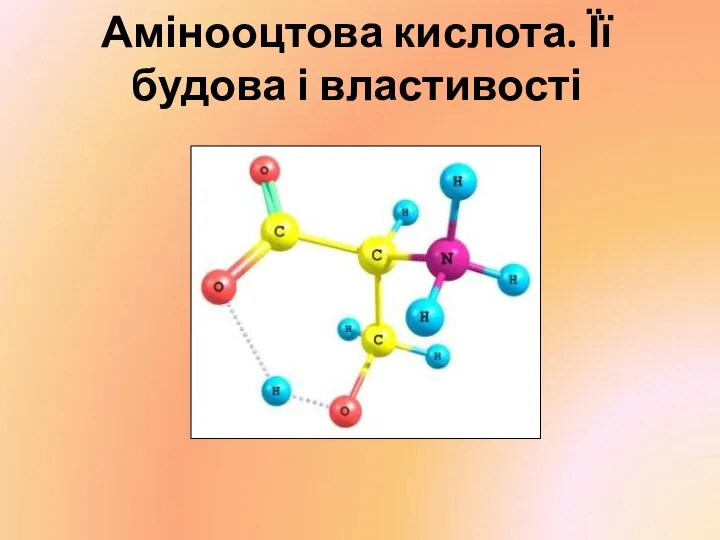 Амінооцтова кислота. Її будова і властивості
Амінооцтова кислота. Її будова і властивості Обмоточные провода
Обмоточные провода Витамины гетероциклического строения. (Тема 2)
Витамины гетероциклического строения. (Тема 2) Хімія для розвитку біо- та нанотехнологій
Хімія для розвитку біо- та нанотехнологій Электродные процессы, их биологическая роль и применение в медицине
Электродные процессы, их биологическая роль и применение в медицине ГИА. Вопрос А2. ПЗ и ПСХЭ
ГИА. Вопрос А2. ПЗ и ПСХЭ Кристаллизация. Кристаллическая и аморфная фазы в полиэтилене
Кристаллизация. Кристаллическая и аморфная фазы в полиэтилене Растворы. Способы выражения состава раствора
Растворы. Способы выражения состава раствора Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Кристаллизация металла шва
Кристаллизация металла шва Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Возраст в геологии
Возраст в геологии Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Лекция № 20 Тема: Окислительно-восстановительные равновесия в аналитической химии
Лекция № 20 Тема: Окислительно-восстановительные равновесия в аналитической химии Лекция 4. Методы количественного химического анализа
Лекция 4. Методы количественного химического анализа Предмет и метод термодинамики. Химическая термодинамика
Предмет и метод термодинамики. Химическая термодинамика Химическая игра Своя игра
Химическая игра Своя игра Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Кремний и его соединения. Кристаллическая решётка кремния
Кремний и его соединения. Кристаллическая решётка кремния Кремний и его родственники
Кремний и его родственники Гидроксиды металлов
Гидроксиды металлов