Содержание
- 2. Задачей количественного анализа является определение количественного содержания элементов, ионов или химических соединений, входящих в состав исследуемых
- 4. Гравиметрический анализ Гравиметрический анализ основан на законе сохранения массы и постоянства состава вещества и заключается в
- 7. Метод отгонки Определяемый компонент выделяют из анализируемой пробы в виде газообразного соединения и измеряют либо массу
- 8. Косвенные методы отгонки широко применяются для определения кристаллизационной воды в солях, воды в почве и лекарственном
- 10. Метод осаждения основан на количественном осаждении искомого иона в виде малорастворимого соединения определенного химического состава, которое
- 11. Основные понятия метода осаждения Осаждаемая форма – это химический состав осадка, в виде которого осаждают определяемый
- 12. Гравиметрическая форма – химический состав высушенного (прокаленного) и взвешенного осадка. Требования к гравиметрической форме: 1. иметь
- 13. Осадитель – это реагент, с помощью которого определяемый компонент переводят в малорастворимое соединение. Осадитель должен: 1.
- 14. Неорганические осадители Неорганические осадители (NH3∙H2O, H2S, H2SO4, HCl, BaCl2) образуют с определяемыми ионами малорастворимые соли или
- 15. Органические осадители Органические осадители образуют с определяемыми ионами малорастворимые соли или комплексные соединения. Например, оксалат аммония
- 18. Погрешности гравиметрического анализа Гравиметрический анализ относится к методам, дающим наиболее правильные результаты. Высокая правильность гравиметрии обусловлена
- 19. Безэталонный(результат получают непосредственно из измерений). Универсальный (можно определить большинство неорганических катионов и анионов, нейтральных молекул (H2O,
- 20. Относительно низкая чувствительность (> 1%). Длительность анализа. Невысокая селективность.
- 21. Расчеты в гравиметрическом анализе Для расчета массы навески анализируемого вещества необходимо знать примерное содержание определяемого компонента
- 22. Масса навески пробы для проведения единичного определения равна: где g – масса навески, г; m –
- 23. Гравиметрический фактор (F) – отношение молярных масс определяемого компонента и его гравиметрической формы, умноженных на соответствующие
- 24. Если анализируемое вещество – жидкость, то расчет необходимого объема его (мл) проводят по формуле: где ρ
- 25. Количество осадителя (объем или масса) определяется растворимостью осаждаемой формы и летучестью осадителя. Если осадитель летучее соединение,
- 26. Концентрацию примесей Cn, остающихся в осадке после n – го промывания рассчитывают по формуле: где C0
- 27. Число промываний (n) равно: Затраченный объем (Vn) промывной жидкости равен:
- 28. Масса определяемого компонента (mопр) в анализируемом образце: Массовая доля (P) определяемого компонента в анализируемом образце:
- 29. Примеры Пример 1. Рассчитайте массу навески пробы, содержащей около 65% Ca(OH)2, необходимую для гравиметрического определения Ca2+
- 31. Скачать презентацию




























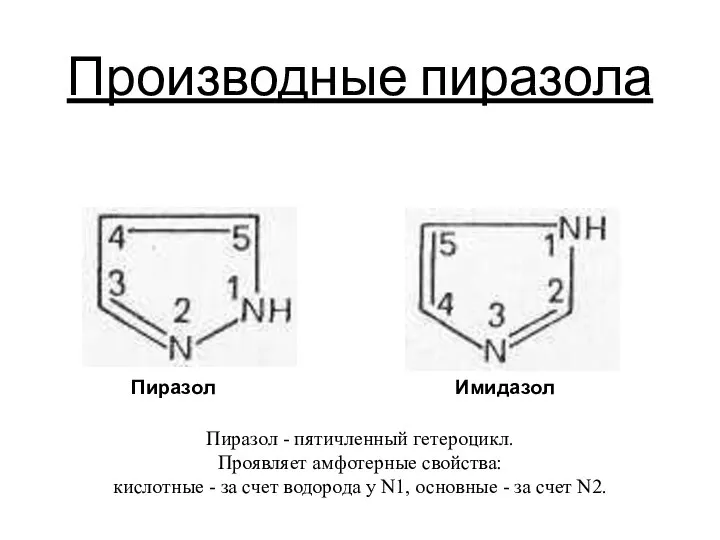 Производные пиразола
Производные пиразола Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Ліпіди
Ліпіди Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия
Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Союз химии и медицины
Союз химии и медицины Химический элемент гелий
Химический элемент гелий Викторина «Что это?»
Викторина «Что это?» Принцип Паули. Периодическая система элементов Д.И. Менделеева
Принцип Паули. Периодическая система элементов Д.И. Менделеева Химические элементы
Химические элементы Альдегиды и кетоны
Альдегиды и кетоны Ароматические углеводороды (арены)
Ароматические углеводороды (арены) № 12.
№ 12.  Люминесценция
Люминесценция Экстракция
Экстракция Углеводы. Моносахариды
Углеводы. Моносахариды Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Colloid chemistry
Colloid chemistry Презентация подготовлена учителем химии ош № 33 г. Симферополя Филиной Лесей Игоревной. Каменный уголь.
Презентация подготовлена учителем химии ош № 33 г. Симферополя Филиной Лесей Игоревной. Каменный уголь.  Кристаллические решетки
Кристаллические решетки «Кремний и его соединения» Автор: учитель химии и биологии МБОУ Летуновской СОШ Короткова Фаина Алексеевна
«Кремний и его соединения» Автор: учитель химии и биологии МБОУ Летуновской СОШ Короткова Фаина Алексеевна Азот в природе
Азот в природе Электрохимические методы анализа
Электрохимические методы анализа Введение в кристаллографию
Введение в кристаллографию Магматические и метаморфические горные породы. (Лекция 7)
Магматические и метаморфические горные породы. (Лекция 7) Предмет органической Химии. Классификация Органических соединений
Предмет органической Химии. Классификация Органических соединений Химическая кинетика
Химическая кинетика Решение задач на долю вещества в растворе с участием кристаллогидратов
Решение задач на долю вещества в растворе с участием кристаллогидратов