Содержание
- 2. 1. Виды эксперимента и методика его использования. 2. Функции химического эксперимента. 3. Проблемный эксперимент. ПЛАН ЛЕКЦИИ
- 3. Химический эксперимент - важнейший метод и средство обучения химии.
- 4. 1. Виды эксперимента и методика его использования.
- 5. Демонстрационный химический эксперимент — главное средство наглядности на уроке.
- 6. Когда применяется демонстрационный эксперимент на уроке? В начале школьного курса — для привития экспериментальных умений и
- 7. ТРЕБОВАНИЯ К ДЕМОНСТРАЦИОННОМУ ЭКСПЕРИМЕНТУ 1. Наглядность — большой объем реактивов и посуды, виден с последних рядов,
- 8. МЕТОДИКА ПРОВЕДЕНИЯ ДЕМОНСТРАЦИОННЫХ ОПЫТОВ Постановка цели опыта: для чего проводится данный опыт, в чем должны убедиться
- 9. последовательность демонстраций: • горение угля • горение серы • горение фосфора • горение железа ТЕМА «КИСЛОРОД»
- 10. ЛАБОРАТОРНЫЕ ОПЫТЫ УЧЕНИЧЕСКИЙ ЭКСПЕРИМЕНТ ПРАКТИЧЕСКИЕ РАБОТЫ
- 11. ЭТАПЫ ВЫПОЛНЕНИЯ - осознание цели опыта - изучение веществ - монтаж прибора - выполнение опыта -
- 12. ПО ФОРМЕ ОРГАНИЗАЦИИ ЛАБОРАТОРНЫЕ ОПЫТЫ - Индивидуальными - Групповыми - Коллективными
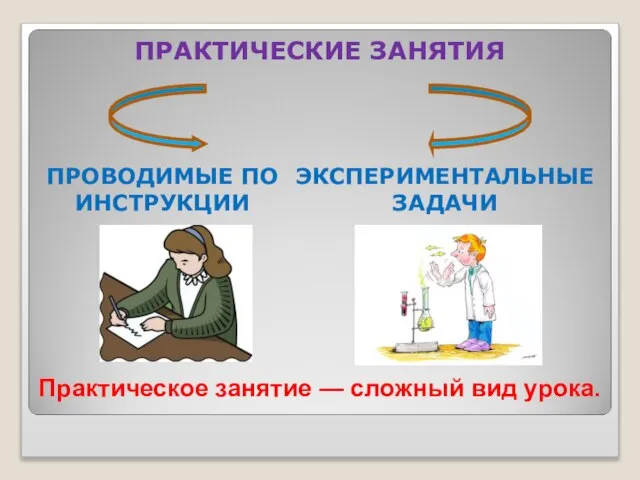
- 13. ПРОВОДИМЫЕ ПО ИНСТРУКЦИИ ПРАКТИЧЕСКИЕ ЗАНЯТИЯ ЭКСПЕРИМЕНТАЛЬНЫЕ ЗАДАЧИ Практическое занятие — сложный вид урока.
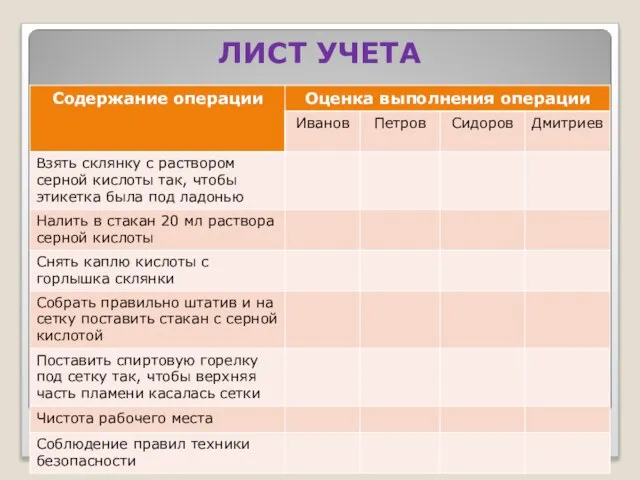
- 14. ЛИСТ УЧЕТА
- 15. ДОМАШНИЙ ХИМИЧЕСКИЙ ЭКСПЕРИМЕНТ – один из видов самостоятельной работы учащихся Используемые реактивы должны быть безопасными и
- 16. ОПЫТЫ С РАЗДЕЛЕНИЕМ СМЕСИ ВЕЩЕСТВ
- 17. 2. Функции химического эксперимента. - Эвристическая - Корректирующая - Обобщающая - Исследовательская
- 18. РЕАКЦИЯ ВЗАИМОДЕЙСТВИЯ ГАЗООБРАЗНОГО ВОДОРОДА С ОКСИДОМ МЕДИ (II) ЭВРИСТИЧЕСКАЯ ФУНКЦИЯ
- 19. CПОСОБ ПОЛУЧЕНИЯ КИСЛОРОДА ИЗ ПЕРОКСИДА ВОДОРОДА
- 20. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
- 21. КОРРЕКТИРУЮЩАЯ ФУНКЦИЯ
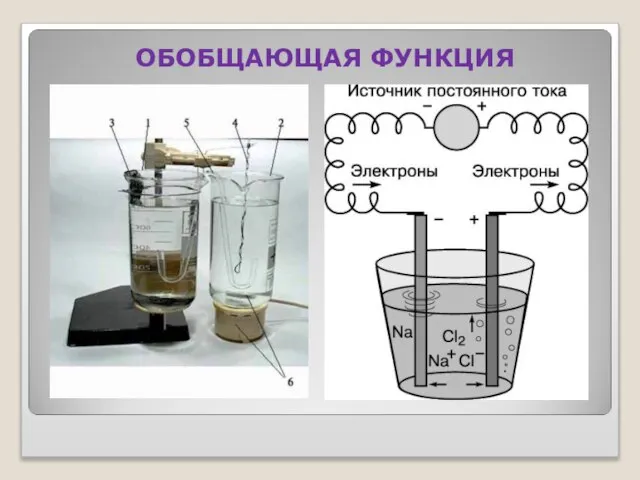
- 22. ОБОБЩАЮЩАЯ ФУНКЦИЯ
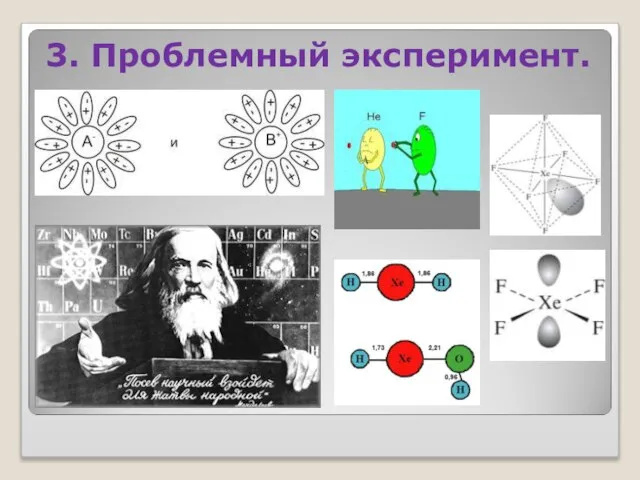
- 23. 3. Проблемный эксперимент.
- 24. ДЛЯ ХИМИИ ХАРАКТЕРЕН ЭКСПЕРИМЕНТ, КОТОРЫЙ НОСИТ ИССЛЕДОВАТЕЛЬСКИЙ И ПРОБЛЕМНЫЙ ХАРАКТЕР
- 25. 1) В чем причина наблюдаемого явления? 2) Почему добавление азотной кислоты влияет на выделение водорода из
- 26. водород, выделяющийся из соляной кислоты, затрачивается на восстановление азотной кислоты. РАБОЧАЯ ГИПОТЕЗА HNО3 + 8Н =
- 27. - актуализация знаний; - постановка целей исследования; - проведение теоретического анализа; - построение гипотезы; - составление
- 28. Слабая кислота вытесняет сильную из ее соли ПРИМЕРЫ ПАРАДОКСАЛЬНЫХ ОПЫТОВ Реактивы. Борная кислота, хлорид натрия, универсальная
- 29. ИЗМЕНЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ РЕАКЦИИ ∆Н°(р-ции) ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ 2NaCl + 4Н3ВО3 = Na2B4О7 + 5Н2O + 2HCl↑
- 30. 2NaCl + 4Н3ВО3 = Na2B4О7 + 5Н2O+ 2HCl↑ ∆S°298 72,36 89,49 189,5 188,74 186,7 (ж/(моль •
- 31. Т= ∆Н/∆S ТЕМПЕРАТУРА, ПРИ КОТОРОЙ ВОЗМОЖНО ПРОТЕКАНИЕ РЕАКЦИИ Т= ∆Н/∆S = 486,6/1 = 486,6 К, или
- 32. Реактивы. Свежеосажденная медь, 10%-й раствор хлорида железа (III). Растворение меди в растворе хлорида железа(III) Объяснение опыта.
- 33. Е = E(ок-ля ) — E(в-ля) ЭДС (Е) окислительно-восстановительного элемента равна: Если Е>0, то данная реакция
- 34. Реактивы. 15-25 %-й раствор аммиака, свежеосажденная медь. Растворение меди в растворе аммиака Объяснение опыта. 2Cu +
- 35. РАСЧЕТ ЭДС: Cu + 4NH3 - 2ē = 2[Cu(NH3)4]2+ Е° = - 0,07 В O2 +
- 36. Ваниль, - душистая добавка к кондитерским изделиям. Ванилью называют высушенные плоды, стручки тропического растения из семейства
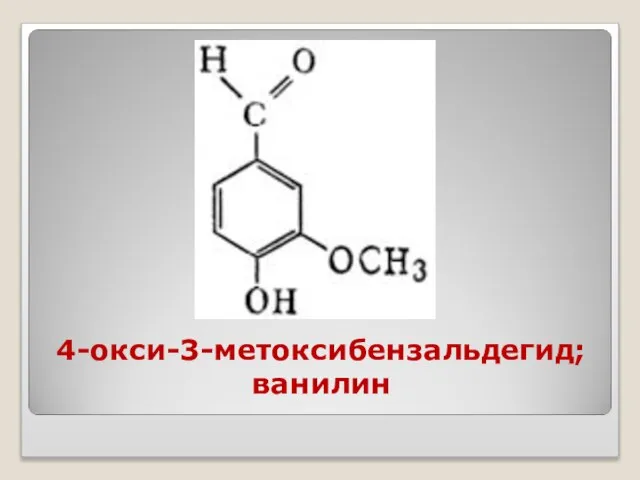
- 37. 4-окси-3-метоксибензальдегид; ванилин
- 39. 1. Приготовьте 3%-ый водный раствор ванилина (при 14˚С в 100 г воды растворяется 1 г вещества,
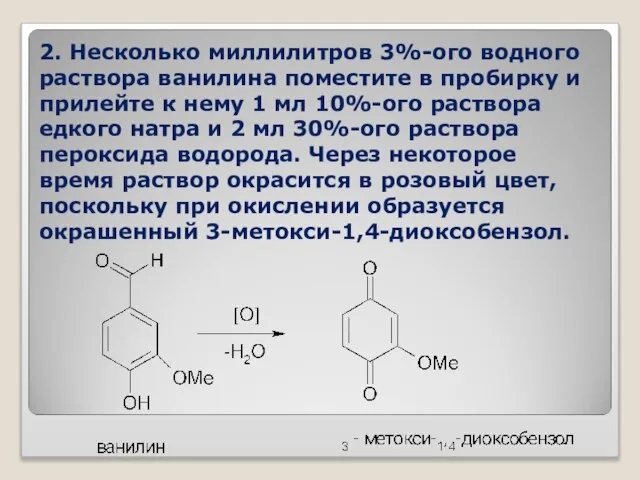
- 40. 2. Несколько миллилитров 3%-ого водного раствора ванилина поместите в пробирку и прилейте к нему 1 мл
- 42. Скачать презентацию




























![РАСЧЕТ ЭДС: Cu + 4NH3 - 2ē = 2[Cu(NH3)4]2+ Е° =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/538817/slide-34.jpg)



 Химическая связь и строение молекул. Лекция 2
Химическая связь и строение молекул. Лекция 2 Презентация по Химии "Техника безопасности в кабинете химии" - скачать смотреть
Презентация по Химии "Техника безопасности в кабинете химии" - скачать смотреть  Титан. Нахождение в природе
Титан. Нахождение в природе Ископаемое топливо
Ископаемое топливо Перманганат калия
Перманганат калия Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice
Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice Ржавчина с точки зрения химика
Ржавчина с точки зрения химика Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Применение реакций брожения в пищевой промышленности
Применение реакций брожения в пищевой промышленности Окислительно – восстановительные реакции. Раева Анна Семеновна Учитель химии МОБУ СОШ № 24 имени С. И. Климакова, г. Якутск
Окислительно – восстановительные реакции. Раева Анна Семеновна Учитель химии МОБУ СОШ № 24 имени С. И. Климакова, г. Якутск Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Предмет химии. Основные задачи курса
Предмет химии. Основные задачи курса План для домашней работы по теме «Алкадиены»
План для домашней работы по теме «Алкадиены» Липиды. Фосфолипиды
Липиды. Фосфолипиды Типы химических реакций. Класс «оксиды»
Типы химических реакций. Класс «оксиды» Катаболизм фенилаланина, тирозина
Катаболизм фенилаланина, тирозина Atomic structure and properties. (Chapter 3)
Atomic structure and properties. (Chapter 3) Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Массообменные процессы
Массообменные процессы Производство синтетического аммиака (лекция 13)
Производство синтетического аммиака (лекция 13) Благородные металлы
Благородные металлы Алюминий и его соединения
Алюминий и его соединения Предельные спирты и фенолы
Предельные спирты и фенолы Предельные углеводороды
Предельные углеводороды МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Индикаторный метод титрования
Индикаторный метод титрования Презентация по Химии "Д.И. Менделеев – основоположник русской агрохимии" - скачать смотреть
Презентация по Химии "Д.И. Менделеев – основоположник русской агрохимии" - скачать смотреть