Содержание
- 2. Калия перманганат (распространённое название в быту — марганцовка) — калиевая соль марганцевой кислоты (KMnO4). ФИЗИЧЕСКИЕ СВОЙСТВА
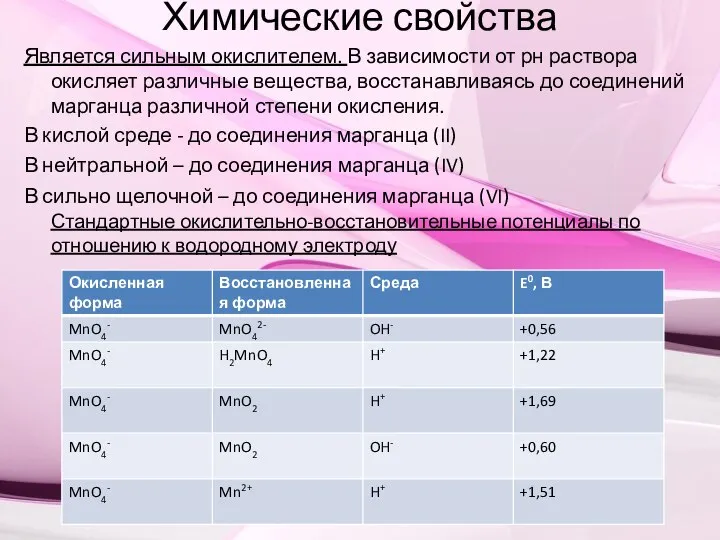
- 3. Химические свойства Является сильным окислителем. В зависимости от рн раствора окисляет различные вещества, восстанавливаясь до соединений
- 4. Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия: в кислой среде: 2KMnO4 + 5K2SO3
- 5. При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему
- 6. Известные способы получения KMnO4 Исторически первый способ получения перманганата калия – синтез манганата (VI) калия из
- 7. Вследствие образования МnО2 процесс невыгоден и необходимо регенерировать KОН из образующегося поташа по реакции K2CO3 +
- 8. На второй стадии плав выщелачивают и полученный раствор подвергают электролизу. При этом на аноде окисляется ион
- 9. Применение Применение этой соли основано на высокой окисляющей способности перманганат-иона. - Щелочной раствор перманганата калия хорошо
- 10. Фармакологическое действие Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата
- 11. Показания Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта
- 12. Калия перманганат (порошок для приготовления раствора) входит в Таблицу III прекурсоров, оборот которых в Российской Федерации
- 13. Срок хранения марганцовки Законодательством РФ установлено, что все химические соединения, применяемые в медицинских целях, имеют определенный
- 14. Правила хранения Марганцовая пыль оказывает на человеческий организм токсическое воздействие. Потому важно соблюдать определенные привала хранения
- 15. ПЕРМАНГАНАТОМЕТРИЯ Рабочим раствором метода является перманганат калия KMnO4. Его окислительная способность зависит от условий реакции. Наибольшей
- 16. Прямым титрование перманганатом калия можно определить лишь Fе2+, выступающего в качестве восстановителя: 5Fе2+ + KМnO4 +
- 18. Скачать презентацию














 Органические вяжущие. Битумы
Органические вяжущие. Битумы Химическое сопротивление меди и ее сплавов
Химическое сопротивление меди и ее сплавов АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ
АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ Приготовление раствора сахара
Приготовление раствора сахара Алкины. Ацетилен (Этин) – С2Н2
Алкины. Ацетилен (Этин) – С2Н2 Строение атома
Строение атома Ископаемое сырье органической химии
Ископаемое сырье органической химии Увлекательная химия
Увлекательная химия Научная работа по химии: «Создание рисунков на стекле методом травления плавиковой кислотой». Выполнила: Черникова Виктория 11 «
Научная работа по химии: «Создание рисунков на стекле методом травления плавиковой кислотой». Выполнила: Черникова Виктория 11 « Углеводы. Дисахариды и полисахариды
Углеводы. Дисахариды и полисахариды Биоорганическая химия
Биоорганическая химия Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Основы химической кинетики и химическое равновесие (лекция 5)
Основы химической кинетики и химическое равновесие (лекция 5) Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Хлор. Нахождение в природе
Хлор. Нахождение в природе Кремневые породы
Кремневые породы Фотосинтез процесі
Фотосинтез процесі Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Углеводы – структура, функции, свойства
Углеводы – структура, функции, свойства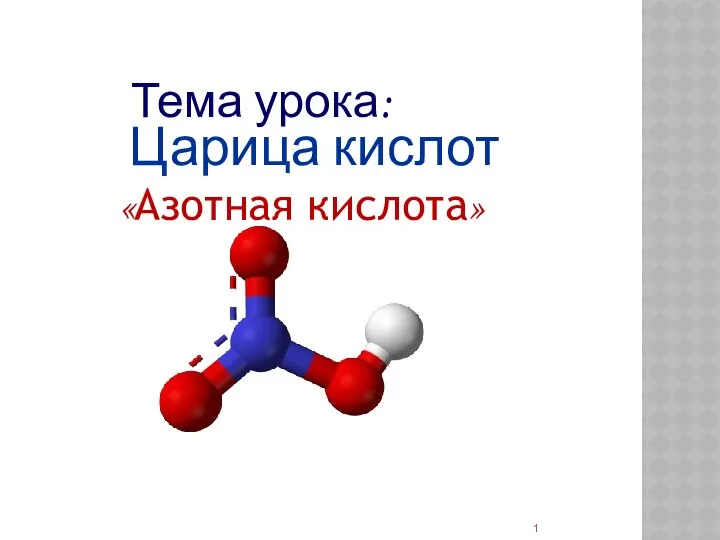 Азотная кислота
Азотная кислота Полісахариди харчових продуктів і їх властивості. Лекція 4
Полісахариди харчових продуктів і їх властивості. Лекція 4 Красная книга Алтайского края - Птицы
Красная книга Алтайского края - Птицы Peek. Сферы применения
Peek. Сферы применения Нефелиновые сиениты. Щелочные породы
Нефелиновые сиениты. Щелочные породы Структуры в сталях
Структуры в сталях Химические явления. Уравнения химических реакций
Химические явления. Уравнения химических реакций Осадочные породы. (Лекция 9.2)
Осадочные породы. (Лекция 9.2) Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості