Содержание
- 2. Физические свойства Аммиак – бесцветный газ с характерным запахом. При охлаждении до – 33,35 оС аммиак
- 3. Сухие аммиак и воздух образуют взрывоопасные смеси, предел взрываемости которых при 18 оС находится в диапазоне
- 4. Химические свойства С водой аммиак образует гидраты NH3, H2O и 2NH3·H2O. При растворении в воде устанавливаются
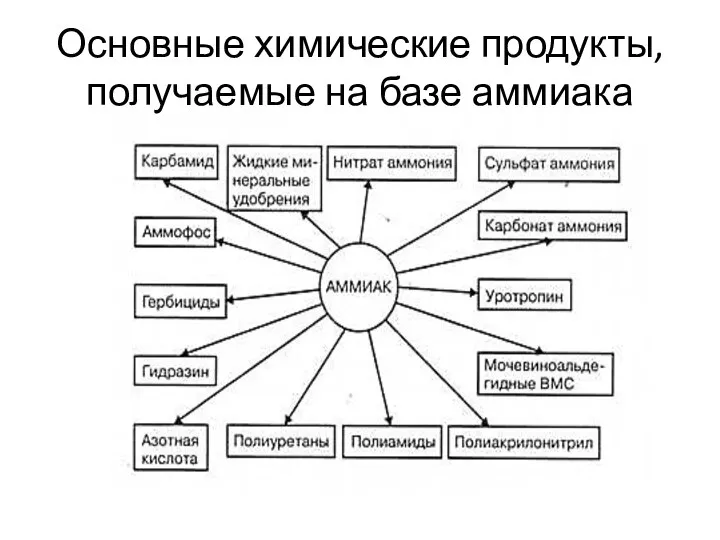
- 5. Основные химические продукты, получаемые на базе аммиака
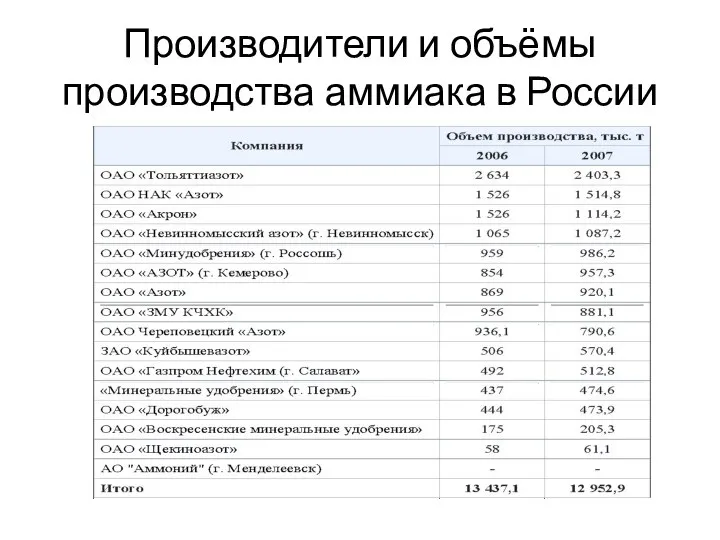
- 6. Производители и объёмы производства аммиака в России
- 7. Физико-химические основы производства синтетического аммиака Равновесие синтеза аммиака Процесс синтеза аммиака описывается следующим уравнением: N2 +
- 8. Для расчета равновесной степени превращения зададимся следующими данными: состав исходной газовой смеси – чистые азот и
- 9. Константу равновесия реакции можно записать в следующем виде: Для определения равновесных концентраций компонентов в газовой смеси
- 10. Выразим концентрацию всех компонентов через. CNH3 получим: или Для упрощения решения этого уравнения извлечем корень квадратный
- 11. После упрощения этого уравнения получим квадратное уравнение с одним неизвестным: Для решения этого уравнения относительно CNH3
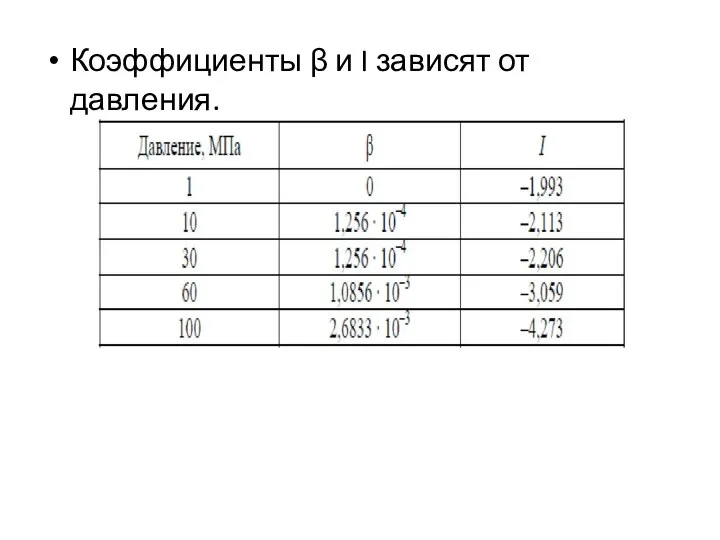
- 12. Коэффициенты β и I зависят от давления.
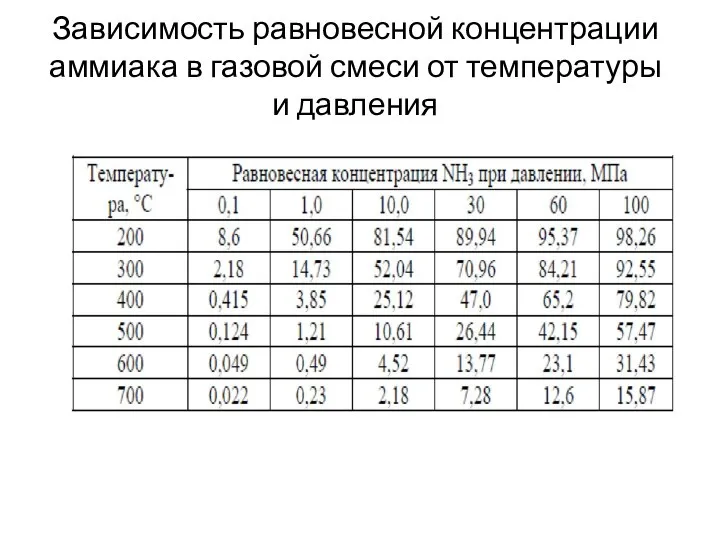
- 13. Зависимость равновесной концентрации аммиака в газовой смеси от температуры и давления
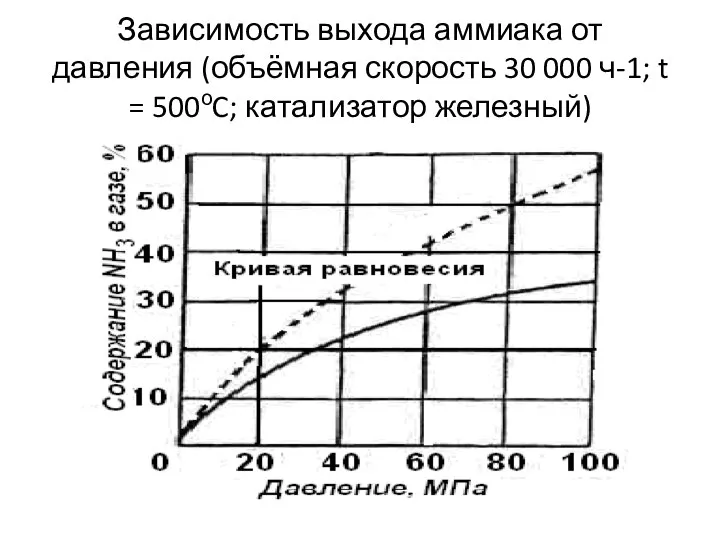
- 14. Зависимость выхода аммиака от давления (объёмная скорость 30 000 ч-1; t = 500оC; катализатор железный)
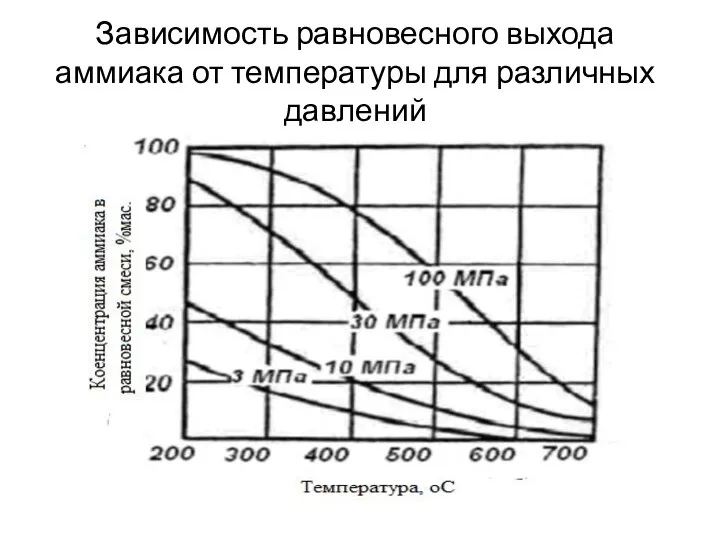
- 15. Зависимость равновесного выхода аммиака от температуры для различных давлений
- 16. Катализаторы синтеза аммиака В результате многолетних исследований было установлено, что каталитическими свойствами по отношению к реакции
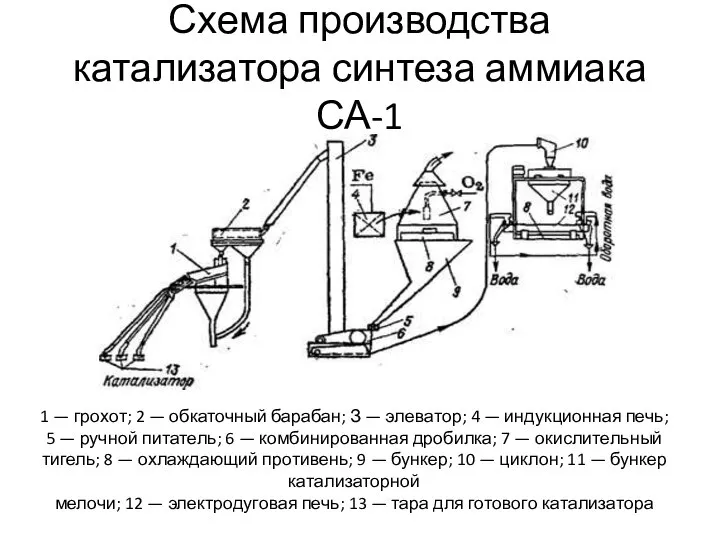
- 17. Схема производства катализатора синтеза аммиака СА-1 1 — грохот; 2 — обкаточный барабан; З — элеватор;
- 18. Кинетика синтеза аммиака Механизм действия катализатора Cинтез аммиака состоит из нескольких стадий, включающих: диффузию азота и
- 19. Лимитирующей стадией катализа является активирующая адсорбция азота. Исходя из этого, М. И. Темкин и В. М.
- 20. Таким образом, в условиях, удаленных от состояния равновесия, кинетическое уравнение приобретает вид: Отсюда следует, что максимальная
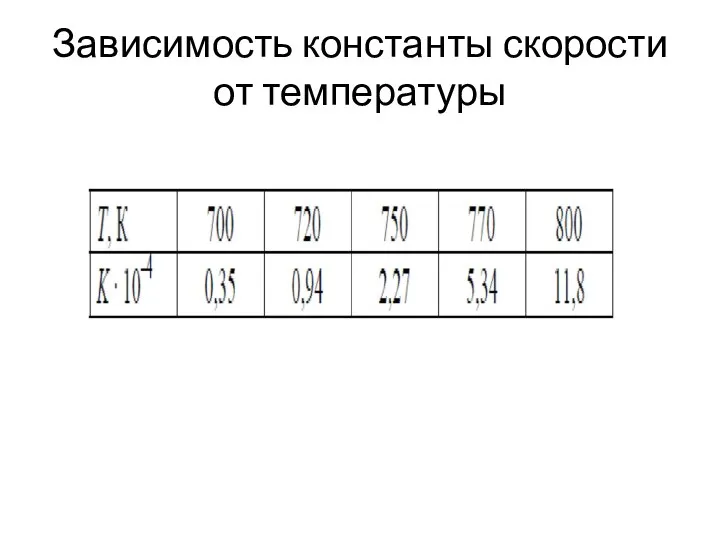
- 21. Зависимость константы скорости от температуры
- 22. Для расчета концентрации аммиака на выходе из колонны синтеза предложено следующее уравнение: где K1 – константа
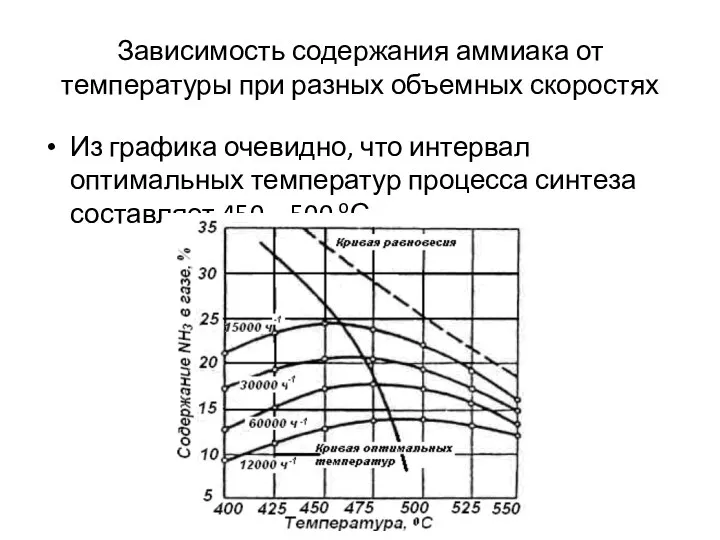
- 23. Зависимость содержания аммиака от температуры при разных объемных скоростях Из графика очевидно, что интервал оптимальных температур
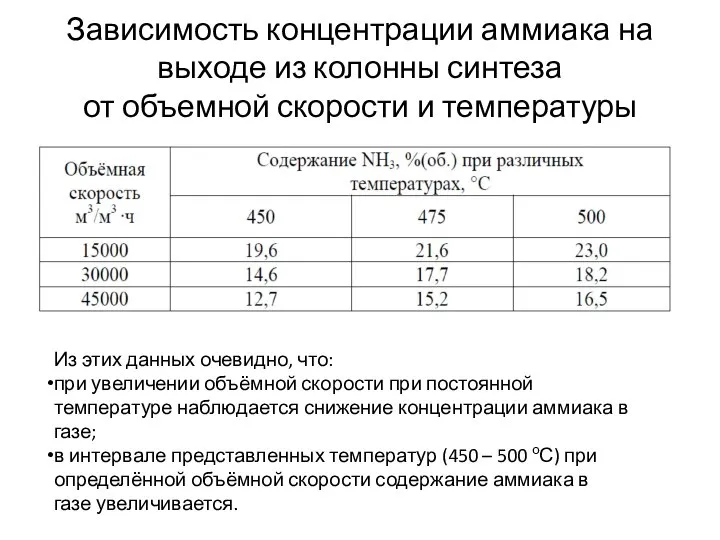
- 24. Зависимость концентрации аммиака на выходе из колонны синтеза от объемной скорости и температуры Из этих данных
- 25. Производительность катализатора – это съём аммиака (кг) с 1м3 контактной массы в течение одного часа. Удельная
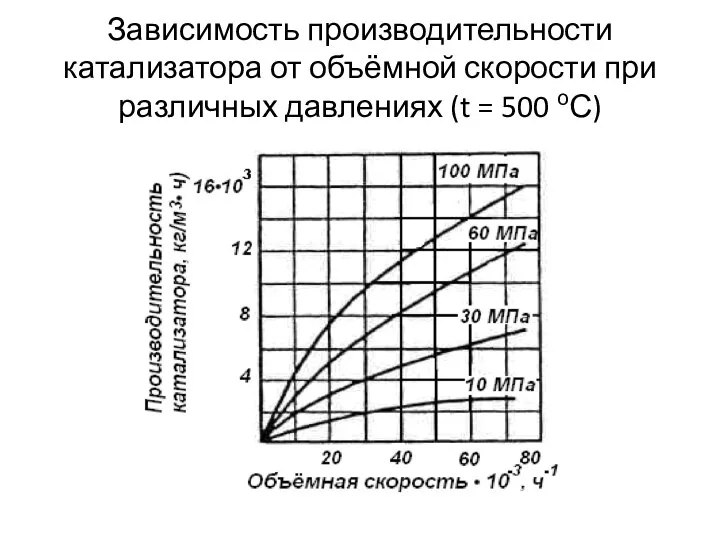
- 26. Зависимость производительности катализатора от объёмной скорости при различных давлениях (t = 500 оС)
- 27. На производительность катализатора оказывает влияние общее давление в системе. Значение эффективного давления зависит от содержания инертных
- 28. Выделение аммиака из прореагировавшей азотоводородной смеси Степень превращения азота и водорода в аммиак в зависимости от
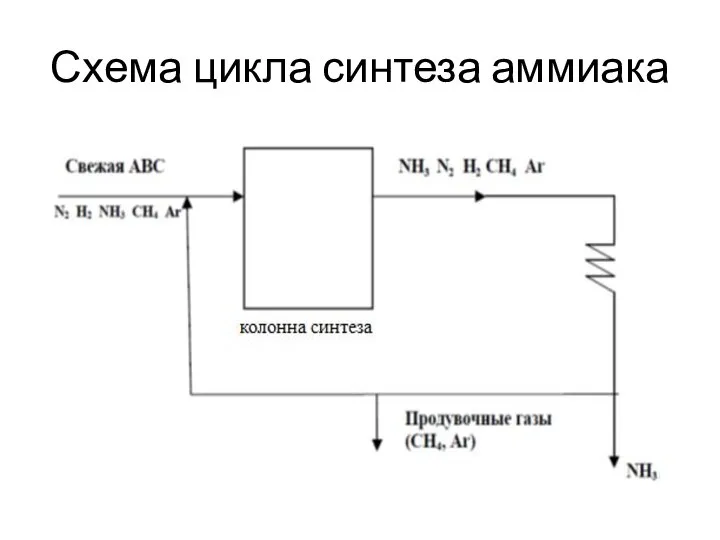
- 29. Схема цикла синтеза аммиака
- 30. Зависимость давления насыщенных паров над жидким аммиаком от температуры характеризуется следующими цифрами: Остаточную концентрацию аммиака в
- 31. Содержание аммиака в газовой смеси после охлаждения рассчитывается по эмпирическому уравнению Ларсона и Блэка: где Р
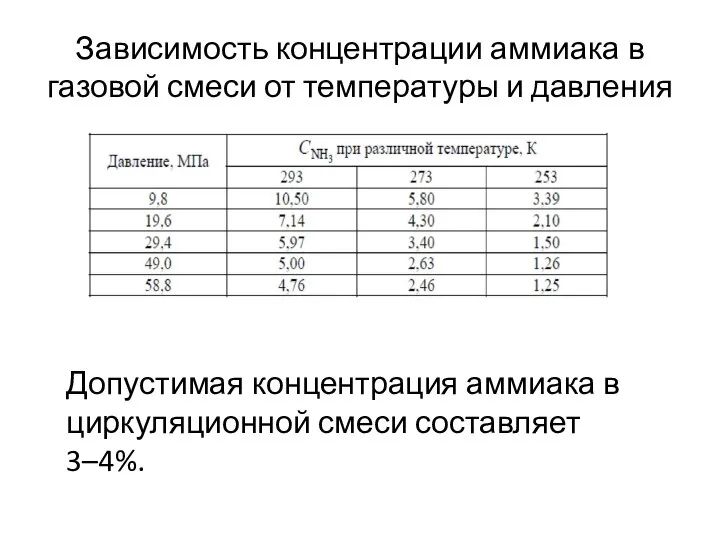
- 32. Зависимость концентрации аммиака в газовой смеси от температуры и давления Допустимая концентрация аммиака в циркуляционной смеси
- 33. Продувочные газы Инерты или инертные газы синтеза аммиака – газы, которые не участвуют в реакции образования
- 34. Современные технологические схемы синтеза аммиака Классификация систем синтеза аммиака Одной их наиболее распространенных и удобных классификацией
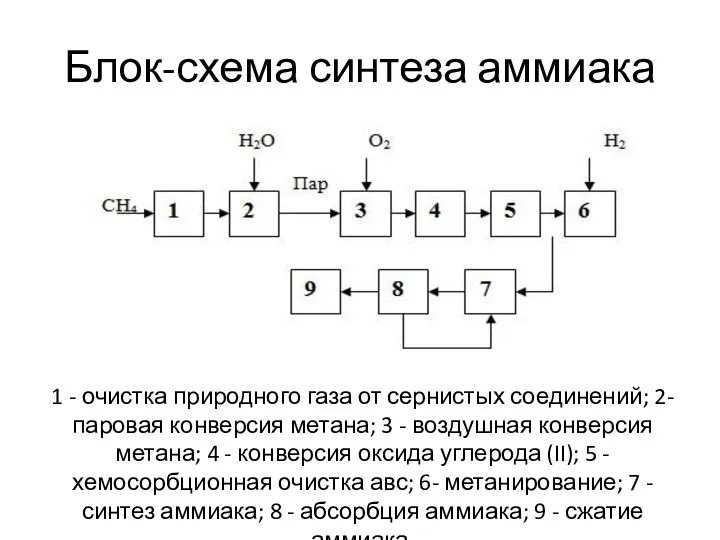
- 35. Блок-схема синтеза аммиака 1 - очистка природного газа от сернистых соединений; 2- паровая конверсия метана; 3
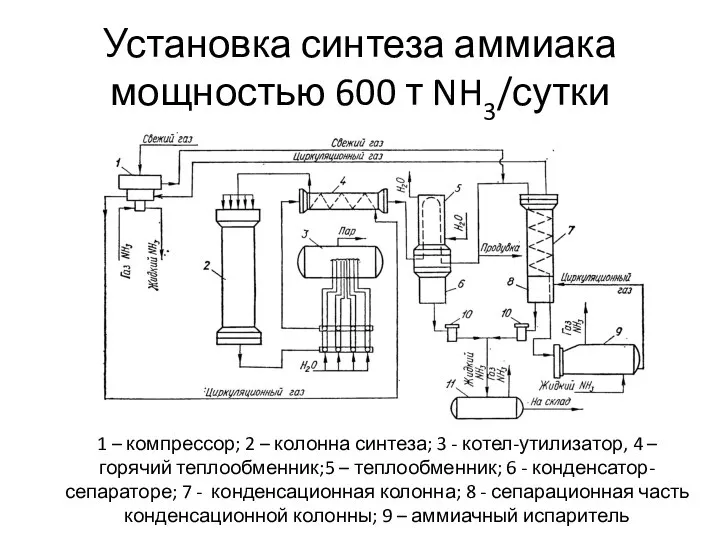
- 36. Установка синтеза аммиака мощностью 600 т NH3/сутки 1 – компрессор; 2 – колонна синтеза; 3 -
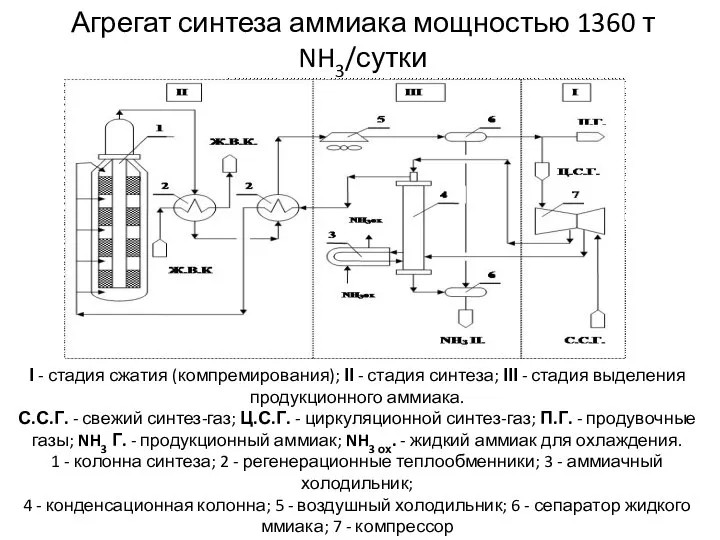
- 37. Агрегат синтеза аммиака мощностью 1360 т NH3/сутки І - стадия сжатия (компремирования); ІІ - стадия синтеза;
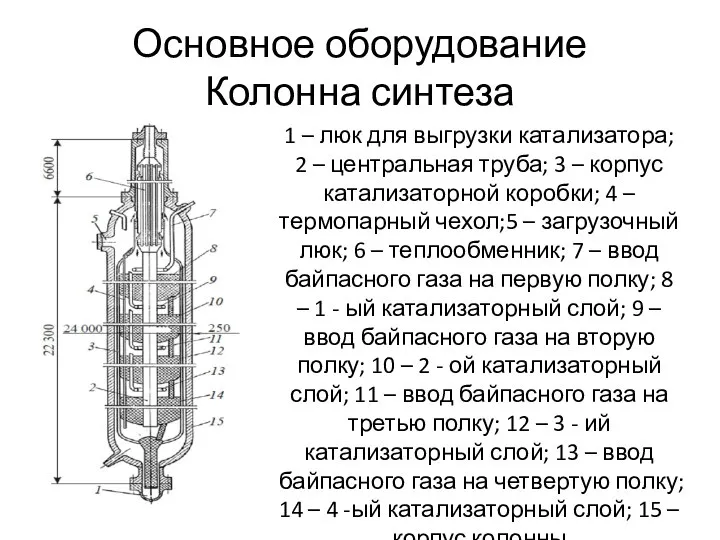
- 38. Основное оборудование Колонна синтеза 1 – люк для выгрузки катализатора; 2 – центральная труба; 3 –
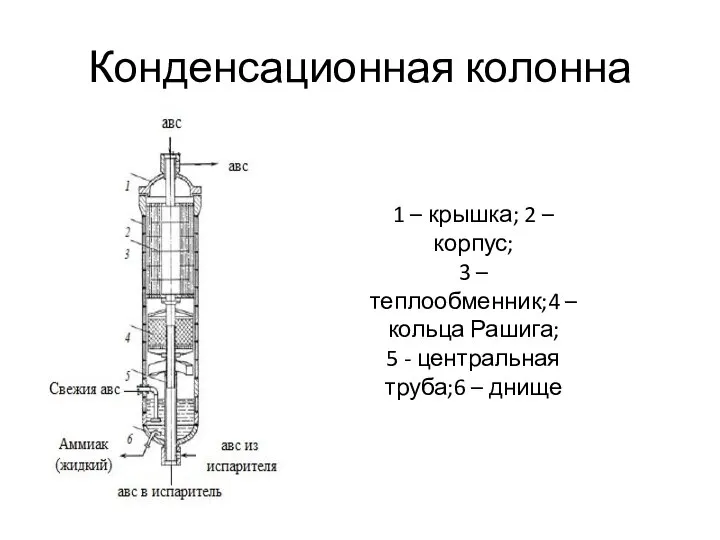
- 39. Конденсационная колонна 1 – крышка; 2 – корпус; 3 – теплообменник;4 – кольца Рашига; 5 -
- 41. Скачать презентацию




















 Презентация по Химии "Теория химического строения органических веществ" - скачать смотреть
Презентация по Химии "Теория химического строения органических веществ" - скачать смотреть  Кинетика химических реакций
Кинетика химических реакций карбонат кальция карбонат кальция мел мрамор известняк
карбонат кальция карбонат кальция мел мрамор известняк Введение в биохимию. Атлас новых профессий
Введение в биохимию. Атлас новых профессий Строение и свойства углеводов и липидов
Строение и свойства углеводов и липидов Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Квантовая механика и квантовая химия
Квантовая механика и квантовая химия Тема урока: Аммиак
Тема урока: Аммиак Древесина и её топливные свойства
Древесина и её топливные свойства Концентраційні межі поширення полум'я
Концентраційні межі поширення полум'я Явище змочування та капілярності в побуті,природі та техніці
Явище змочування та капілярності в побуті,природі та техніці Презентация по Химии "Химия. Щелочные металлы" - скачать смотреть
Презентация по Химии "Химия. Щелочные металлы" - скачать смотреть  Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Презентация Биологическое действие радиации
Презентация Биологическое действие радиации  Структура периодической системы химических элементов
Структура периодической системы химических элементов Конкурс интерактивных презентаций «Интерактивная мозаика» автор: Кудрявцева Ирина Александровна МОУ «Средняя общеобразовател
Конкурс интерактивных презентаций «Интерактивная мозаика» автор: Кудрявцева Ирина Александровна МОУ «Средняя общеобразовател Презентация по Химии "Ліки" - скачать смотреть бесплатно
Презентация по Химии "Ліки" - скачать смотреть бесплатно Хімія і медицина
Хімія і медицина  Харчові добавки Е
Харчові добавки Е  Азотная кислота
Азотная кислота АЛКАНЫ Строение молекулы метана. Свойства метана и его гомологов.
АЛКАНЫ Строение молекулы метана. Свойства метана и его гомологов.  Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения
Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения Аморфні та склоподібні матеріали. (Лекція 2)
Аморфні та склоподібні матеріали. (Лекція 2) Основы теории плавления и отвердевания металлов
Основы теории плавления и отвердевания металлов Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев Карбонатна кислота. Карбонати. Підготувала: Учениця 10 класу Прилуцької ЗОШ І-ІІІ ст. № 13 Імені Святителя Іоасафа Бєлгородсько
Карбонатна кислота. Карбонати. Підготувала: Учениця 10 класу Прилуцької ЗОШ І-ІІІ ст. № 13 Імені Святителя Іоасафа Бєлгородсько