Содержание
- 2. 2SO2 + O2 ↔ 2SO3 Химические реакции, идущие во взаимно противоположных направлениях, называются обратимыми.
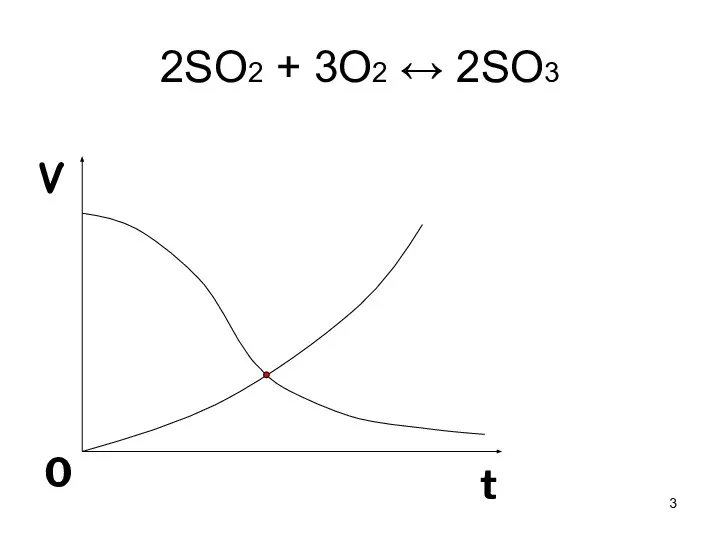
- 3. 2SO2 + O2 ↔ 2SO3 V t 0
- 4. Химическое равновесие - это такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
- 5. Условия смещения равновесия Концентрация (C) Давление (P) Температура (T)
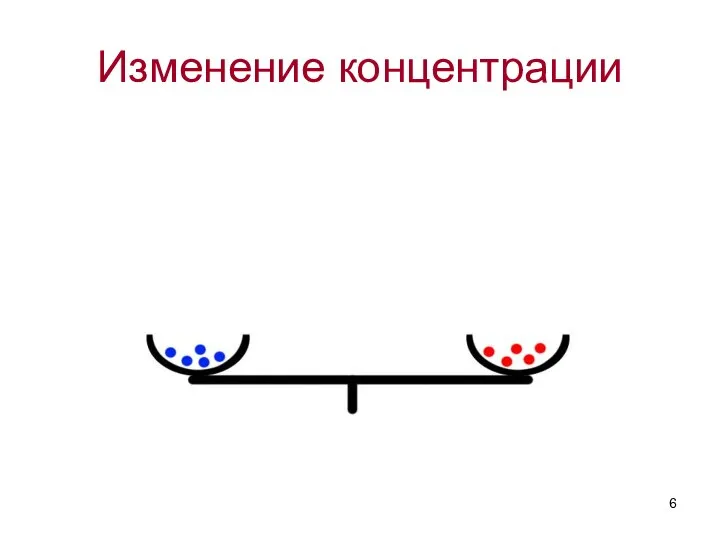
- 6. Изменение концентрации
- 7. Влияние концентрации на химическое равновесие: Увеличение концентрации исходных веществ ведет к смещению равновесия в сторону образования
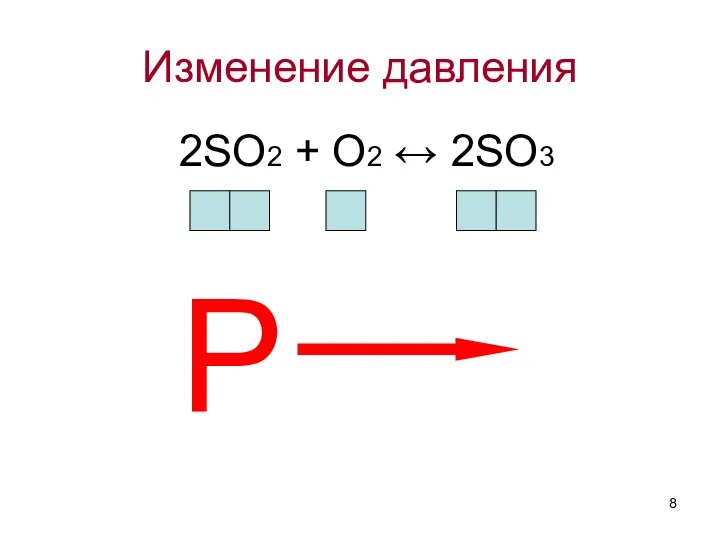
- 8. Изменение давления 2SO2 + O2 ↔ 2SO3 P
- 9. Влияние давления на смещение химического равновесия: Увеличение давления в системе ведет к смещению химического равновесия в
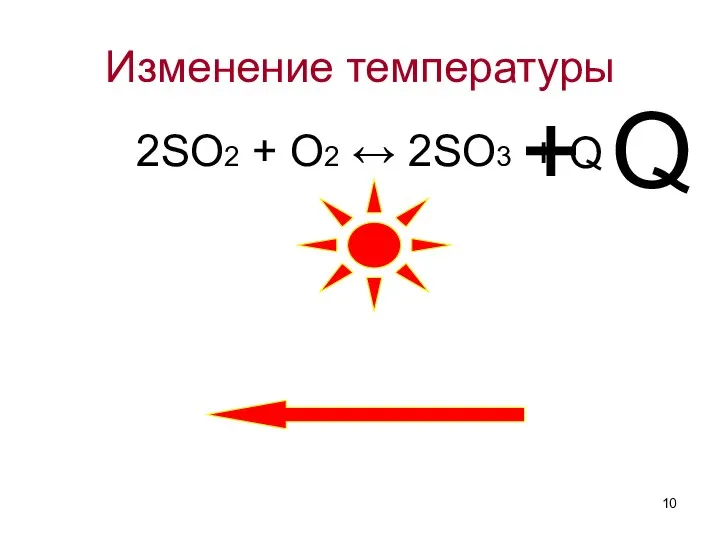
- 10. Изменение температуры 2SO2 + O2 ↔ 2SO3 + Q + Q
- 11. Влияние температуры на смещение равновесия: Повышение температуры ведет к смещению химического равновесия в сторону эндотермической реакции.
- 12. Принцип Ле Шателье: При изменении внешних условий (С, Р, Т) химическое равновесие смещается в сторону той
- 13. Анри Луи Ле Шателье Французский физик и химик, (1850-1936) Большинство работ посвящены прикладным проблемам, разработал пирометр,
- 15. Скачать презентацию








 Теоретические основы неорганического синтеза
Теоретические основы неорганического синтеза Задачі та їх розв’язування
Задачі та їх розв’язування Метали
Метали  Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Химические свойства кислот.
Химические свойства кислот. Этил спиртін өндірісте алу
Этил спиртін өндірісте алу Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Изучение свойств природных индикаторов, содержащихся в растениях
Изучение свойств природных индикаторов, содержащихся в растениях Бальзам-ополаскиватель для волос
Бальзам-ополаскиватель для волос Химическая термодинамика
Химическая термодинамика A laboratory examination of double replacement reaction
A laboratory examination of double replacement reaction Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Выращивание кристаллов Выполнил: ученик 8 класса А Алексеев Ден
Выращивание кристаллов Выполнил: ученик 8 класса А Алексеев Ден Фараонова Змея
Фараонова Змея Характеристика хімічного елементу Hg
Характеристика хімічного елементу Hg Алканы. Гомологический ряд и изомерия
Алканы. Гомологический ряд и изомерия Твердые тела и их свойства
Твердые тела и их свойства Свойства топлив Стабильность бензинов
Свойства топлив Стабильность бензинов Презентация по Химии "Волокна" - скачать смотреть бесплатно
Презентация по Химии "Волокна" - скачать смотреть бесплатно Законы химической термодинамики. Часть 1. Физическая и коллоидная химия
Законы химической термодинамики. Часть 1. Физическая и коллоидная химия Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Бионеорганическая химия. Комплексообразование в организме. (Лекция 3)
Бионеорганическая химия. Комплексообразование в организме. (Лекция 3) Презентация по Химии "Токсикологическая химия" - скачать смотреть
Презентация по Химии "Токсикологическая химия" - скачать смотреть  Органическая химия и важнейшие органические соединения углевода
Органическая химия и важнейшие органические соединения углевода Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Химический элемент медь. (11 класс)
Химический элемент медь. (11 класс) «Химия и окружающая среда»
«Химия и окружающая среда»  Сера и её аллотропные модификации
Сера и её аллотропные модификации