Агрегатний стан: тверді, за винятком Hg, Ga.
Колір: усі відтінки від сірого
до чорного (винятки Cu, Au).
Тепло – й електропровідність (за рахунок вільних електронів) збільшуються в ряді Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag.
Ковкість і пластичність (йони безпосередньо один з одним не зв'язані, тому окремі їх шари можуть зміщатися один відносно одного). Найбільш пластичний метал – золото, найбільш крихкий – хром, манган, стибій.
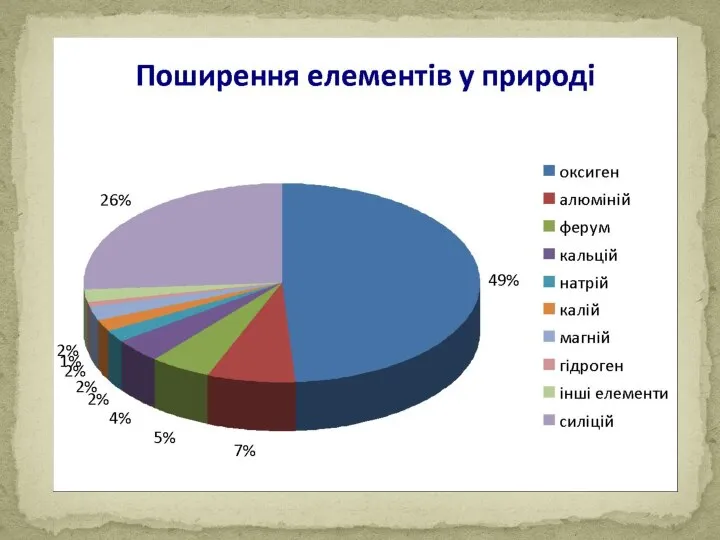
Густина: легкі – ρ < 5 г/см ³ (ρ (Li) = 0,53 г/см ³); важкі – ρ > 5 г/см ³ (ρ (Os) = 22,48 г/см ³).
Твердість: м'які (лужні метали); тверді (хром).
Температура плавлення: легкоплавкі – Tпл (Hg) = 38,87 С; тугоплавкі – Тпл (W)=3370 С.
Температура кипіння в металів висока.
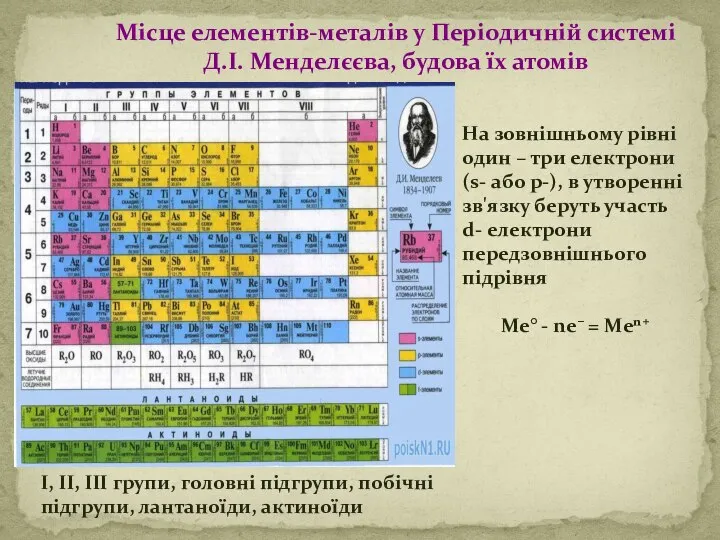
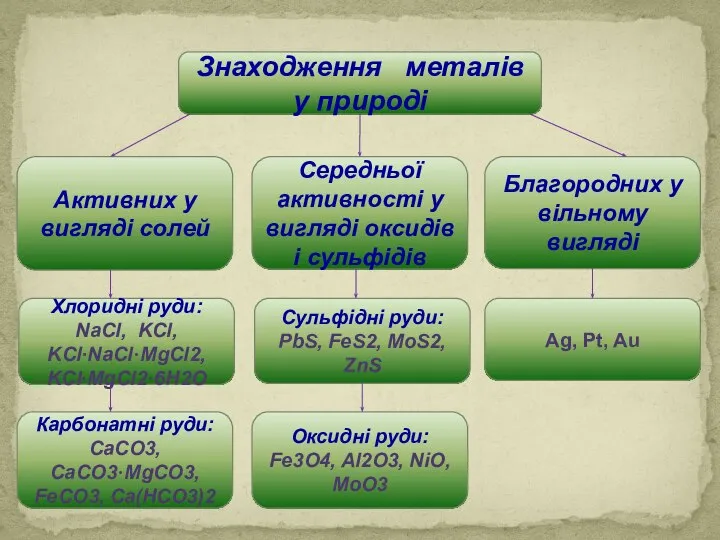
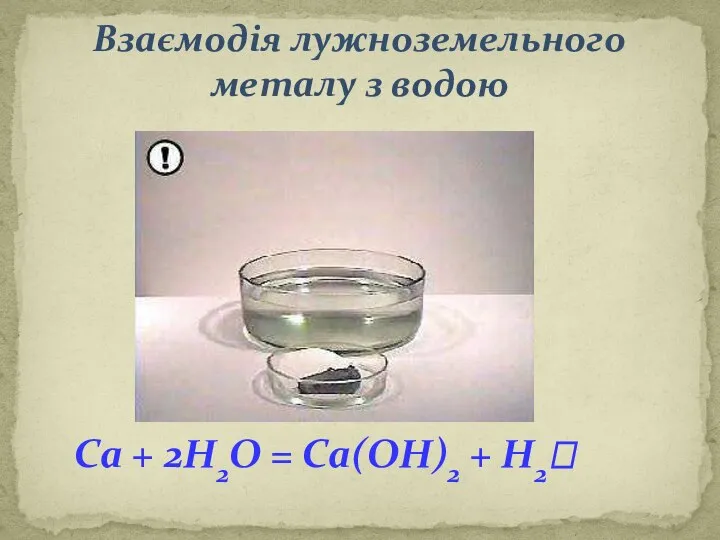
Загальні фізичні властивості металів













 Пластмассы, их классификация и применение
Пластмассы, их классификация и применение Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Как сохранить жизнь букету
Как сохранить жизнь букету Місце хімії серед наук про природу Виконала учениця 9-А класу, Велітченко Юлія
Місце хімії серед наук про природу Виконала учениця 9-А класу, Велітченко Юлія  Химические формулы. Атомная и молекулярная массы
Химические формулы. Атомная и молекулярная массы Биодеградируемые полимеры – продукты биотехнологии
Биодеградируемые полимеры – продукты биотехнологии Знаки химических элементов. Дополнение
Знаки химических элементов. Дополнение Химическая связь в кристаллах
Химическая связь в кристаллах Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома
Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома кислородные соед.азота
кислородные соед.азота Йодиметрия и йодометрия. (Лекция 9)
Йодиметрия и йодометрия. (Лекция 9) Общая характеристика металлов
Общая характеристика металлов Карбоновые кислоты
Карбоновые кислоты Алканы (Предельные углеводороды. Парафины. Насыщенные углеводороды)
Алканы (Предельные углеводороды. Парафины. Насыщенные углеводороды) Оксигенвмісні органічні сполуки. Лекція 12
Оксигенвмісні органічні сполуки. Лекція 12 Кристаллооптический метод в петрографии
Кристаллооптический метод в петрографии Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Анализ лекарственных веществ гетероциклического строения, производных имидазола, имидазолина, пиразола, пиразолидина. (Тема 2)
Анализ лекарственных веществ гетероциклического строения, производных имидазола, имидазолина, пиразола, пиразолидина. (Тема 2) Хімічні властивості кислот
Хімічні властивості кислот Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде
Бензол қатарының гетерофункционалды туындылары дәрілік заттар ретінде Торжество периодического закона К 175-летию со дня рождения Д. И. Менделеева К 140-летию со дня создания Периодического закона
Торжество периодического закона К 175-летию со дня рождения Д. И. Менделеева К 140-летию со дня создания Периодического закона Титан и его сплавы
Титан и его сплавы Контрольная работа №1
Контрольная работа №1 Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9)
Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9) Презентация Степень окисления
Презентация Степень окисления