Содержание
- 2. План лекции: История химии. Роль отечественных и зарубежных ученых в развитии химии. Предмет и задачи химии.
- 3. Предмет химии Химия – наука о веществах, их строении, свойствах и превращениях. Предмет химии изучает явления,
- 4. Задачи химии. Изучение веществ, их физических и химических свойств Изучение превращений веществ и процессов, сопровождающих эти
- 5. Роль химии Роль химии в жизни современного общества очень велика. Она проникла во все сферы деятельности
- 6. Значение общей и неорганической химии В подготовке провизоров общая и неорганическая химия являются теоретической базой для
- 7. Химия и проблемы охраны окружающей среды Химическое загрязнение окружающей среды обусловлено следующими факторами: повышением концентрации биогенных
- 8. Периодизация истории химии Выделялют 2 основных основных периода: а) эмпирический (с древности до XVIIIв); процесс познания
- 9. Основные периоды в истории химии 1. Период алхимии - с древности до XVI в. нашей эры.
- 10. Роберт Бойль Он положили начало рождению новой химической науки, отдельной от медицины. Систематизируя многочисленные цветные реакции
- 11. Дмитрий Иванович Менделеев Менделеев оставил свыше 500 печатных трудов, среди которых классические «Основы химии» — первое
- 12. М. В. ЛОМОНОСОВ - ОСНОВОПОЛОЖНИК НАУЧНОЙ ХИМИИ В РОССИИ М.В. Ломоносов - создатель школы российских химиков.
- 13. МОЛЕКУЛЯРНАЯ ТЕОРИЯ АВОГАДРО В 1814 г. итальянский физик и химик А. Авогадро сформулировал закон, который носит
- 14. Й. Я. БЕРЦЕЛИУС вычислил относительные атомные массы всех известных к тому времени элементов (45). Берцелиус ввел
- 15. КАЗАНСКАЯ ХИМИЧЕСКАЯ ШКОЛА Н.Н. Зинин – химик-органик. Открыл метод получения ароматических аминов (реакция Зинина). Впервые синтезировал
- 16. Основные законы химии.
- 17. Основные законы химии Закон сохранения массы Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции.
- 18. Основные законы химии Закон постоянства состава Каждое вещество, каким бы способом оно ни было получено, всегда
- 19. Основные законы химии Закон кратных отношений Если два элемента образуют между собой несколько соединений, то массовые
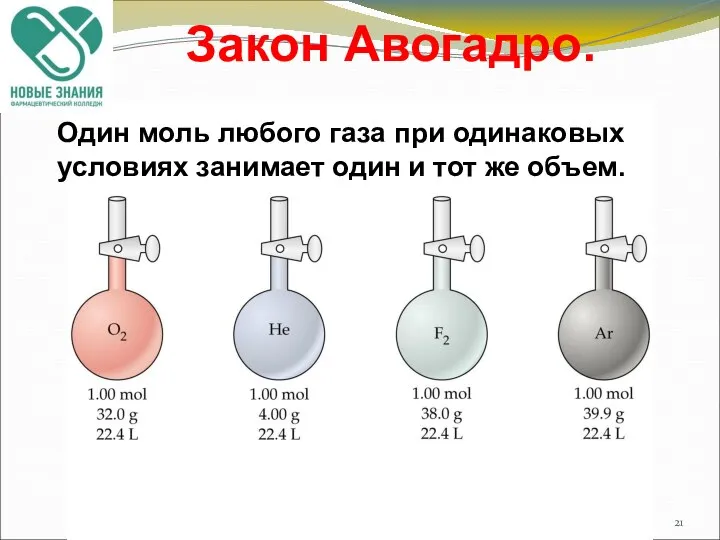
- 20. Основные законы химии Закон Авогадро В равных объемах различных газов при одинаковых условиях (температура и давление)
- 21. Закон Авогадро. Один моль любого газа при одинаковых условиях занимает один и тот же объем.
- 23. Скачать презентацию



















 Металлы и сплавы
Металлы и сплавы ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии
ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Алкины. 10 класс
Алкины. 10 класс Физические свойства элементов
Физические свойства элементов Гидролиз. Методы его получения и применения
Гидролиз. Методы его получения и применения Ученые химики. Выполнила ученица 10 кл. Трофимова Настя
Ученые химики. Выполнила ученица 10 кл. Трофимова Настя Жидкостно-сцинтилляционная спектроскопия
Жидкостно-сцинтилляционная спектроскопия Многоатомные спирты
Многоатомные спирты Алканы. Гомологи, изомеры, номенклатура.
Алканы. Гомологи, изомеры, номенклатура.  Валидация титриметрических методик анализа
Валидация титриметрических методик анализа Электролитическая диссоциация
Электролитическая диссоциация Кислородосодержащие органические соединения (2 часть)
Кислородосодержащие органические соединения (2 часть) Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Синергизм и синергические системы
Синергизм и синергические системы Химические реакции. Типы химических реакций
Химические реакции. Типы химических реакций Требование к оформлению отчета лабораторной работы
Требование к оформлению отчета лабораторной работы ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА  Моделирование химических процессов
Моделирование химических процессов Поверхностное упрочнение деталей. (Лекция 11)
Поверхностное упрочнение деталей. (Лекция 11) Окисно-відновні процеси
Окисно-відновні процеси Кислород, его общая характеристика, нахождение в природе и получение (8 класс)
Кислород, его общая характеристика, нахождение в природе и получение (8 класс) «Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к
«Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к Штучні і синтетичні волокна
Штучні і синтетичні волокна  Современные и новейшие материалы
Современные и новейшие материалы Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна
Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна