Содержание
- 2. Мақсаты: химиялық реакциялардың әр түрлі жылдамдықпен жүретіндігін білу - реакция жылдамдығына әсер ететін факторларды болжау -Химиялық
- 3. Жетістік критерийлері реакция жылдамдығына әсер ететін кем дегенде екі факторды анықтайды: концентрацияның артуы температураның жоғарылауы реагент
- 4. Химиялық реакция жылдамдығы
- 5. Химиялық реакция жылдамдығы нені білдіреді? Әртүрлі химиялық реакциялардың жылдамдығы бір-бірінен күрт ерекшеленеді. Кейбір реакциялар өте тез
- 6. коррозия тоқаш жарылыс баяу тез өте тез Мына реакциялардың жылдамдығы қандай?
- 7. Химиялық реакция жылдамдығы Неге кейбір реакциялар басқаларына қарағанда тез?
- 8. Реакциялар, бөлшектер және соқтығысу Энергияның белгілі бір мөлшері бар бөлшектер соқтығысқан кезде реакциялар жүзеге асады. Бөлшектер
- 9. Химиялық реакция жылдамдығы екі нәрсеге: бөлшектер арасындағы соқтығысудың жиілігіне және бөлшектер соқтығысу үшін қажетті энергияға тәуелді
- 10. Химиялық реакция жылдамдығын өзгерту Әрекеттесетін бөлшектер арасындағы сәтті соқтығысу санын арттыратынның бәрі реакция жылдамдығын жоғарылатады.
- 11. Қандай факторлар реакция жылдамдығына әсер етеді? Әрекеттесуші заттар табиғаты Температураны жоғарылату Еритін реагенттердің концентрациясын жоғарылату
- 12. Қандай факторлар реакция жылдамдығына әсер етеді? Газ тәріздес реагенттердің қысымын жоғарылату Қатты реагенттердің беттік ауданын жоғарылату
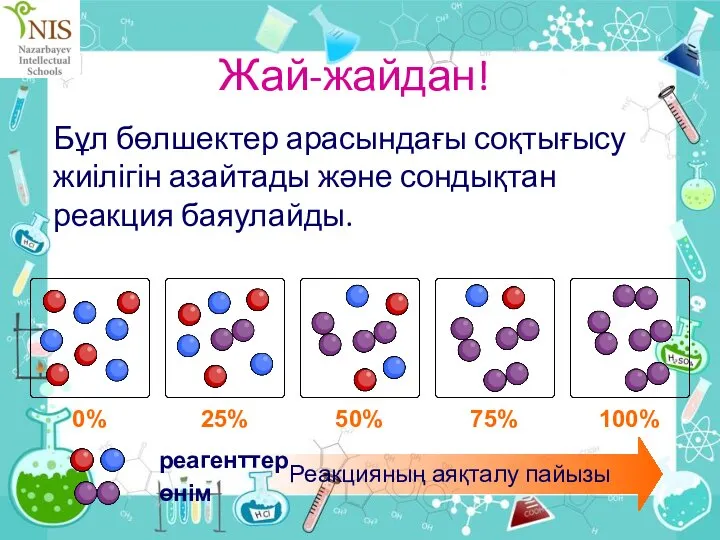
- 13. Жай-жайдан! Реакциялар бірдей жылдамдықпен өтпейді. Олар бастапқыда белгілі бір жылдамдықпен бастайды, одан кейін реакция тоқтағанға дейін
- 14. Жай-жайдан! Бұл бөлшектер арасындағы соқтығысу жиілігін азайтады және сондықтан реакция баяулайды.
- 15. Химиялық реакция жылдамдығының графигі
- 16. Реагенттер – өнімдер қоспасы
- 17. Әрекеттесуші заттар табиғатының химиялық реакция жылдамдығына әсері Мырыш + күкірт қышқылы → мырыш сульфаты + сутек
- 18. Температура және соқтығысу Қалай температура бөлшектердің соқтығысуына әсер етеді?
- 19. Температураның химиялық реакция жылдамдығына әсері Температура жоғарылаған сайын реакция жылдамдығы артады. Көп реакцияда температураны 10 °C
- 20. Неге температураны арттырғанда реакцияның жылдамдығы артады? Температура жоғары болғанда, бөлшектер көбірек энергияға ие болады. Олар жылдамырақ
- 21. Температура және бөлшектер
- 22. Температураның химиялық реакция жылдамдығына әсері Тәжірибе жүргізіп көрейік: Екі сынауыққа мыс (ІІ) оксиді ұнтағын салып, екеуіне
- 23. Температураның химиялық реакция жылдамдығына әсері Екі сынауықта да өтетін химиялық реакция теңдеуі: мыс (ІІ) оксиді +
- 24. Химиялық реакция жылдамдығына температура қалай әсер етеді? Натрий тиосульфат және тұз қышқылы арасындағы реакция нәтижесінде күкірт
- 25. The effect of temperature on rate
- 26. Химиялық реакция жылдамдығына концентрацияның әсері Ерітілген реагенттердің концентрациясы жоғары болған сайын, химиялық реакция жылдамдығы артады.
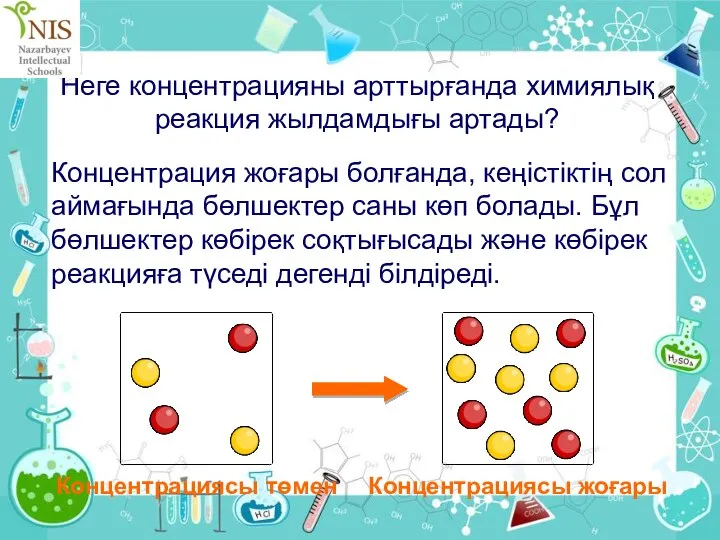
- 27. Неге концентрацияны арттырғанда химиялық реакция жылдамдығы артады? Концентрация жоғары болғанда, кеңістіктің сол аймағында бөлшектер саны көп
- 28. Химиялық реакция жылдамдығына концентрацияның әсері
- 29. Химиялық реакция жылдамдығына концентрацияның әсері
- 30. Мырыш + күкірт қышқылы → мырыш сульфаты + сутек Zn + H2SO4 → ZnSO4 + H2↑
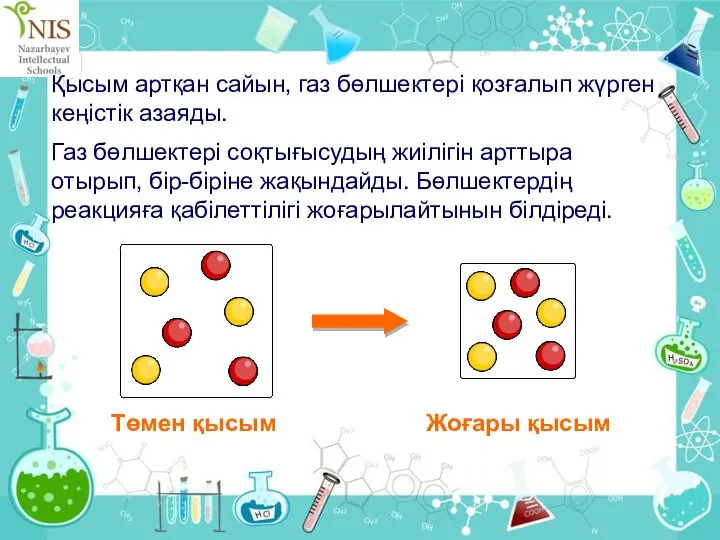
- 31. Химиялық реакция жылдамдығына қысымның әсері Неге газ тәріздес реагенттердің қысымын арттырғанда химиялық реакция жылдамдығы артады?
- 32. Қысым артқан сайын, газ бөлшектері қозғалып жүрген кеңістік азаяды. Газ бөлшектері соқтығысудың жиілігін арттыра отырып, бір-біріне
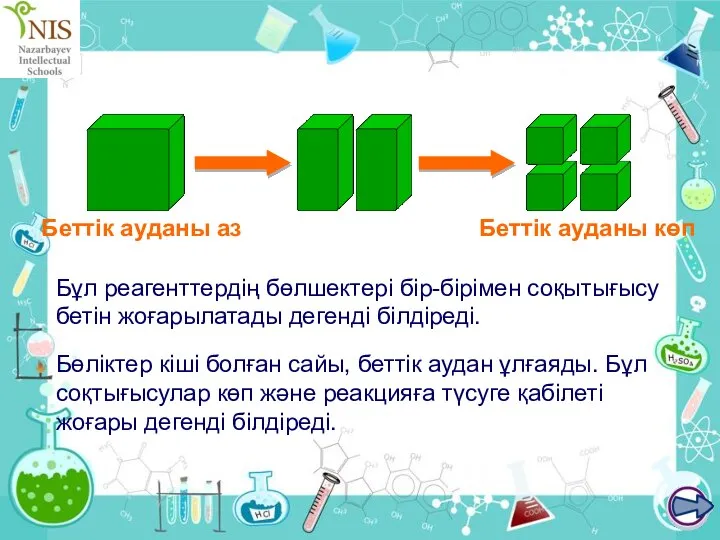
- 33. Химиялық реакция жылдамдығына беттік ауданның әсері Қатты заттары болатын кез келген реакция тек қатты заттың бетінде
- 34. Бөліктер кіші болған сайы, беттік аудан ұлғаяды. Бұл соқтығысулар көп және реакцияға түсуге қабілеті жоғары дегенді
- 35. Химиялық реакция жылдамдығына беттік ауданның әсері
- 36. Карбонат және қышқыл арасындағы реакция Мәрмәр бөлігі – ол кальций карбонаты. Ол тұз қышқылымен әрекеттесіп, көміртек
- 37. Беттік ауданның реакция жылдамдығына әсері
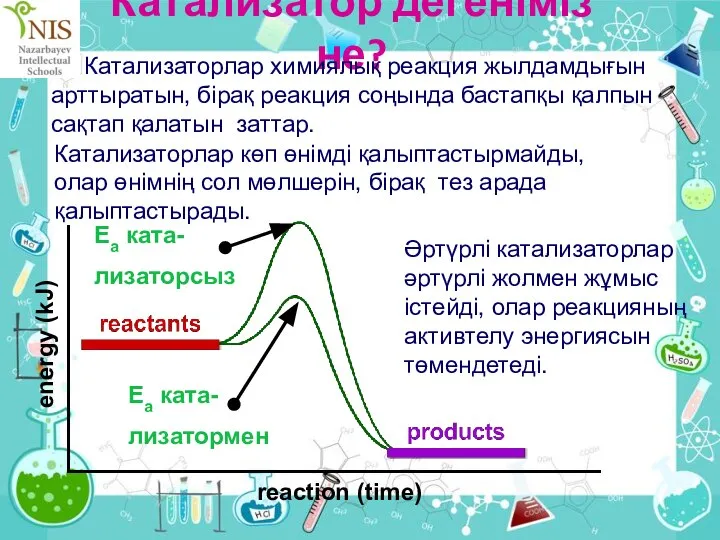
- 38. Катализатор дегеніміз не? Катализаторлар химиялық реакция жылдамдығын арттыратын, бірақ реакция соңында бастапқы қалпын сақтап қалатын заттар.
- 39. Күнделікті катализаторлар Көптеген катализаторлар ауыспалы металдар немесе олардың қосылыстары болып табылады.
- 40. Мысалы: Nickel (никель) – маргаринді өндіру кезінде катализатор ретінде қолданылады. (сұйық өсімдік майын гидрлеу). Platinum (платина)
- 41. Өндірістегі катализаторлар Сонымен қатар катализаторлар тірі ұяшықтар үшін табиғи болып саналады. Биологиялық катализаторлар протеиннің арнайы түрлері
- 42. Сутек пероксиді = Су + Оттек 2 Н2O2 = 2 Н2O + O2 ↑ Химиялық реакция
- 43. Химиялық реакция жылдамдығына әсер ететін факторлар Химиялық реакция жылдамдығы артады: Химиялық белсенді заттар болу; Реагенттердің концентрациясын
- 44. Химиялық реакция жылдамдығына әсер ететін факторлар Химиялық реакция жылдамдығы кемиді: Химиялық белсенді емес заттар болу; Реагенттердің
- 45. Glossary activation energy – активтелу энергиясы – Реакция басталу үшін қажетті энергия мөлшері. catalyst – катализатор
- 46. Бекіту тапсырмалары: Температура жайында қандай сөздер қалдырылып кеткен? Температура жоғары болған сайын, химиялық реакция жылдамдығы ……….
- 47. Концентрация жайында қандай сөздер қалдырылып кеткен? Ерітілген реагенттің концентрациясы ........ болған сайын, химиялық реакция жылдамдығы жоғары
- 48. Қысым жайында қандай сөздер қалдырылып кеткен? Реакцияның қысымы жоғары болған сайын, химиялық реакция жылдамдығы ........... болады.
- 49. Үй тапсырмасы: Келесі факторлар реакция жылдамдығына қалай әсер етеді? а) реагенттердің концентрациясын арттыру; б) қатты реагентті
- 51. Скачать презентацию










































 Углеводы. Глюкоза
Углеводы. Глюкоза Основы органической химии. Углеводороды. Алкины
Основы органической химии. Углеводороды. Алкины Элементы VII группы периодической таблицы Д.И. Менделеева
Элементы VII группы периодической таблицы Д.И. Менделеева Анодные реакции коррозионного процесса
Анодные реакции коррозионного процесса Обмен липидов
Обмен липидов Естественная радиоактивность. Радон
Естественная радиоактивность. Радон Аттестационная работа. Исследование электрических свойств воды и её растворов
Аттестационная работа. Исследование электрических свойств воды и её растворов Нанотехнологии и науки о материалах
Нанотехнологии и науки о материалах Коллигативные свойства растворов
Коллигативные свойства растворов Молекулы и атомы. Простые и сложные вещества
Молекулы и атомы. Простые и сложные вещества Получение кристаллов в домашних условиях
Получение кристаллов в домашних условиях ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Цели: Дать понятия ионной, ковалентной, металлической, водородной хим.связям; Научить определять и запис
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Цели: Дать понятия ионной, ковалентной, металлической, водородной хим.связям; Научить определять и запис Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Выделение урана из растворов (пульп)
Выделение урана из растворов (пульп) Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск
Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Э.М. Спиридонов. Эволюция минералов цинка в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов цинка в зоне гипергенеза Структурная химия катионов переходных элементов
Структурная химия катионов переходных элементов Презентация ОБЩАЯ ЖЕСТКОСТЬ ВОДЫ
Презентация ОБЩАЯ ЖЕСТКОСТЬ ВОДЫ  студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак
студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак Виды полимеризации
Виды полимеризации Физико-химическое явление электролиз
Физико-химическое явление электролиз Альдегиды и кетоны
Альдегиды и кетоны Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій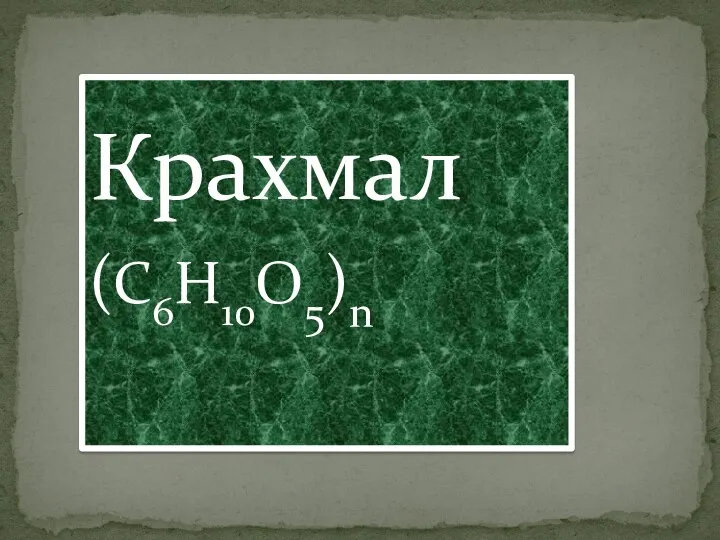 Крахмал (C6H10O5)n
Крахмал (C6H10O5)n  Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Ароматические углеводороды, арены, бензол
Ароматические углеводороды, арены, бензол Наноалмазы детонационного синтеза
Наноалмазы детонационного синтеза