Содержание
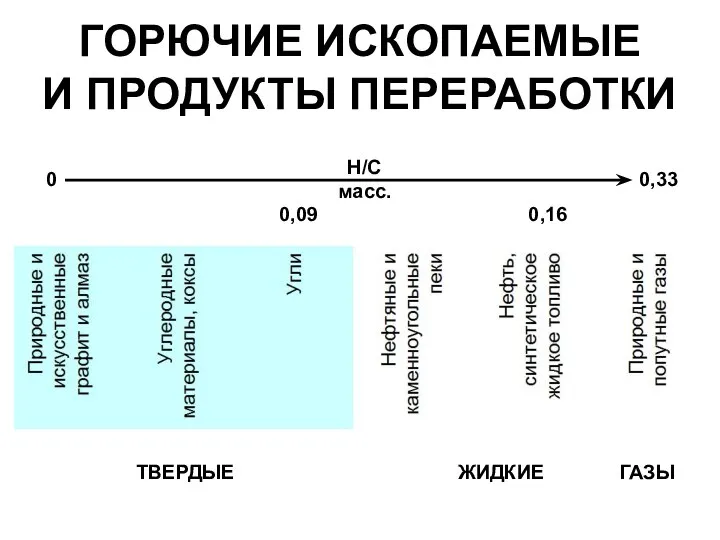
- 2. H/C масс. 0,33 0 ГОРЮЧИЕ ИСКОПАЕМЫЕ И ПРОДУКТЫ ПЕРЕРАБОТКИ 0,09 0,16 ТВЕРДЫЕ ЖИДКИЕ ГАЗЫ
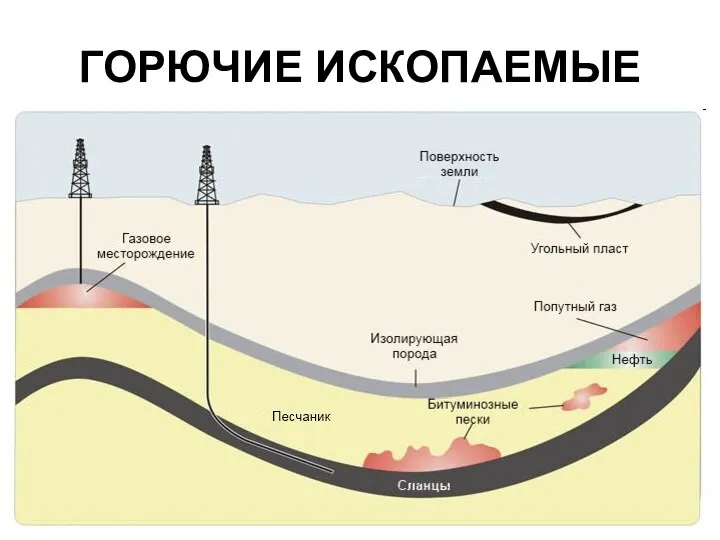
- 3. ГОРЮЧИЕ ИСКОПАЕМЫЕ
- 4. УГЛЕХИМИЧЕСКОЕ СЫРЬЕ ОРГАНИЧЕСКОЙ ХИМИИ
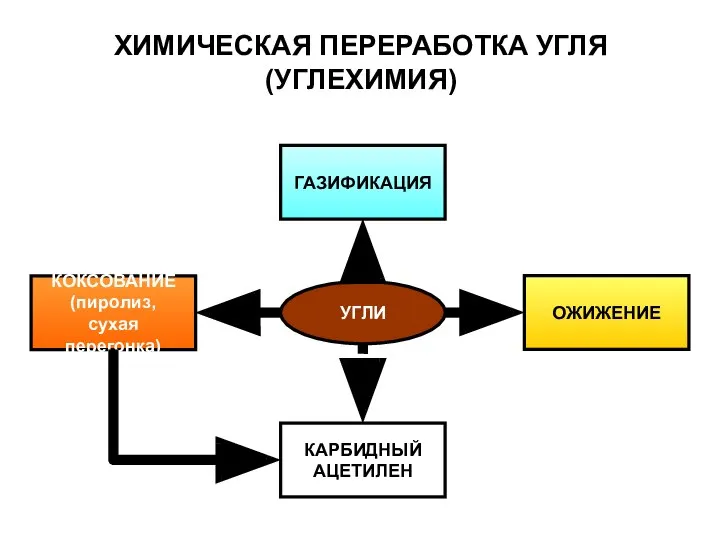
- 5. УГЛИ КОКСОВАНИЕ (пиролиз, сухая перегонка) ГАЗИФИКАЦИЯ КАРБИДНЫЙ АЦЕТИЛЕН ОЖИЖЕНИЕ ХИМИЧЕСКАЯ ПЕРЕРАБОТКА УГЛЯ (УГЛЕХИМИЯ)
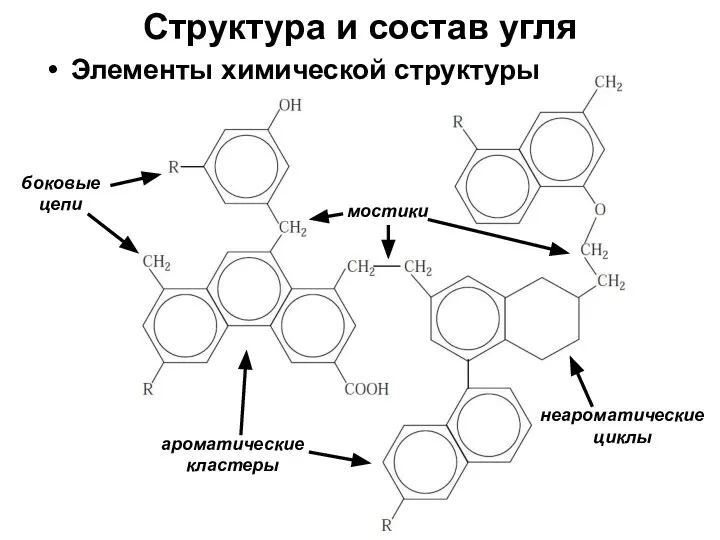
- 6. Структура и состав угля ароматические кластеры мостики боковые цепи неароматические циклы Элементы химической структуры
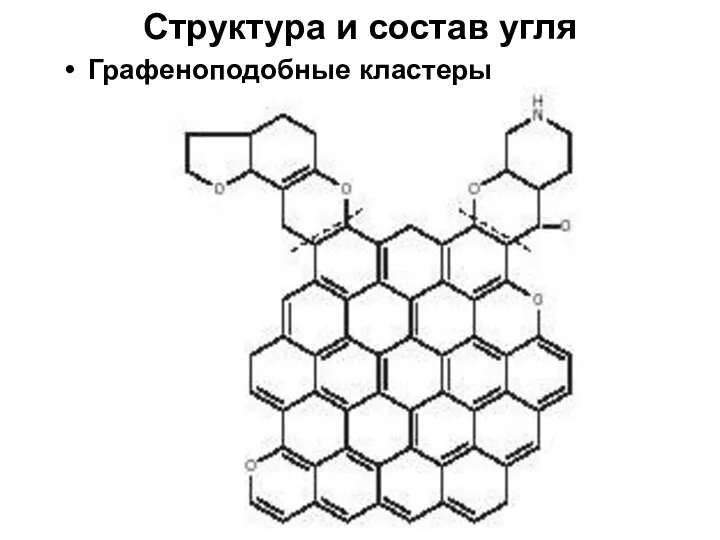
- 7. Структура и состав угля Графеноподобные кластеры
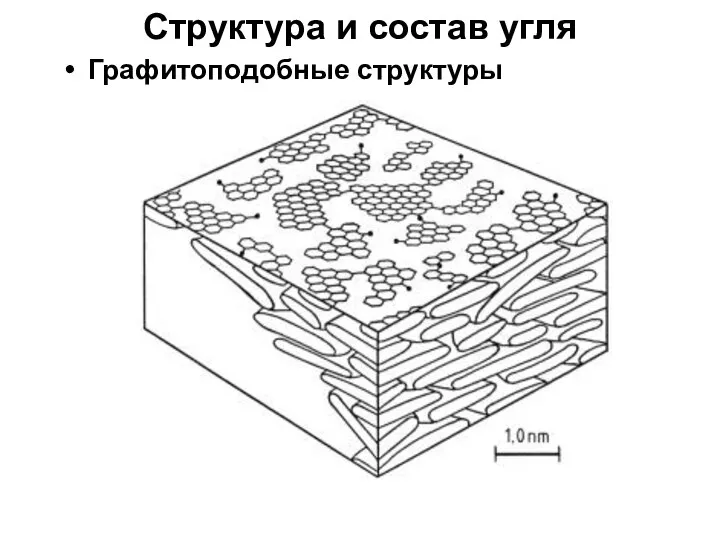
- 8. Структура и состав угля Графитоподобные структуры
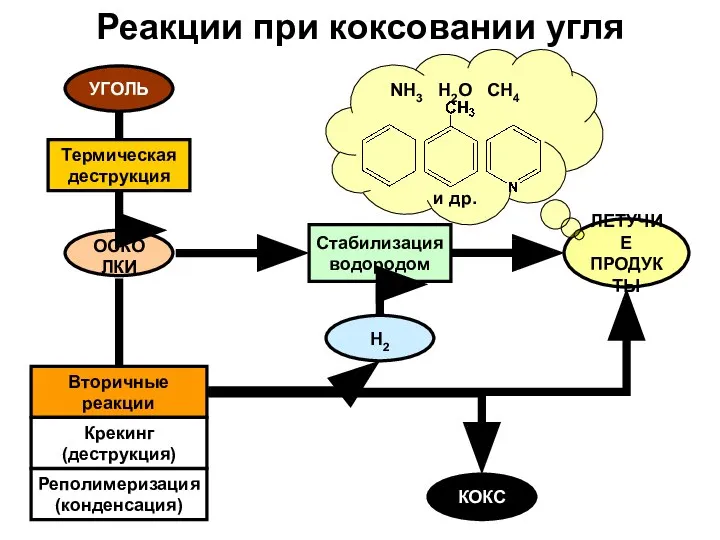
- 9. Реакции при коксовании угля УГОЛЬ Термическая деструкция ОСКОЛКИ Стабилизация водородом Вторичные реакции ЛЕТУЧИЕ ПРОДУКТЫ Крекинг (деструкция)
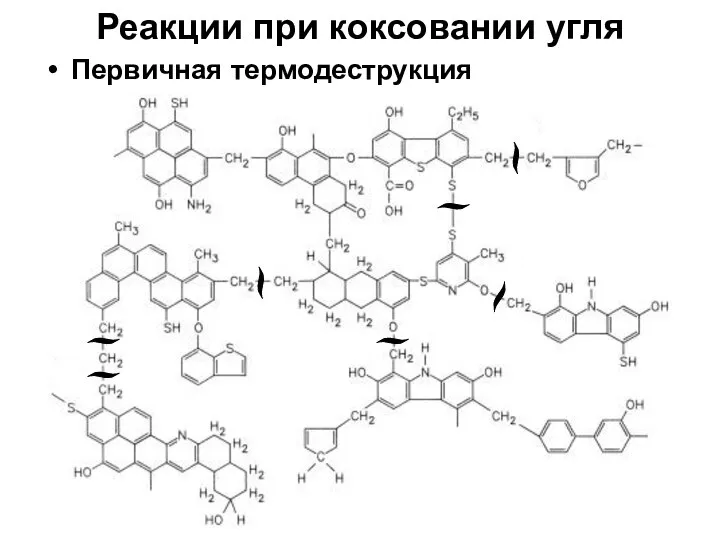
- 10. Реакции при коксовании угля Первичная термодеструкция
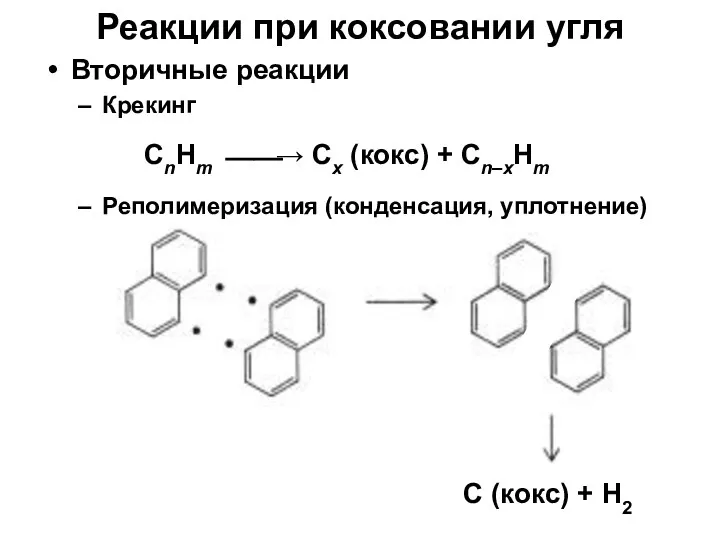
- 11. Вторичные реакции Крекинг Реполимеризация (конденсация, уплотнение) Реакции при коксовании угля CnHm ⎯⎯→ Cx (кокс) + Cn–xHm
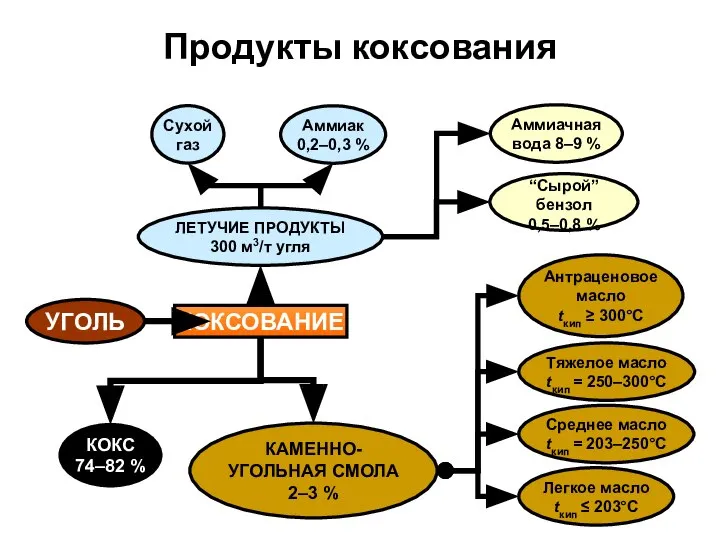
- 12. УГОЛЬ КОКСОВАНИЕ ЛЕТУЧИЕ ПРОДУКТЫ 300 м3/т угля Сухой газ Аммиак 0,2–0,3 % Аммиачная вода 8–9 %
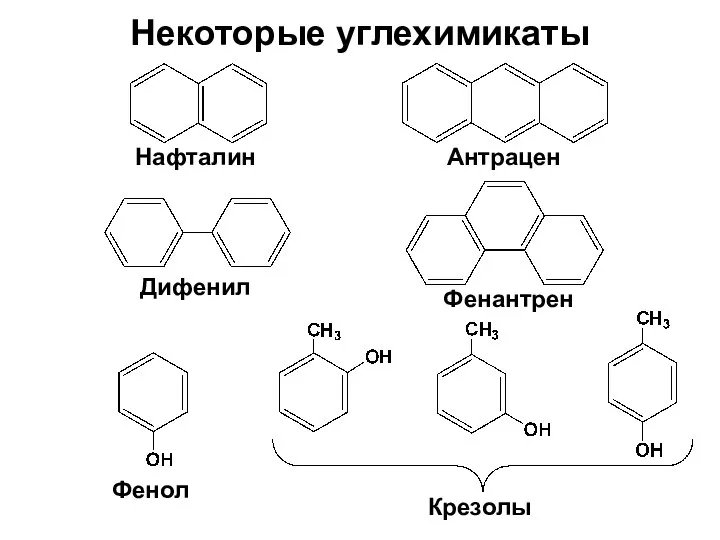
- 13. Некоторые углехимикаты Нафталин Антрацен Фенантрен Дифенил Фенол Крезолы
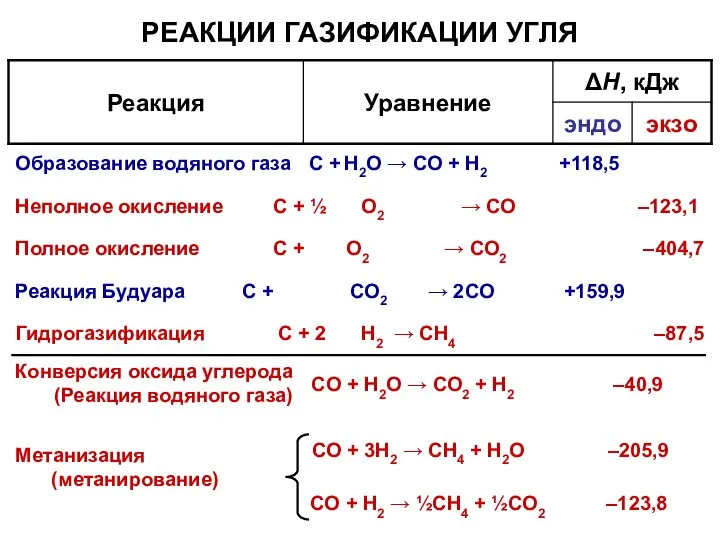
- 14. СO + 3Н2 → CH4 + Н2О –205,9 Метанизация (метанирование) РЕАКЦИИ ГАЗИФИКАЦИИ УГЛЯ СO + Н2
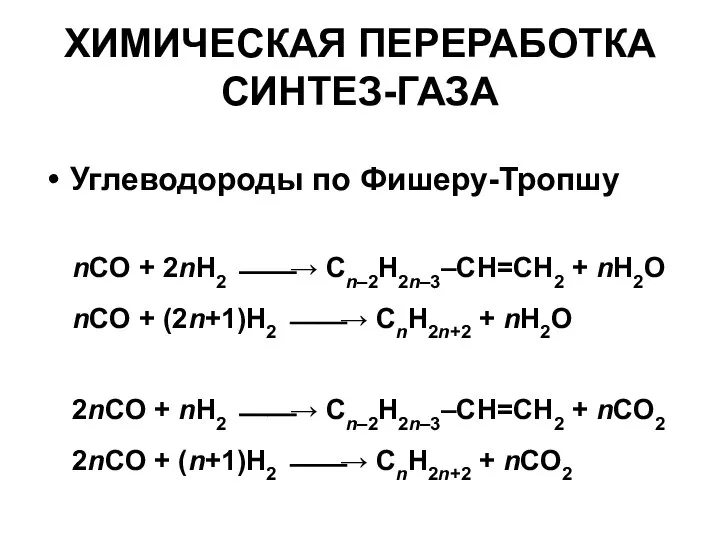
- 15. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА Углеводороды по Фишеру-Тропшу nCO + 2nH2 ⎯⎯→ Cn–2H2n–3–CH=CH2 + nH2O nCO + (2n+1)H2
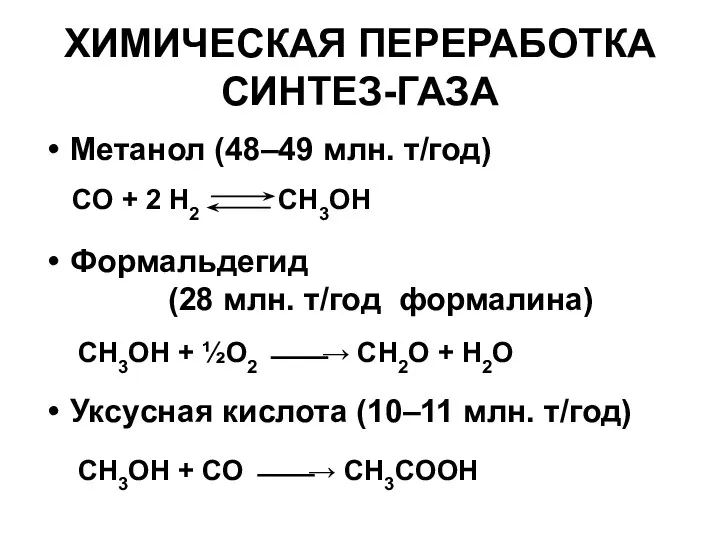
- 16. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА Метанол (48–49 млн. т/год) Формальдегид (28 млн. т/год формалина) Уксуcная кислота (10–11 млн.
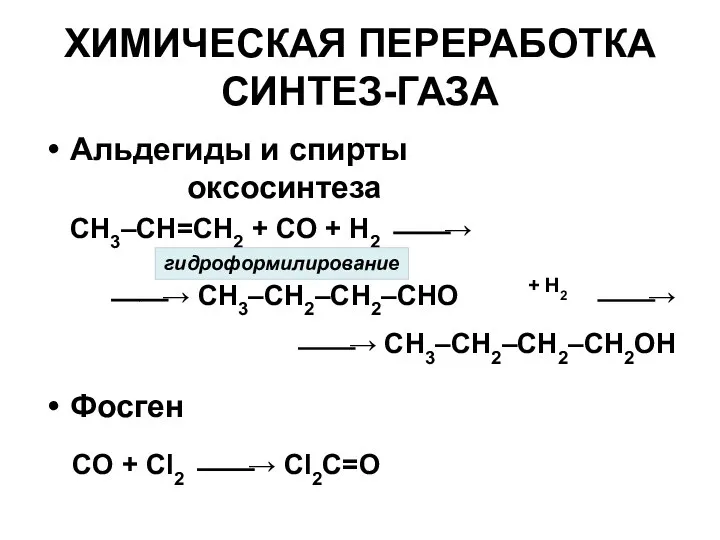
- 17. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА Альдегиды и спирты оксосинтеза Фосген CH3–CH=CH2 + CO + H2 ⎯⎯→ ⎯⎯→ CH3–CH2–CH2–CHO
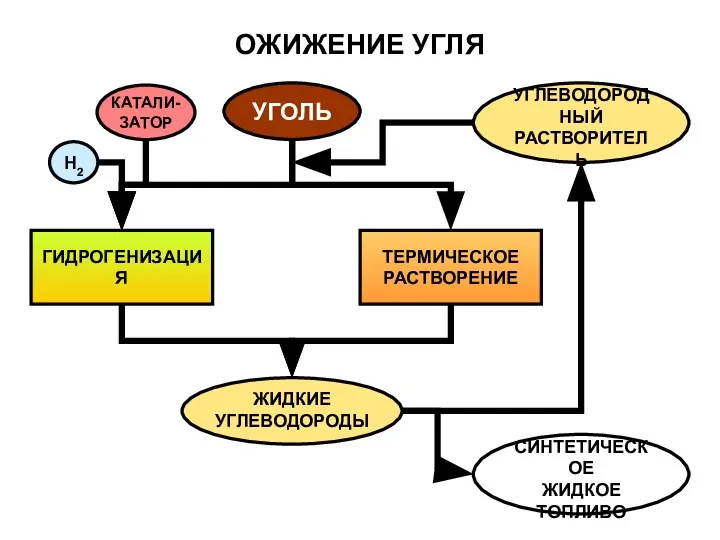
- 18. ОЖИЖЕНИЕ УГЛЯ УГОЛЬ ГИДРОГЕНИЗАЦИЯ ТЕРМИЧЕСКОЕ РАСТВОРЕНИЕ ЖИДКИЕ УГЛЕВОДОРОДЫ УГЛЕВОДОРОДНЫЙ РАСТВОРИТЕЛЬ СИНТЕТИЧЕСКОЕ ЖИДКОЕ ТОПЛИВО КАТАЛИ- ЗАТОР H2
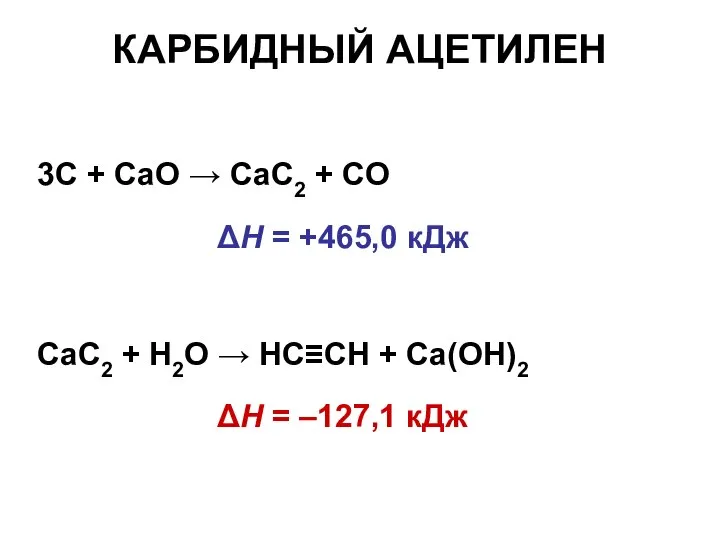
- 19. КАРБИДНЫЙ АЦЕТИЛЕН 3C + CaO → CaC2 + CO ΔН = +465,0 кДж CaC2 + H2O
- 21. Скачать презентацию

 Углерод. Физические свойства
Углерод. Физические свойства Сложные вещества кислоты
Сложные вещества кислоты Неоднородные системы (процессы и аппараты химической технологии, 8 лекция)
Неоднородные системы (процессы и аппараты химической технологии, 8 лекция) Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Кислород
Кислород Агрохимия растений
Агрохимия растений Презентация по Химии "Аммиак" - скачать смотреть
Презентация по Химии "Аммиак" - скачать смотреть  Серная кислота. Строение и свойства
Серная кислота. Строение и свойства Основные классы неорганических веществ
Основные классы неорганических веществ Кислоты: названия, получение, свойства, применение
Кислоты: названия, получение, свойства, применение Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Ғажайып химия
Ғажайып химия Исследование состава и свойств минеральной воды Авторы:
Исследование состава и свойств минеральной воды Авторы:  Нарушения водно-электролитного и кислотно-основного обмена
Нарушения водно-электролитного и кислотно-основного обмена Каучук и резина (10 класс)
Каучук и резина (10 класс) Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Гидрозольные препараты для экспрессной бесприборной диагностики лейкоза КРС
Гидрозольные препараты для экспрессной бесприборной диагностики лейкоза КРС Хром. Соединения хрома
Хром. Соединения хрома Iodine. Physical properties. Application of iodine
Iodine. Physical properties. Application of iodine Чистые вещества и смеси. Способы разделения смесей. 8 класс
Чистые вещества и смеси. Способы разделения смесей. 8 класс Теории кислот и оснований. Классификация реакций и реагентов
Теории кислот и оснований. Классификация реакций и реагентов ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ  Пиридин. Методы получения пиридина. Химические свойства. Биологически активные производные. (Леекция 5)
Пиридин. Методы получения пиридина. Химические свойства. Биологически активные производные. (Леекция 5) Литий. Физические и химические свойства
Литий. Физические и химические свойства Типы и механизмы органических реакций
Типы и механизмы органических реакций Щелочноземельные металлы
Щелочноземельные металлы Окислительно-восстановительные реакции в растворах
Окислительно-восстановительные реакции в растворах