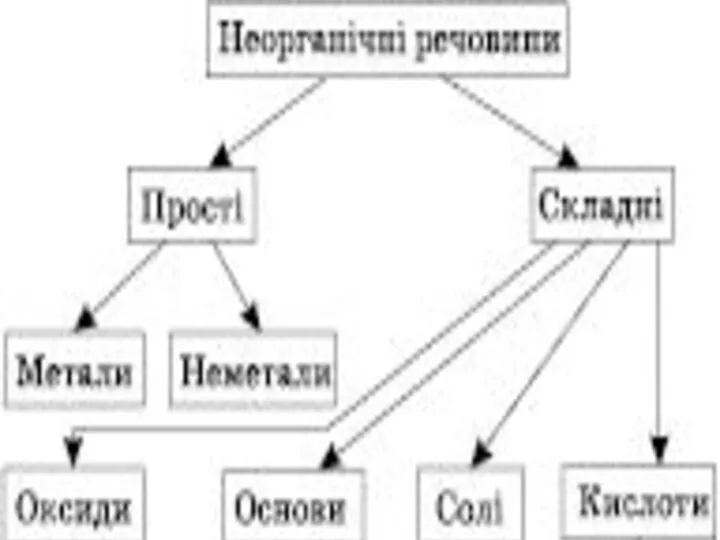
Содержание
- 2. План Оксиди. 2. Основи. 3. Кислоти. 4. Солі.
- 4. Солетворні Основні (CaO, FeO) Кислотні (CO2, P2O5) Амфотерні (ZnO, Al2O3) Несолетворні (SiO2, CO, N2O) Класифікація оксидів
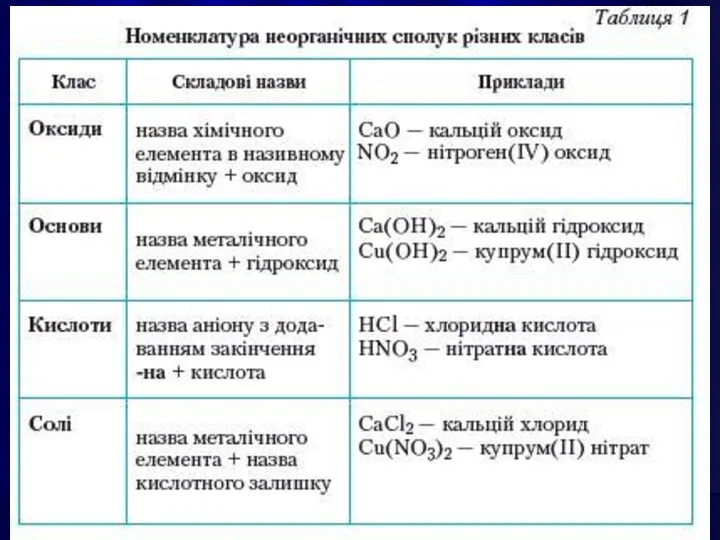
- 5. Окси́д — бінарна сполука, до складу якої входить Оксиген. Майже всі елементи утворюють оксиди. Їх загальні
- 6. Назва оксидів складається зі слова «оксид» з додаванням спочатку назви елемента, що входить до складу речовини,
- 8. ОСНОВНИМИ_ОКСИДАМИ називають оксиди металів, гідрати яких є основами. Наприклад: Lі2O, Nа2O, К2O, Rb2O, CS2O, MgO, CaO,
- 9. КИСЛОТНИМИ_ОКСИДАМИ називають оксиди, гідрати яких є кислотами. Наприклад: Ва2О3, СО2, М2О5, Р2О5, С12О7, СrО3, V2O5, МnО3,
- 10. АМФОТЕРНИМИ_ОКСИДАМИ називають оксиди, гідрати яких є амфотерними гідроксидами. Наприклад: А12О3, Сг2О3, ВеО, ZnО, SnО, Sn02, РbО,
- 11. Методи одержання оксидів Безпосереднім сполученням елементів з киснем: 2Zn + O2 = 2ZnO 4Р + 5О2
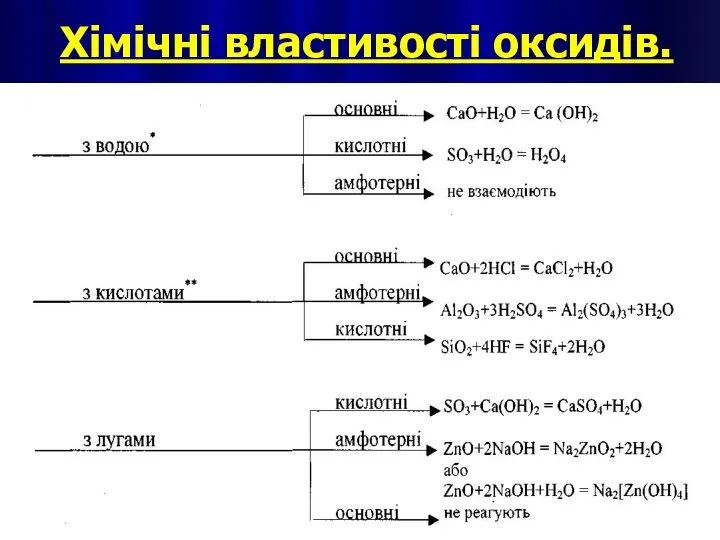
- 12. Хімічні властивості оксидів.
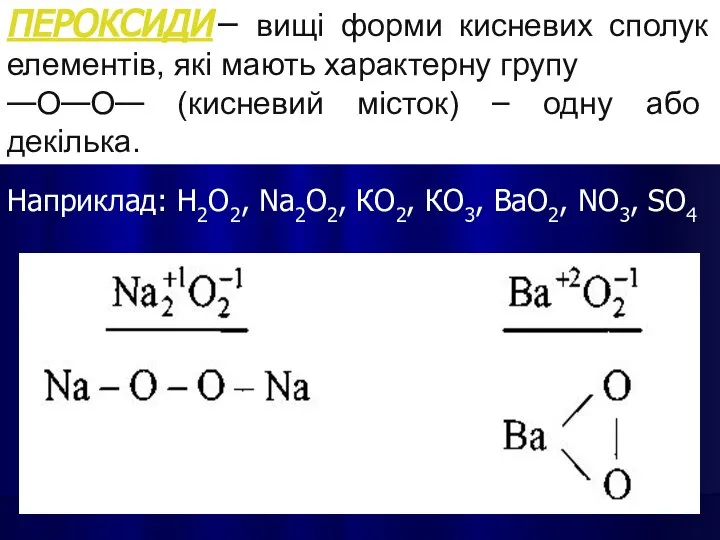
- 13. ПЕРОКСИДИ – вищі форми кисневих сполук елементів, які мають характерну групу —О—О— (кисневий місток) – одну
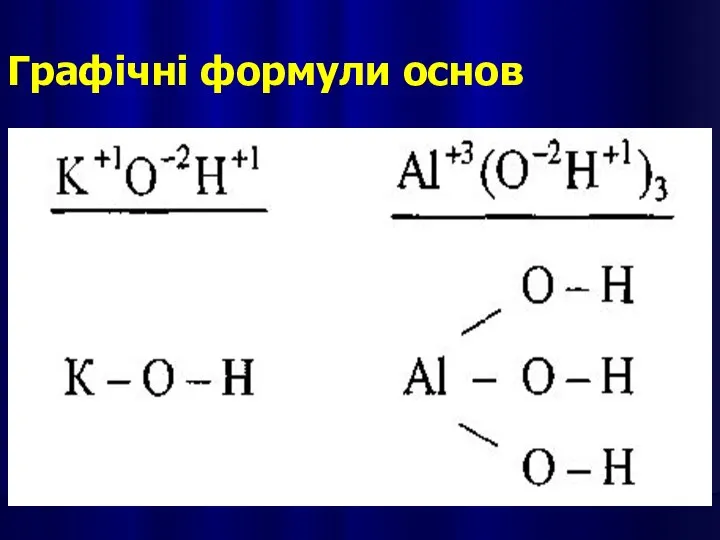
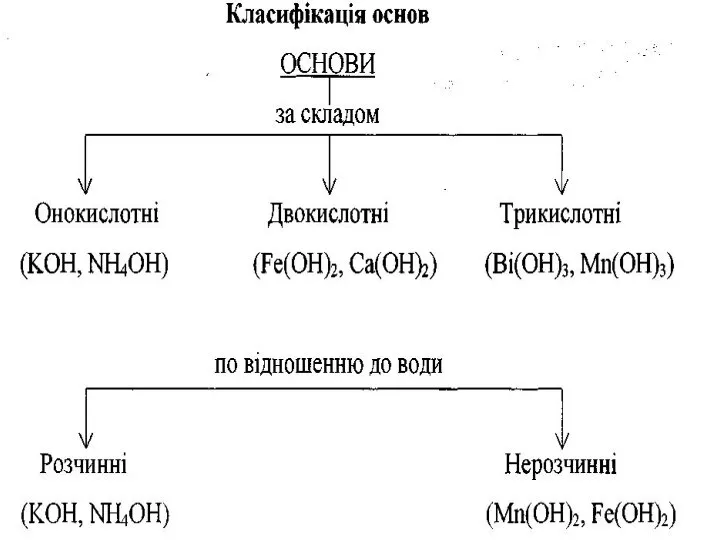
- 14. ОСНОВАМИ є сполуки основних оксидів з водою, які мають гідроксильні групи —ОН. Назви основ: після слова
- 15. Наприклад:
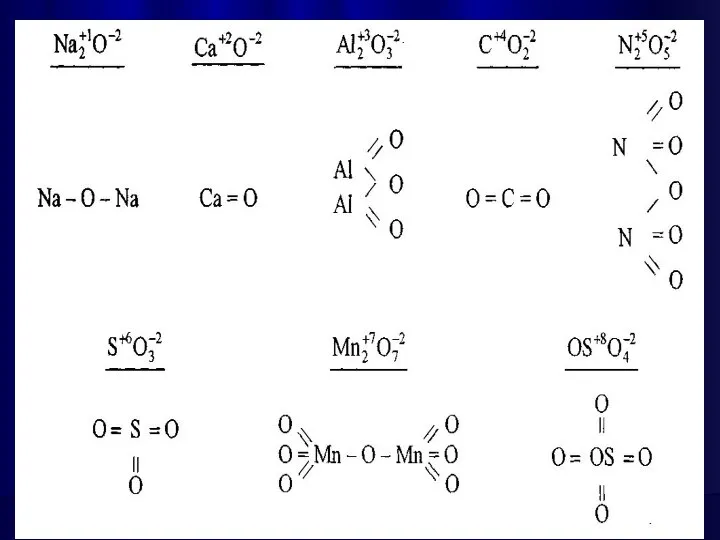
- 16. Графічні формули основ
- 18. Основи можна добути різними способами. Безпосереднім сполученням основних оксидів з водою. Na2O + H2O = 2NaOH
- 19. Хімічні властивості основ 1. Взаємодія основ з кислотними оксидами. 1. Взаємодія основ з кислотними оксидами. 2.
- 20. 3. Взаємодія лугів з амфотерними оксидами. 4. Взаємодія лугів з амфотерними гідроксидами. 5. Взаємодія лугів з
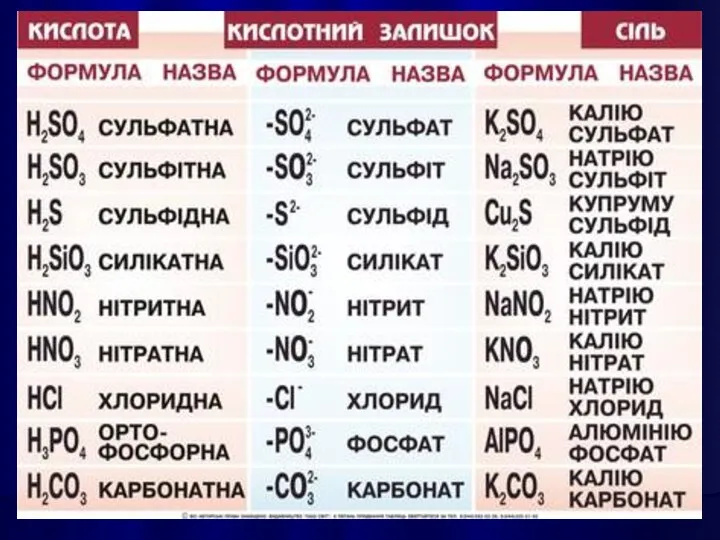
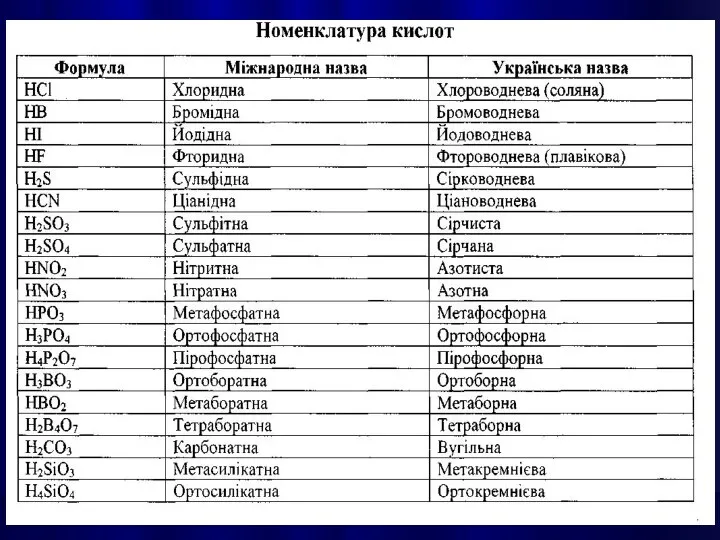
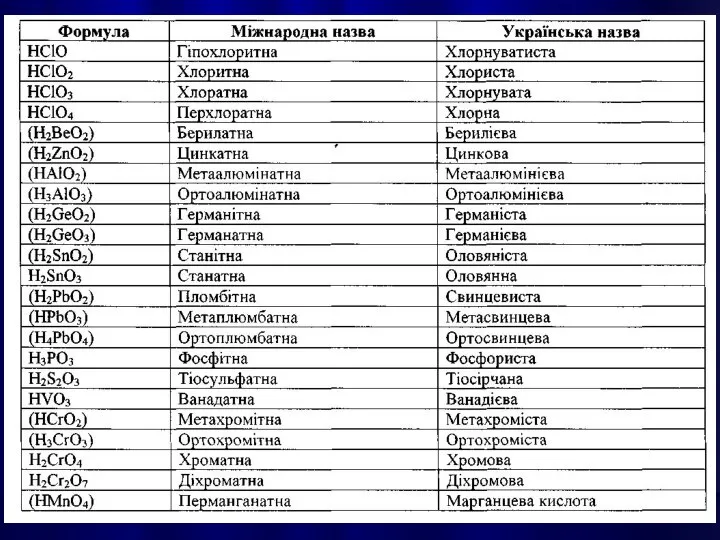
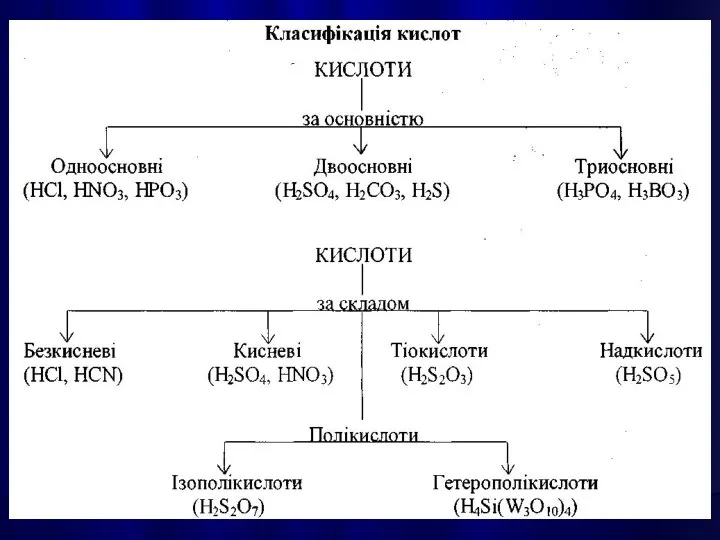
- 21. КИСЛОТАМИ називають сполуки, які містять атоми Гідрогену, здатні заміщуватися на метал з утворенням солей.
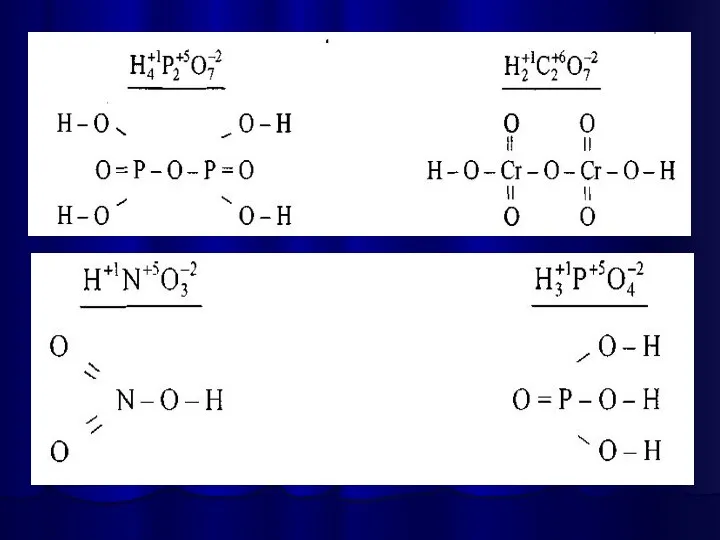
- 25. Написання графічної формули кислоти починають з кислотоутворюючого елементу, потім справа від нього пишуть стільки груп —ОН,
- 28. Кислоти можна добувати різними способами. Безпосереднім сполученням ангідридів з водою: SO3 + Н2О = Н2SO4 N2O5
- 29. 3. Безкисневі кислоти можна одержувати як їх витісненням з солей іншими кислотами, так і безпосереднім сполученням
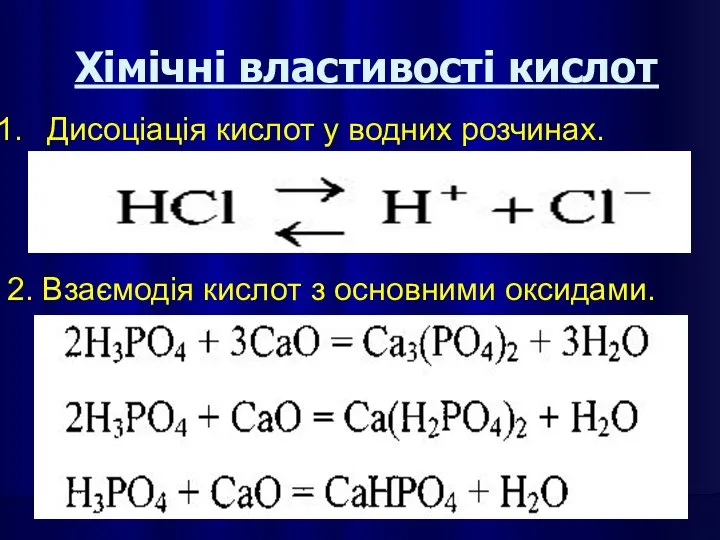
- 30. Хімічні властивості кислот Дисоціація кислот у водних розчинах. 2. Взаємодія кислот з основними оксидами.
- 31. 3. Взаємодія кислот з основами (реакція нейтралізації). 4. Взаємодія кислот з амфотерними оксидами та гідроксидами.
- 32. 5. Взаємодія кислот з солями 6. Взаємодія кислот з металами.
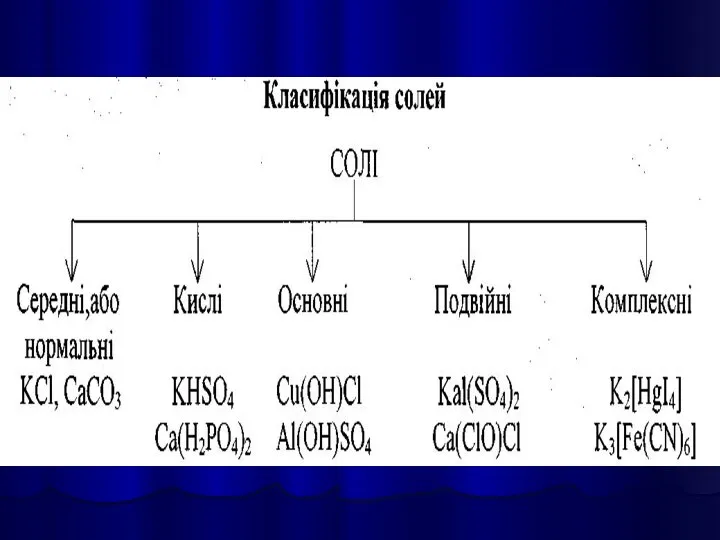
- 33. СОЛЯМИ є кристалічні речовини, які можна рахувати продуктами повного або часткового зміщення атомів Гідрогену в молекулах
- 35. Середні солі можна розглядати як продукти повного заміщення атомів Гідрогену в молекулі кислоти на метал, або
- 37. Солі утворюються: 1. При взаємодії кислот з основами (реакції нейтралізації): 2HNO3 + Ba(OH)2 = Ba(NO3)2 +
- 38. 4. При взаємодії кислот з солями: 3H2SO4 + Ca3(PO4)2 = 2H3PO4 + 3CaSO4 ↓ 5. При
- 39. 8. При взаємодії основних оксидів з кислотними: CaO + CO2 = CaCO3 9. При взаємодії солей:
- 40. Хімічні властивості солей 1. Дисоціація солей у водних розчинах. 2. Гідроліз солей – взаємодія солі з
- 41. 3. Взаємодія солей з лугами (розчинними основами): 4. Взаємодія солей з кислотами: 5. Взаємодія між солями.
- 44. Скачать презентацию



























 Пищевые добавки
Пищевые добавки Дисахариды и полисахариды
Дисахариды и полисахариды Презентация по Химии "Устранение дефектов при росте кристалла медного купороса" - скачать смотреть
Презентация по Химии "Устранение дефектов при росте кристалла медного купороса" - скачать смотреть  Токсины в быту. Классификация товаров бытовой химии
Токсины в быту. Классификация товаров бытовой химии Атом. Будова атома
Атом. Будова атома Базальты. Классификация основных пород
Базальты. Классификация основных пород Каталитикалық крекинг
Каталитикалық крекинг Презентация по химии Органические вещества
Презентация по химии Органические вещества  Общая и неорганическая химия
Общая и неорганическая химия Нуклеин қышқылдары. ДНҚ репликациясы
Нуклеин қышқылдары. ДНҚ репликациясы Кислородсодержащие органические соединения. Сложные эфиры
Кислородсодержащие органические соединения. Сложные эфиры Методика решения части С2 ГИА 9 класс
Методика решения части С2 ГИА 9 класс Электролиз расплавов и растворов
Электролиз расплавов и растворов Химические свойства строительных материалов. Урок №5
Химические свойства строительных материалов. Урок №5 Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Углерод
Углерод ИК-спектроскопия органических соединений
ИК-спектроскопия органических соединений Сложные вещества Выполнил ученик 8 класса КГООУ «Железногорская санаторно-лесная школа» Москальчук Павел Учитель химии и биол
Сложные вещества Выполнил ученик 8 класса КГООУ «Железногорская санаторно-лесная школа» Москальчук Павел Учитель химии и биол Презентация Химия в быту
Презентация Химия в быту  Основные классы органических соединений: циклические соединения
Основные классы органических соединений: циклические соединения Кислоты – кислотные гидроксиды
Кислоты – кислотные гидроксиды Кыргызстандагы химия онор жайы
Кыргызстандагы химия онор жайы Качественный анализ молока
Качественный анализ молока Горные породы
Горные породы Стадии и общая схема почвообразования
Стадии и общая схема почвообразования Комплексные соединения. (Лекция 7)
Комплексные соединения. (Лекция 7) Вступ в гетерогенний катализ. Загальні положення каталізу
Вступ в гетерогенний катализ. Загальні положення каталізу Ферменттер. Ферменттердің құрылымы. Биохимиялық маңызы
Ферменттер. Ферменттердің құрылымы. Биохимиялық маңызы