Содержание
- 2. Общая характеристика и основные понятия Комплексные соединения имеют сложный состав и могут быть образованы из простых
- 3. Общая характеристика и основные понятия Альфред Вернер (1866 — 1919) Нобелевская премия по химии 1913 г
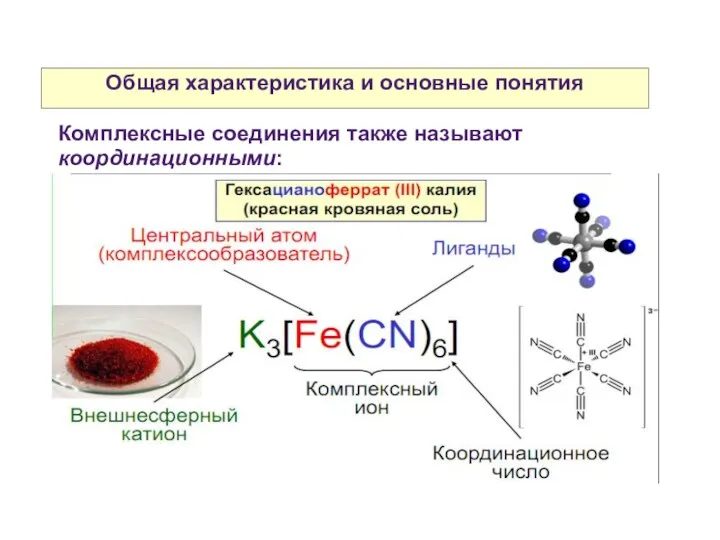
- 4. Общая характеристика и основные понятия Комплексные соединения также называют координационными:
- 5. Общая характеристика и основные понятия Комплексообразователи: почти все элементы ПСХЭ. Наиболее распространенные: ионы переходных металлов: Cu2+,
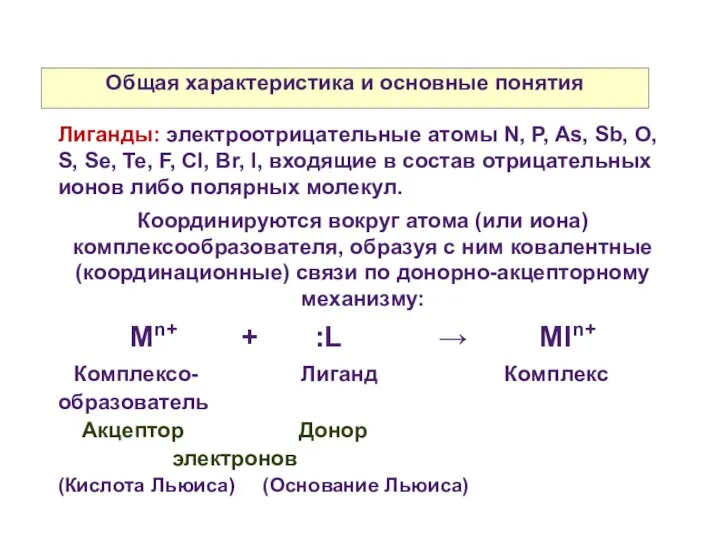
- 6. Общая характеристика и основные понятия Лиганды: электроотрицательные атомы N, P, As, Sb, O, S, Se, Te,
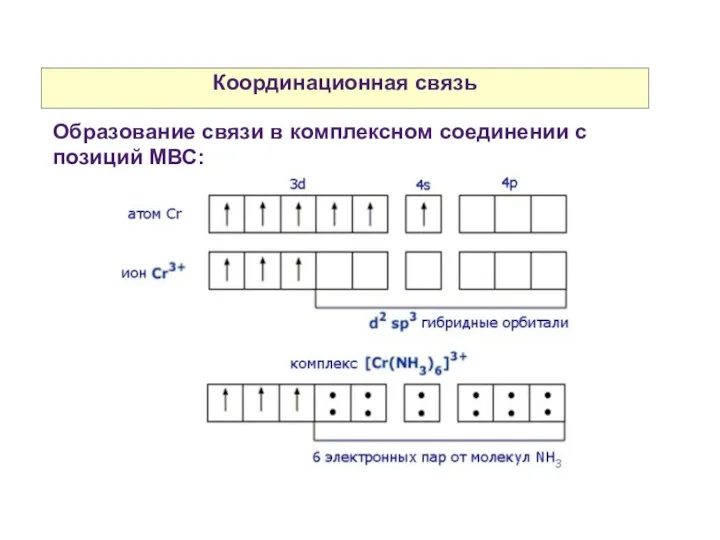
- 7. Координационная связь Образование связи в комплексном соединении с позиций МВС:
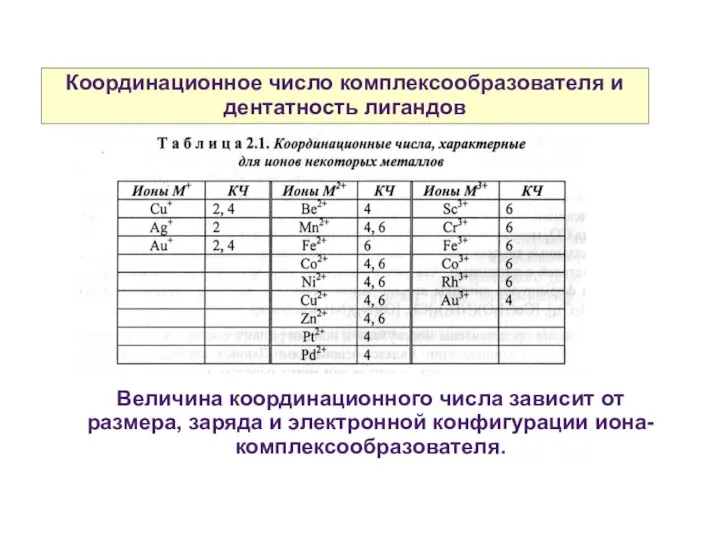
- 8. Координационное число комплексообразователя и дентатность лигандов Координационное число комплексообразователя — это число свободных орбиталей, предоставляемых для
- 9. Координационное число комплексообразователя и дентатность лигандов Величина координационного числа зависит от размера, заряда и электронной конфигурации
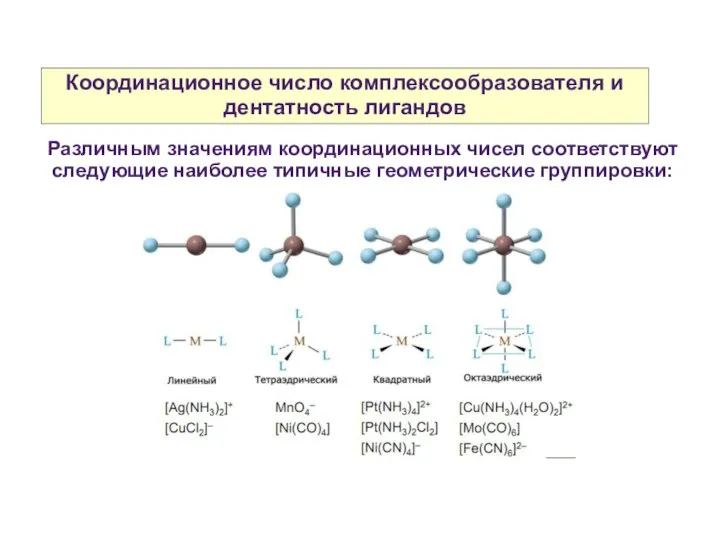
- 10. Координационное число комплексообразователя и дентатность лигандов Различным значениям координационных чисел соответствуют следующие наиболее типичные геометрические группировки:
- 11. Координационное число комплексообразователя и дентатность лигандов Зависимость значений координационных чисел от отношения размеров комплексообразователя и лигандов
- 12. Координационное число комплексообразователя и дентатность лигандов Наиболее распространенные монодентатные лиганды: H2O, OH-, CO32-, SO42-, SCN-, S2-,
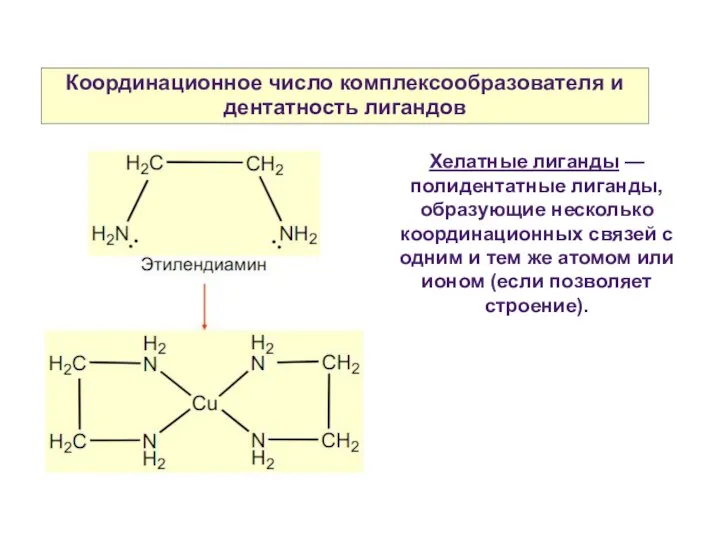
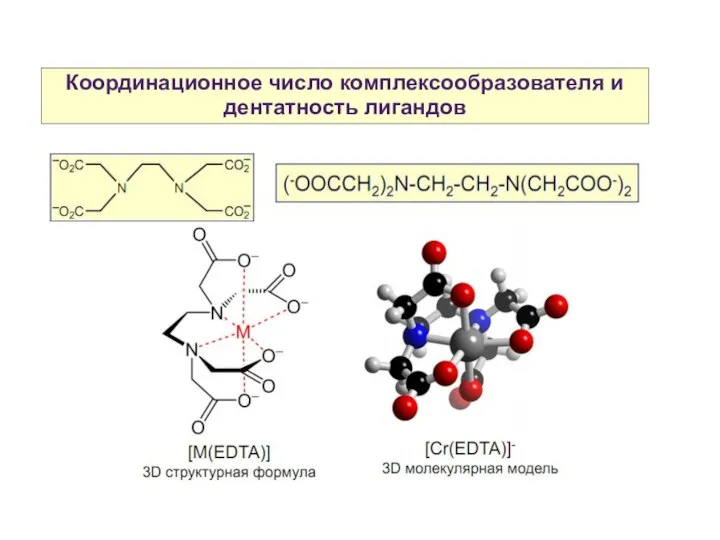
- 13. Координационное число комплексообразователя и дентатность лигандов Хелатные лиганды — полидентатные лиганды, образующие несколько координационных связей с
- 14. Координационное число комплексообразователя и дентатность лигандов
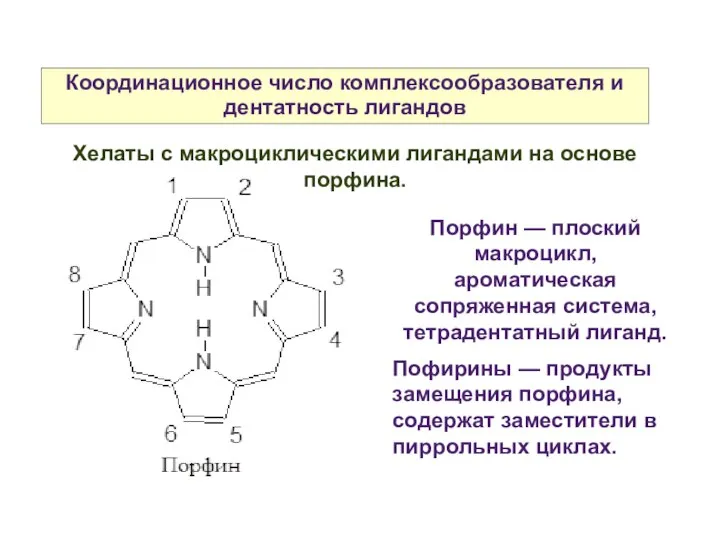
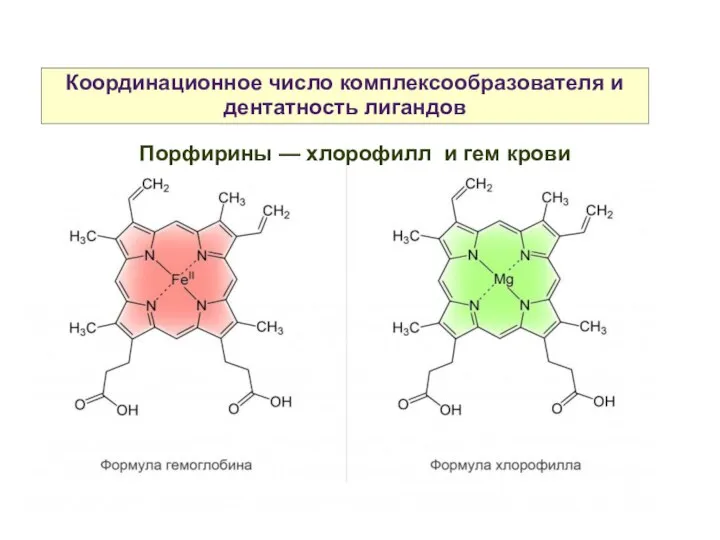
- 15. Координационное число комплексообразователя и дентатность лигандов Порфин — плоский макроцикл, ароматическая сопряженная система, тетрадентатный лиганд. Пофирины
- 16. Координационное число комплексообразователя и дентатность лигандов Порфирины — хлорофилл и гем крови
- 17. Координационное число комплексообразователя и дентатность лигандов Амбидентатные лиганды — присоединяются к комплексообразователю разными способами. NCS- :
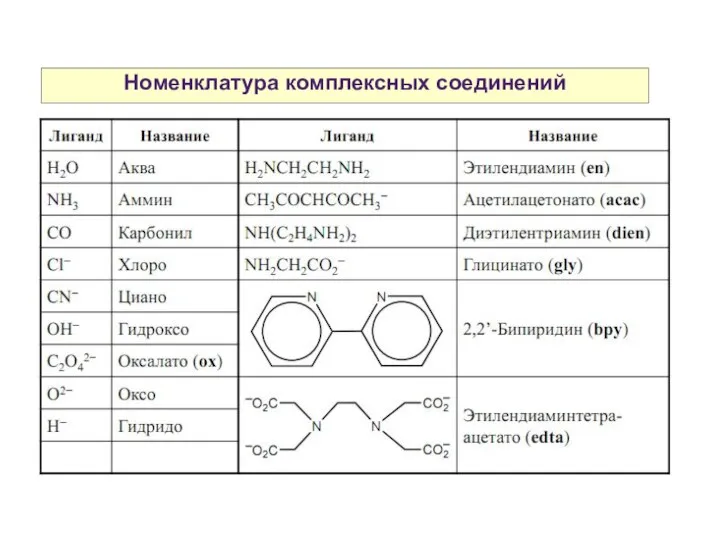
- 18. Номенклатура комплексных соединений
- 19. Номенклатура комплексных соединений K4[Fe(CN)6] — гексацианоферрат (II) калия Na2[ZnCl4] — тетрахлороцинкат натрия K3[Fe(SCN)5NO] —пентатиоционатонитрозилферрат (II) калия
- 20. Устойчивость комплексных соединений в водных растворах Комплексные соединения с заряженной координационной сферой — сильные электролиты: K4[Fe(CN)6]
- 21. Устойчивость комплексных соединений в водных растворах Каждая ступень диссоциации может быть охарактеризована константой диссоциации, которая в
- 22. Устойчивость комплексных соединений в водных растворах Образование комплекса тоже ступенчатый процесс: 1) Cu2+(р-р) + NH3(р-р) ↔
- 23. Изомерия комплексных соединений Изомеры — соединения, одинаковые по составу и массе, но разные по строению. 1)
- 24. Изомерия комплексных соединений 2) Ионизационная изомерия — характерна только для катионных (!) комплексов. Обусловлена различным распределением
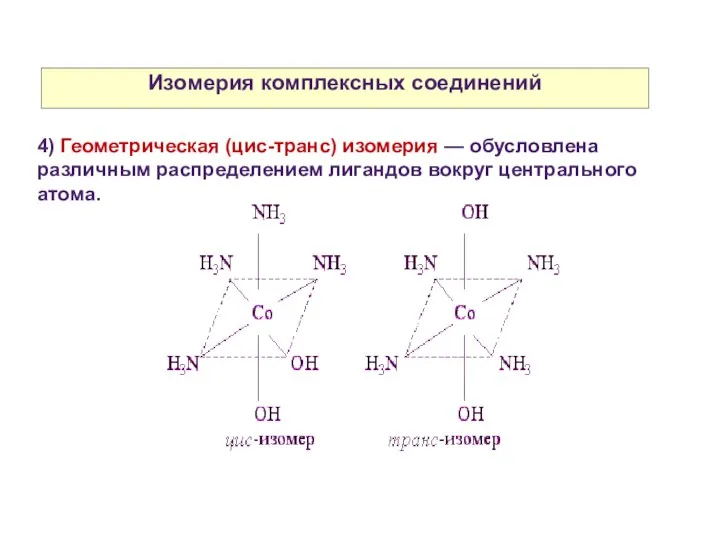
- 25. Изомерия комплексных соединений 4) Геометрическая (цис-транс) изомерия — обусловлена различным распределением лигандов вокруг центрального атома.
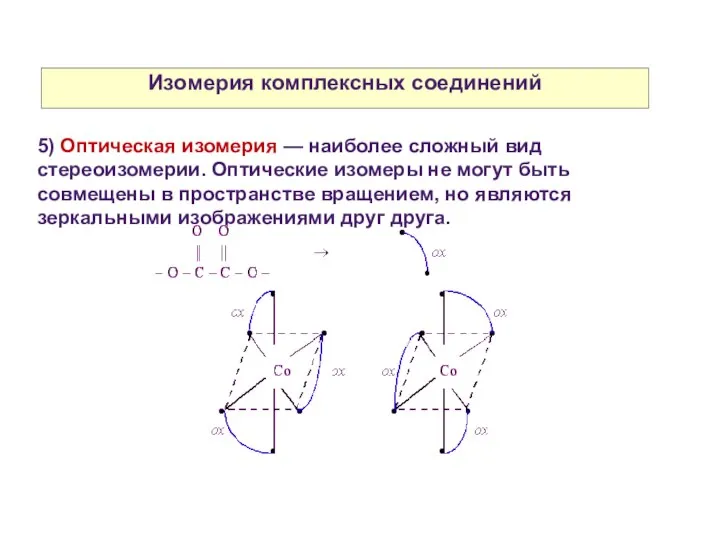
- 26. Изомерия комплексных соединений 5) Оптическая изомерия — наиболее сложный вид стереоизомерии. Оптические изомеры не могут быть
- 27. Химическая связь в комплексных соединениях Может быть описана с позиций трех методов: - метода валентных связей
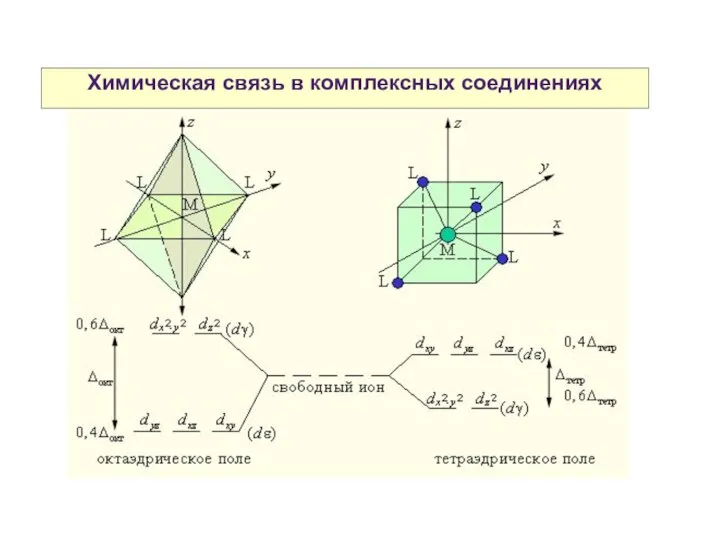
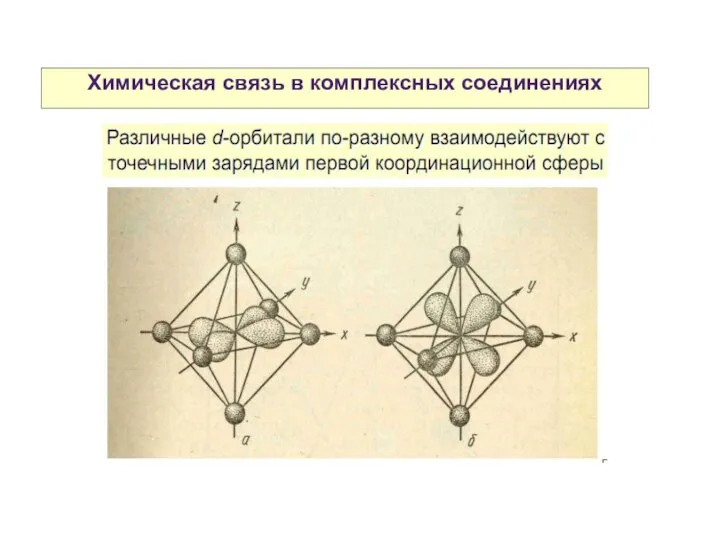
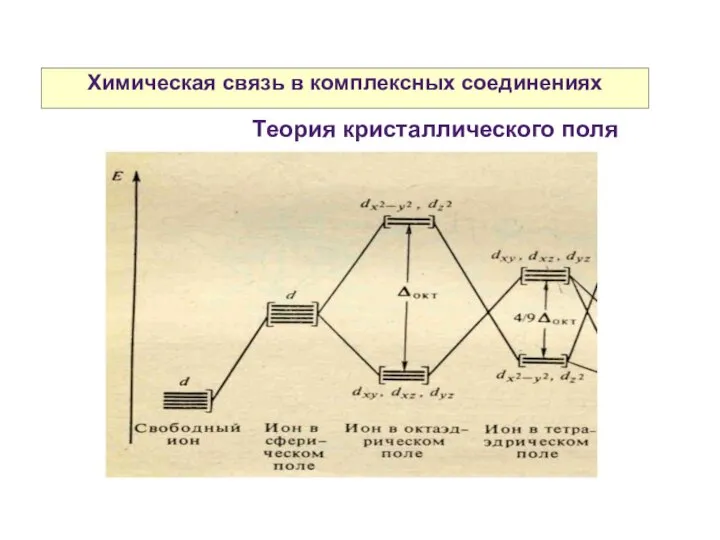
- 28. Химическая связь в комплексных соединениях Теория кристаллического поля
- 29. Химическая связь в комплексных соединениях
- 30. Химическая связь в комплексных соединениях
- 31. Химическая связь в комплексных соединениях Теория кристаллического поля
- 32. Химическая связь в комплексных соединениях Разность энергий между dε и dγ- уровнями называется параметром расщепления и
- 35. Скачать презентацию







![Номенклатура комплексных соединений K4[Fe(CN)6] — гексацианоферрат (II) калия Na2[ZnCl4] — тетрахлороцинкат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1403418/slide-18.jpg)








 Исследовательская работа: «Выращивание кристаллов в домашних условиях»
Исследовательская работа: «Выращивание кристаллов в домашних условиях» Микроскопическая симметрия. Пространственные решетки. Решетки Бравэ
Микроскопическая симметрия. Пространственные решетки. Решетки Бравэ Неорганическая химия Сероводород
Неорганическая химия Сероводород  Метаморфогенная серия. Группа регионального метаморфизма
Метаморфогенная серия. Группа регионального метаморфизма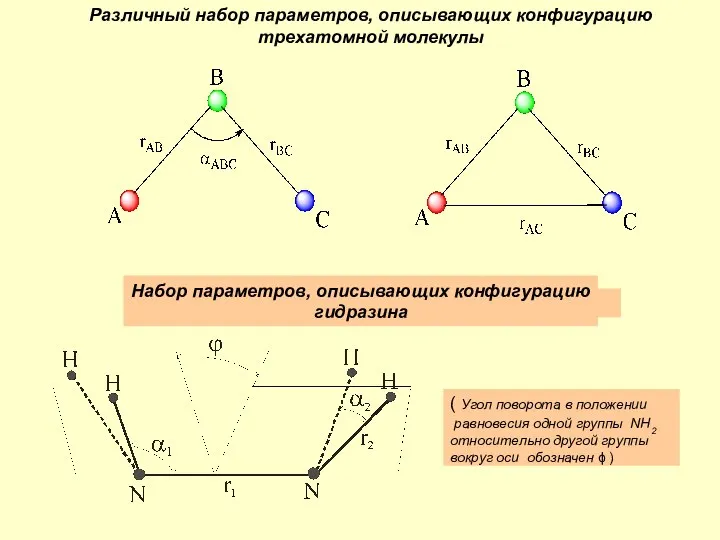 Различный набор параметров, описывающих конфигурацию трехатомной молекулы
Различный набор параметров, описывающих конфигурацию трехатомной молекулы Презентация по Химии "Основные классы Неорганических соединений" - скачать смотреть
Презентация по Химии "Основные классы Неорганических соединений" - скачать смотреть  Композиты на основе полибензоксазинов
Композиты на основе полибензоксазинов Перегонка с водяным паром
Перегонка с водяным паром Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные
Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные Физико-химические и электро-физические свойства А3В5. Сравнительный анализ
Физико-химические и электро-физические свойства А3В5. Сравнительный анализ 9 класс Урок №7. Сложные эфиры. Жиры. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №7. Сложные эфиры. Жиры. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Химические свойства кислорода. Применение кислорода
Химические свойства кислорода. Применение кислорода Пластмаса
Пластмаса  Магний. Электронное строение атома Mg
Магний. Электронное строение атома Mg Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан
Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан Презентация Химический алфавит
Презентация Химический алфавит  Производство полимеров
Производство полимеров Отрицательное влияние азотных минеральных удобрений на почву
Отрицательное влияние азотных минеральных удобрений на почву «Історія розвитку хімічних знань»
«Історія розвитку хімічних знань»  Алканы: состав, строение, изомерия, номенклатура, получение. МОУ «СОШ» пгт.Кожва Республика Коми, Печорский район Савчук Оксана В
Алканы: состав, строение, изомерия, номенклатура, получение. МОУ «СОШ» пгт.Кожва Республика Коми, Печорский район Савчук Оксана В Дефекты упорядочивающихся сплавов
Дефекты упорядочивающихся сплавов Тема: «Алкины»
Тема: «Алкины» Кристаллические решётки и их виды (11 класс)
Кристаллические решётки и их виды (11 класс) Углеводороды нефти и газа. Тема 1. Алканы нефти и газа
Углеводороды нефти и газа. Тема 1. Алканы нефти и газа Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Неметаллы Подготовила Кулешова Ксения Ученица 10-А класса
Неметаллы Подготовила Кулешова Ксения Ученица 10-А класса  Выращивание кристаллов неорганических веществ Проект Кийко Елизаветы ученицы 3 Б класса МОУ «Гимназия №17 г.
Выращивание кристаллов неорганических веществ Проект Кийко Елизаветы ученицы 3 Б класса МОУ «Гимназия №17 г. Тест Проверь себя
Тест Проверь себя