Содержание
- 2. 8. Коррозия металлов ( Ме - один из основных конструкционных материалов) Самопроизвольный физико-химический процесс взаимодействия материалов
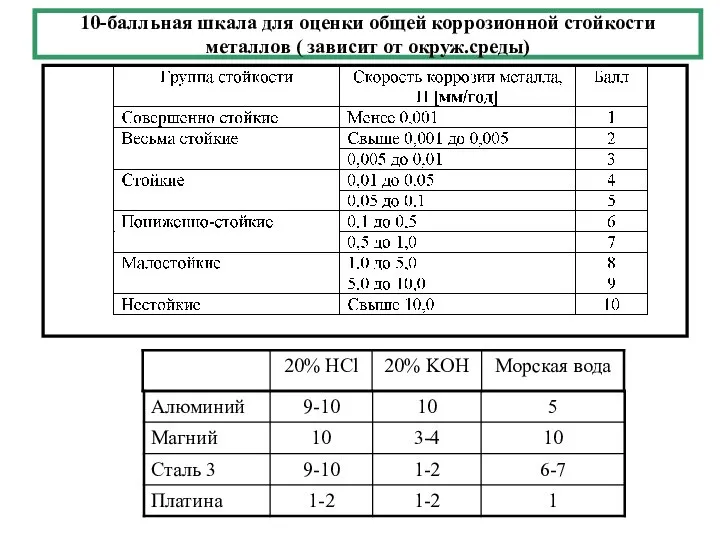
- 3. 10-балльная шкала для оценки общей коррозионной стойкости металлов ( зависит от окруж.среды)
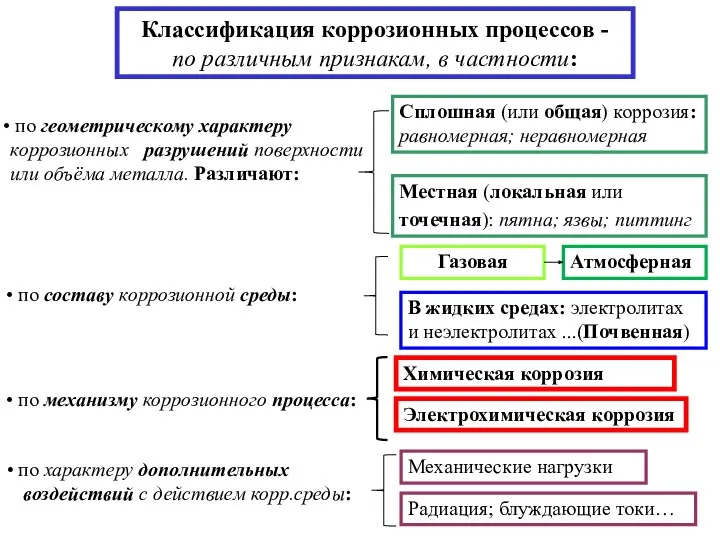
- 4. Классификация коррозионных процессов - по различным признакам, в частности:
- 5. 8.1 Химическая коррозия Гетерогенная окислительно-восстановительная реакция (между Ме и окислителем окруж.среды). Окисление металла и восстановление окислителя
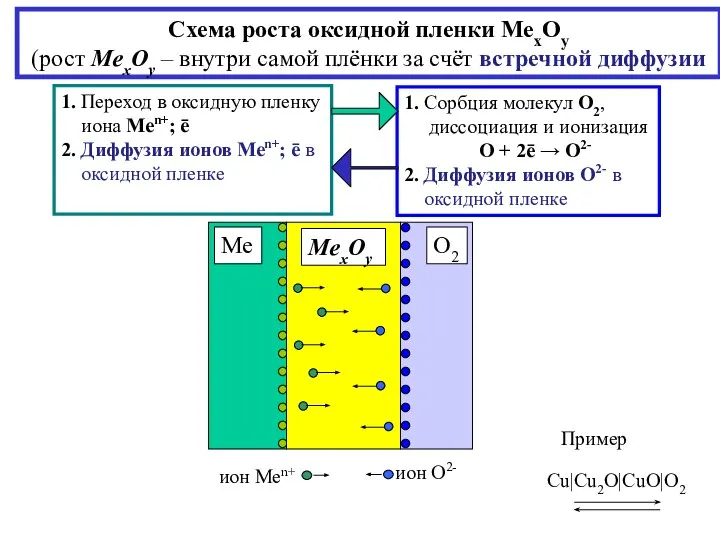
- 6. Схема роста оксидной пленки МеxOy (рост МеxOy – внутри самой плёнки за счёт встречной диффузии 1.
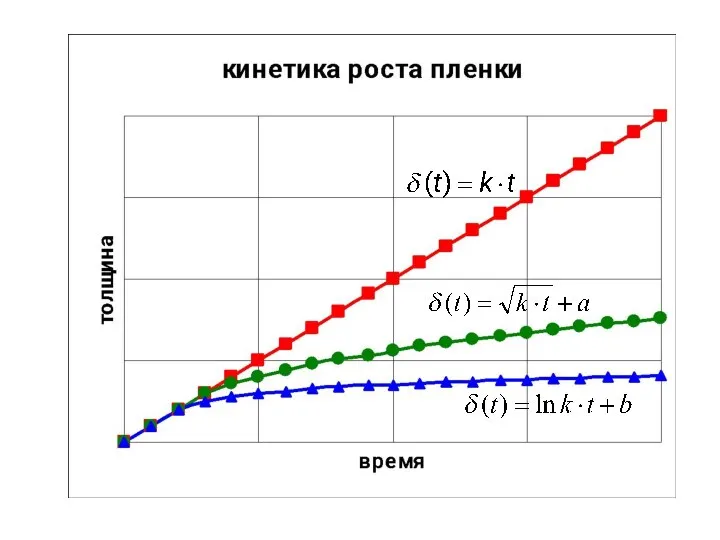
- 7. Кинетика роста оксидных пленок (определяется свойствами оксидной пленки и температурой) Уравн.роста оксидной пленки для газ. коррозии:
- 8. Кинетика роста оксидных пленок 2. Лимитирующая стадия диффузия (наличие сплошной оксидной плёнки). Скорость коррозии (роста пленки)
- 10. Факторы, влияющие на скорость газовой коррозии (определяется св-вами оксидной пленки) 1. Защитные свойства пленок – определяет
- 11. 8.2 Водородная коррозия (охрупчивание) Уменьшение пластичности металла (охрупчивание) в газовой среде содержащий водород (Н2) из-за растворения
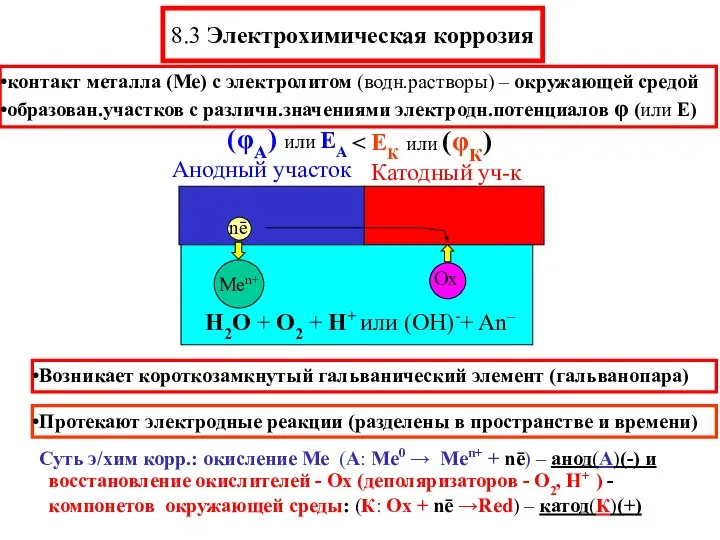
- 12. 8.3 Электрохимическая коррозия контакт металла (Ме) с электролитом (водн.растворы) – окружающей средой образован.участков с различн.значениями электродн.потенциалов
- 13. Электродные реакции эл.хим.коррозии анодные – окисление Ме (А: Me0 → Men+ + nē); катодные – восстановл.
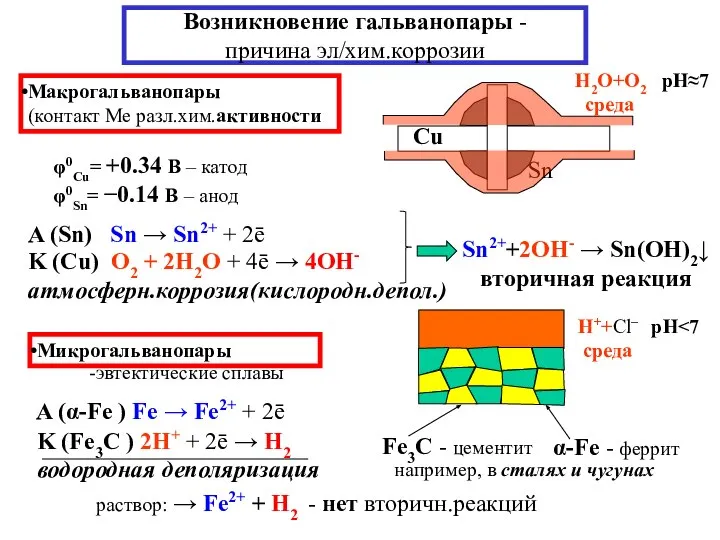
- 14. Возникновение гальванопары - причина эл/хим.коррозии Макрогальванопары (контакт Ме разл.хим.активности φ0Cu= +0.34 В – катод φ0Sn= −0.14
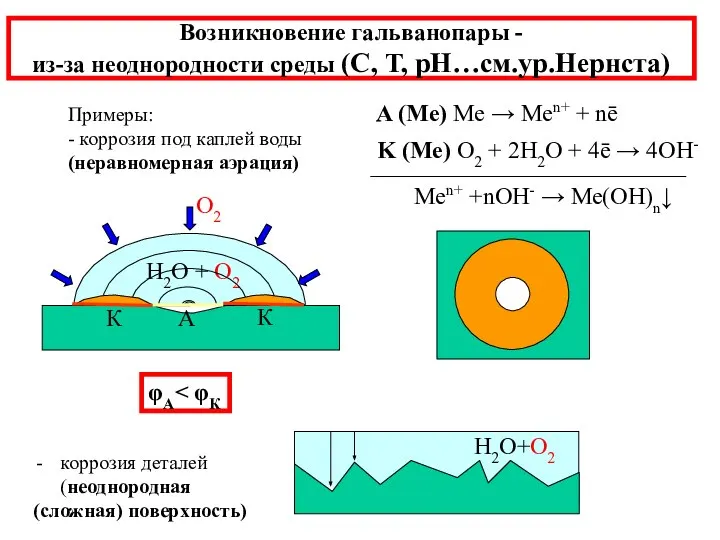
- 15. Возникновение гальванопары - из-за неоднородности среды (С, Т, рН…см.ур.Нернста) Примеры: - коррозия под каплей воды (неравномерная
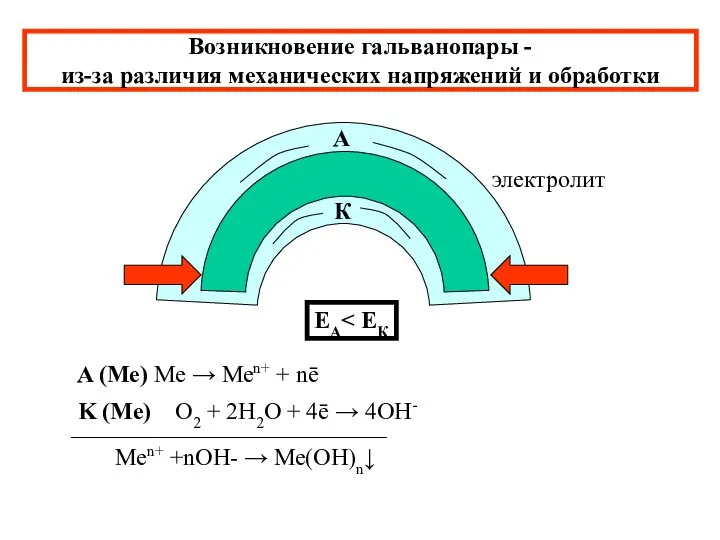
- 16. Возникновение гальванопары - из-за различия механических напряжений и обработки
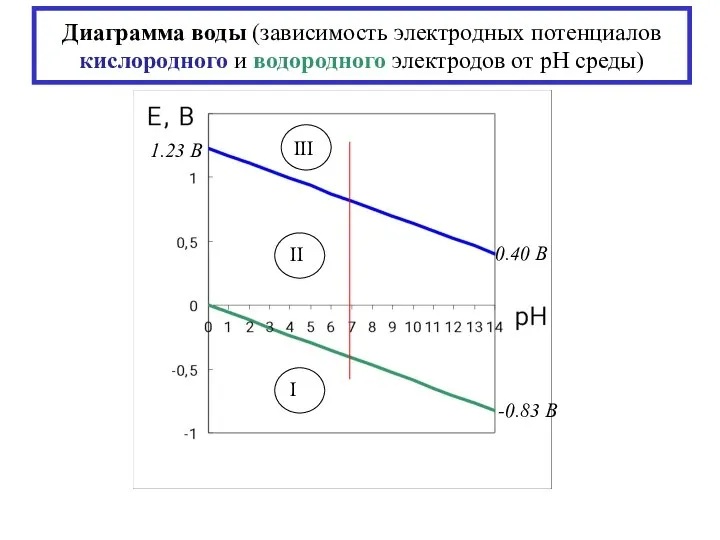
- 17. Диаграмма воды (зависимость электродных потенциалов кислородного и водородного электродов от рН среды)
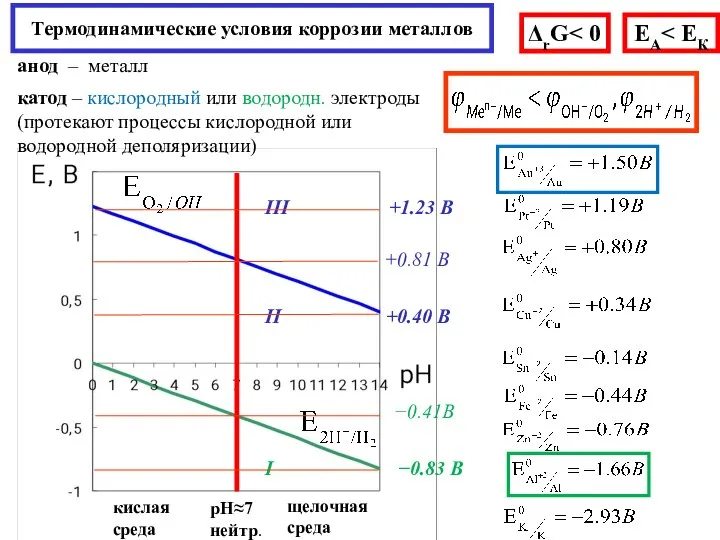
- 18. Термодинамические условия коррозии металлов ЕА анод – металл катод – кислородный или водородн. электроды (протекают процессы
- 20. Скачать презентацию







 Ферменты 3. Медицинская энзимология. (Лекция 3)
Ферменты 3. Медицинская энзимология. (Лекция 3) Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть бесплатно
Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть бесплатно Solutions. Acid–base equilibrium in biological systems
Solutions. Acid–base equilibrium in biological systems Свойства воды
Свойства воды Изотопы, их свойства и применение
Изотопы, их свойства и применение Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Вольфрам W
Вольфрам W Молочні продукти
Молочні продукти  Бром және оның қасиеттері
Бром және оның қасиеттері Олигосахариды
Олигосахариды  Теоретическая электрохимия, часть 1
Теоретическая электрохимия, часть 1 Метаболизм углеводов. Регуляция. Нарушения. (Лекция 6)
Метаболизм углеводов. Регуляция. Нарушения. (Лекция 6) Химическая термодинамика
Химическая термодинамика Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс The study of adsorption-desorption interaction of amino acids with calcium phosphates
The study of adsorption-desorption interaction of amino acids with calcium phosphates Противогололёдные реагенты. Вред или польза?
Противогололёдные реагенты. Вред или польза? Реакции при участии катализатора
Реакции при участии катализатора Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Особенности сплавов цветных металлов
Особенности сплавов цветных металлов Презентация по Химии "Значение химии" - скачать смотреть бесплатно
Презентация по Химии "Значение химии" - скачать смотреть бесплатно Химические опасные аварии с выбросом хлора и аммиака
Химические опасные аварии с выбросом хлора и аммиака Халық арасында тез таралатын жұқпалы ауыру түрлері,Барсакелмес қорығы
Халық арасында тез таралатын жұқпалы ауыру түрлері,Барсакелмес қорығы Изомерия и ее виды
Изомерия и ее виды Химия и биохимия игристых вин
Химия и биохимия игристых вин Азот. История открытия азота
Азот. История открытия азота Минералы и горные породы
Минералы и горные породы Презентация по Химии "Изучение показателей качества чипсов и газированной воды" - скачать смотреть
Презентация по Химии "Изучение показателей качества чипсов и газированной воды" - скачать смотреть  Месторождения железистых кварцитов
Месторождения железистых кварцитов