Содержание
- 3. Уравнение Никольского в общем виде
- 4. Методы определения коэффициентов селективности Виды ионоселективных электродов и их селективность «Электронный нос» и «электронный язык» Потенциометрия
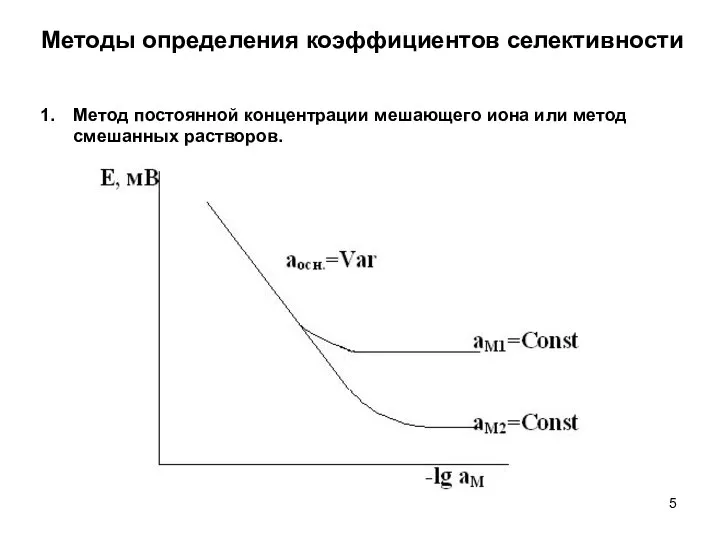
- 5. Методы определения коэффициентов селективности Метод постоянной концентрации мешающего иона или метод смешанных растворов.
- 6. 2. Метод раздельных растворов В этом методе сначала измеряют потенциал ИСЭ в растворе основного иона Е1.
- 7. Электроды с др. стеклянными и кристаллическими (и поликристаллическими) мембранами
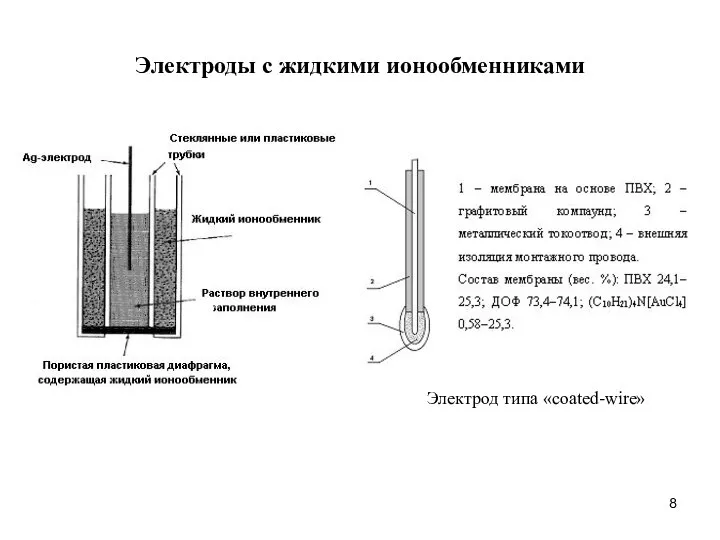
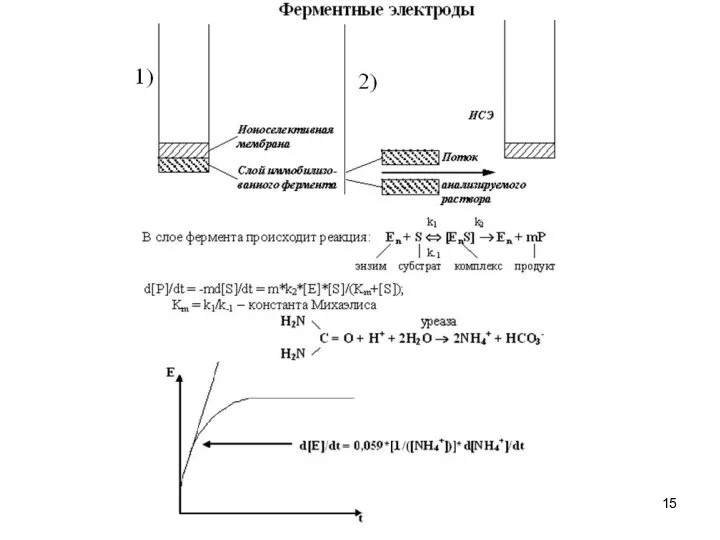
- 8. Электрод типа «coated-wire» Электроды с жидкими ионообменниками
- 9. Электроды с жидкими ионообменниками Основные типы мембран электродов На основе жидких ионообменников (типа Aliquat-336, крупный гидрофобный
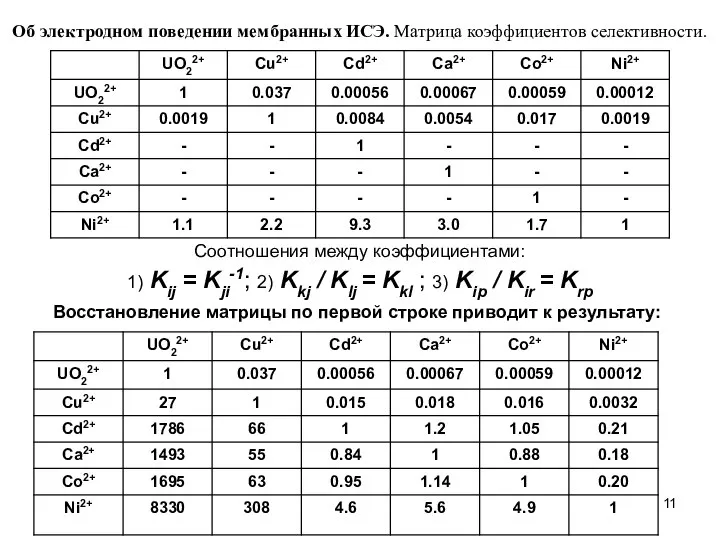
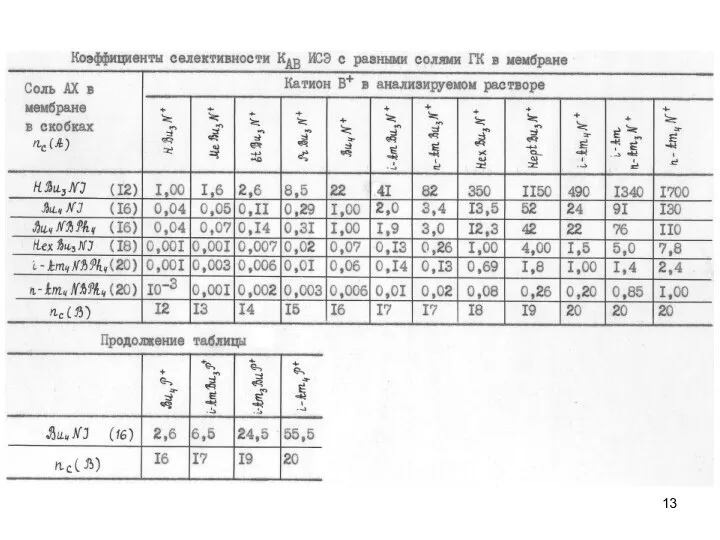
- 11. Об электродном поведении мембранных ИСЭ. Матрица коэффициентов селективности. Соотношения между коэффициентами: 1) Kij = Kji-1; 2)
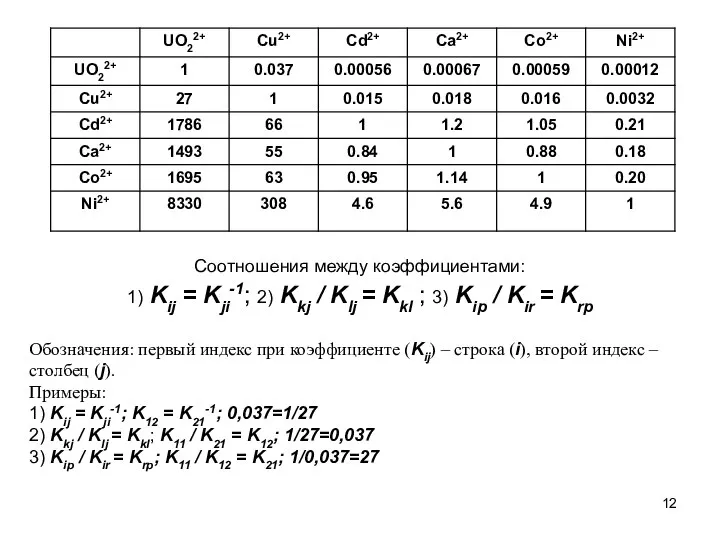
- 12. Соотношения между коэффициентами: 1) Kij = Kji-1; 2) Kkj / Klj = Kkl ; 3) Kip
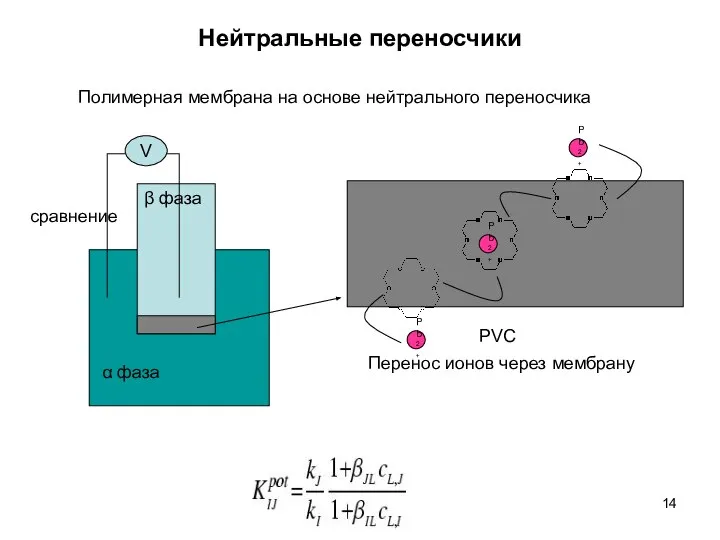
- 14. Нейтральные переносчики
- 16. Газовые потенциометрические сенсоры
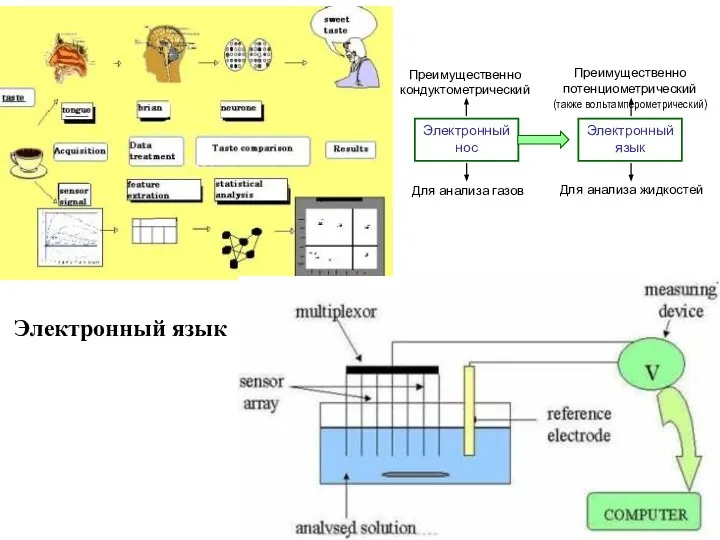
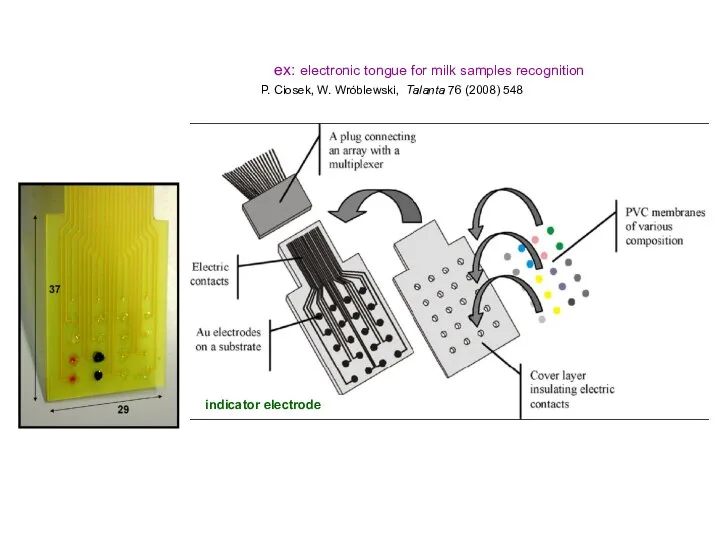
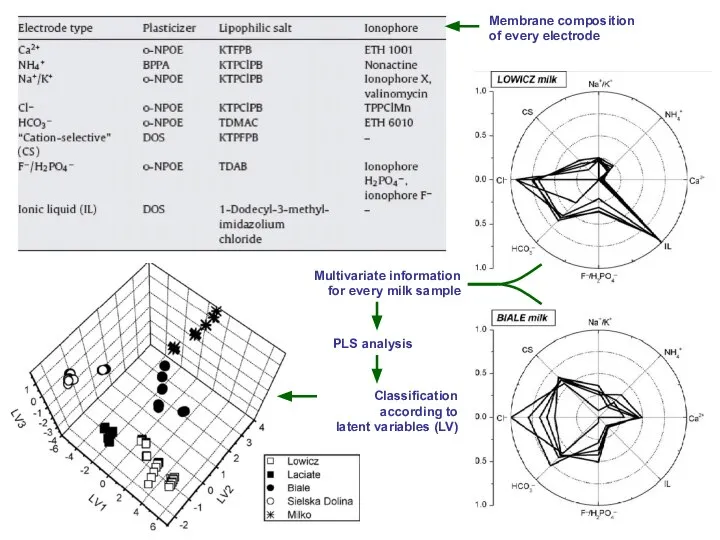
- 17. Электронный язык
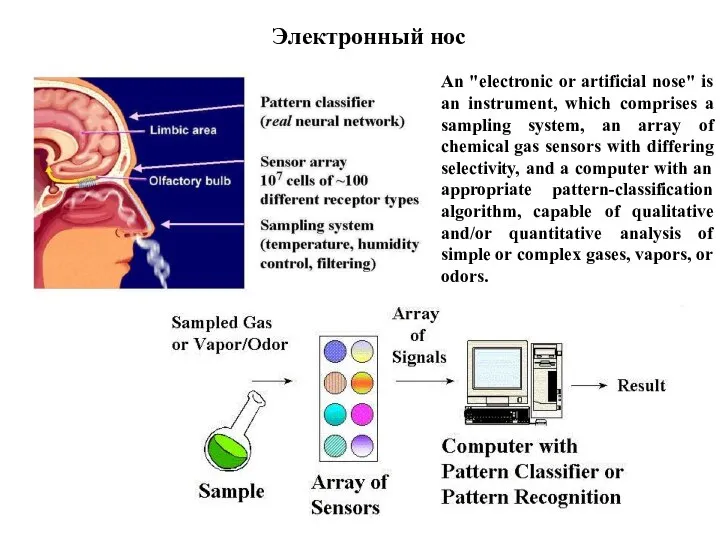
- 18. Электронный нос An "electronic or artificial nose" is an instrument, which comprises a sampling system, an
- 21. Задача: установление связи потенциала с составом контактирующих фаз. Для мембранных систем удалось установить связи с их
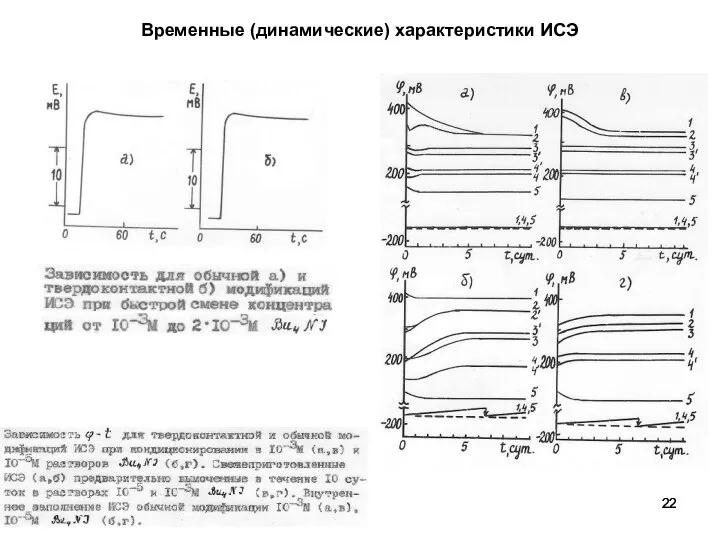
- 22. Временные (динамические) характеристики ИСЭ
- 23. Применение потенциометрии Потенциометрия в определении стандартных электродных потенциалов
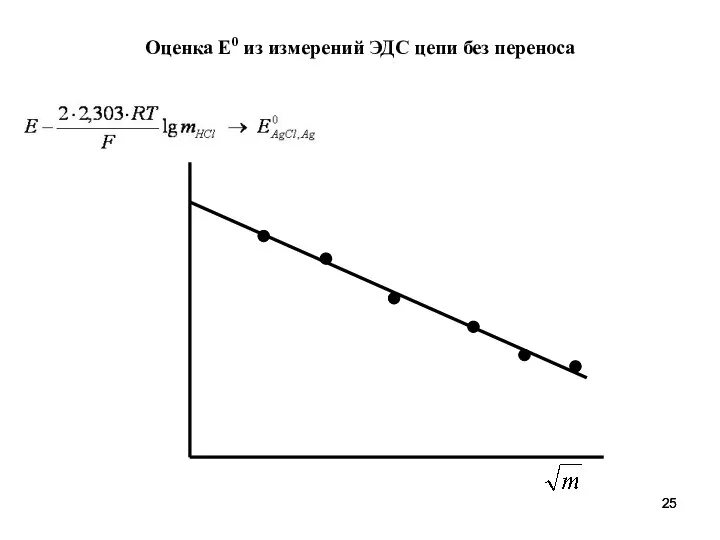
- 24. Перейдем от активностей ионов к среднеионным активностям электролита
- 25. Оценка Е0 из измерений ЭДС цепи без переноса
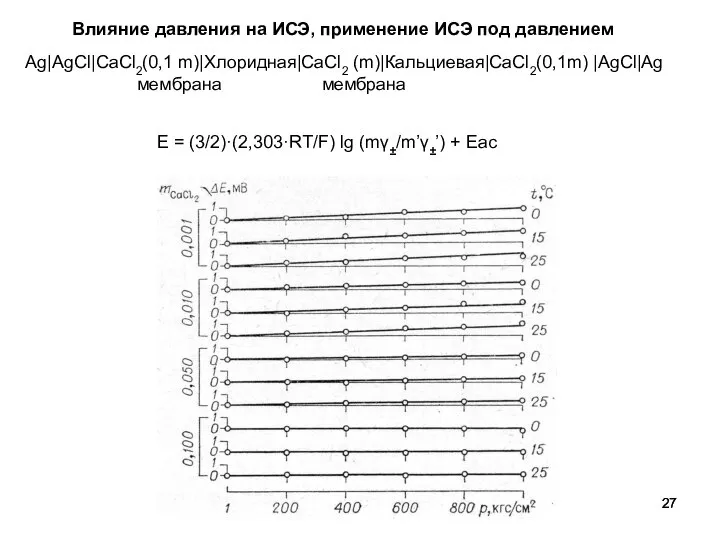
- 26. Применение кальциевых и хлоридных мембранных электродов Ag|AgCl|CaCl2(0,1 m)|Хлоридная|CaCl2 (m)|Кальциевая|CaCl2(0,1m) |AgCl|Ag мембрана мембрана E = RT/2F ln
- 27. Ag|AgCl|CaCl2(0,1 m)|Хлоридная|CaCl2 (m)|Кальциевая|CaCl2(0,1m) |AgCl|Ag мембрана мембрана Е = (3/2)·(2,303·RT/F) lg (mγ±/m’γ±’) + Eас Влияние давления на
- 28. Другие применения потенциометрии Определение термодинамических характеристик реакции, протекающей в ГЦ из температурной зависимости ЭДС (ΔE/ΔT): ΔG0,
- 29. Применение потенциометрии для определения ионной активности
- 30. В качестве примера определения активности рассмотрим определение рН Для определения рН используют платиновый, хингидронный, сурьмяный и
- 31. Говоря словами Харнеда: Практическая шкала рН: рНх = рНS + (Ех - ЕS)/(2,303RT/F) Надо задаться рН
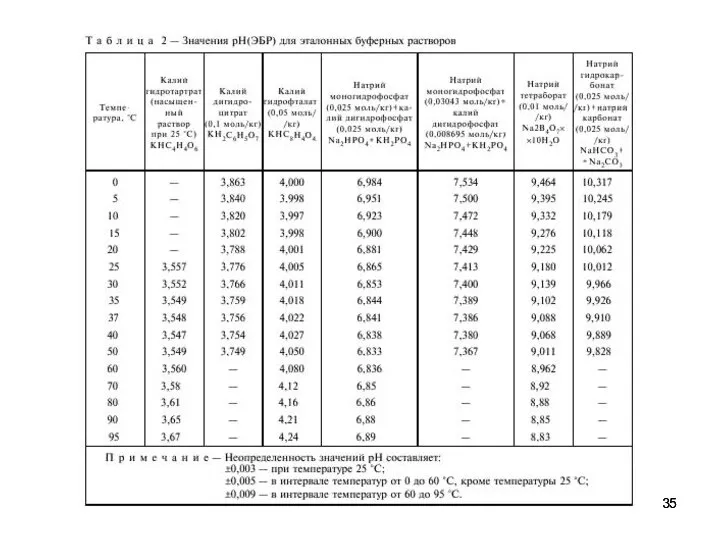
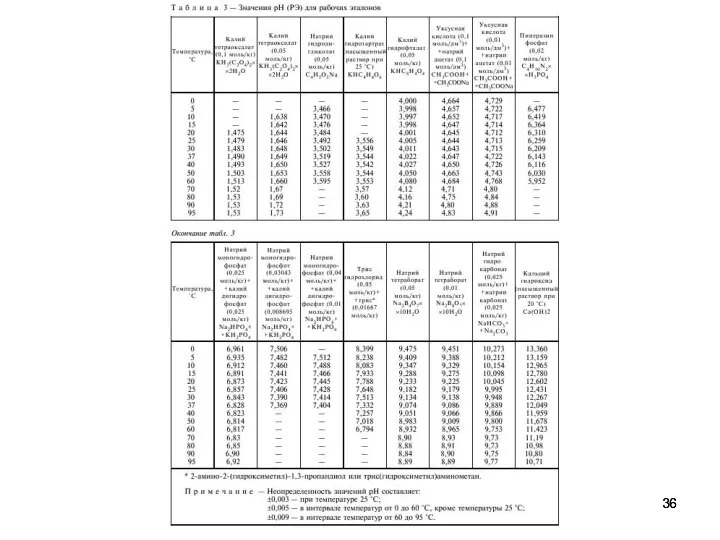
- 32. Процедура установления рН в практической шкале Следует выделить 4 этапа. В гальваническом элементе без переноса типа
- 33. 3. Расчет величины paH на основе введения условного понятия об индивидуальном ионном коэффициенте активности Для расчета
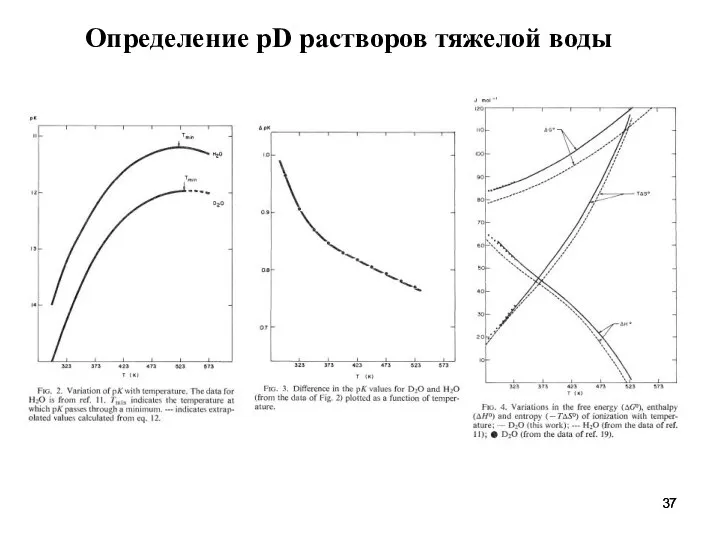
- 37. Определение pD растворов тяжелой воды
- 38. Pt │D2(g) │ KD2Cit (0.05m), KCl (m') in D2O │ AgCl │ Ag (Ia) Pt │
- 39. Сопоставление активностей, оцененных из условия Бейтса-Гуггенгейма
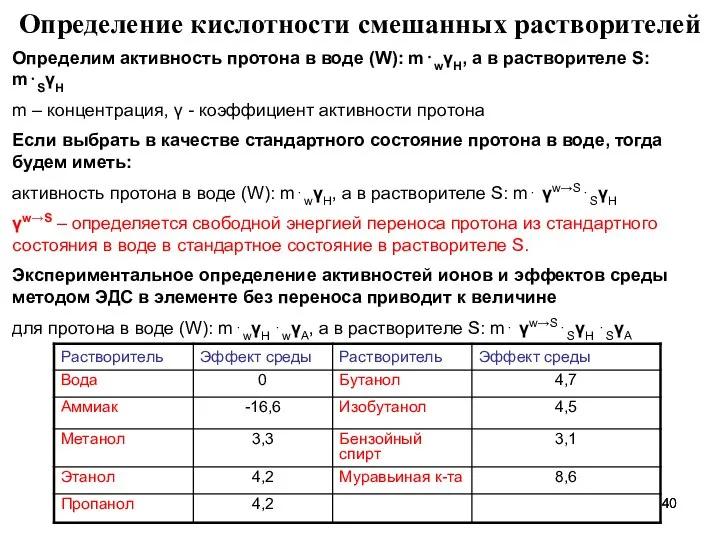
- 40. Определение кислотности смешанных растворителей Определим активность протона в воде (W): m⋅wγH, а в растворителе S: m⋅SγH
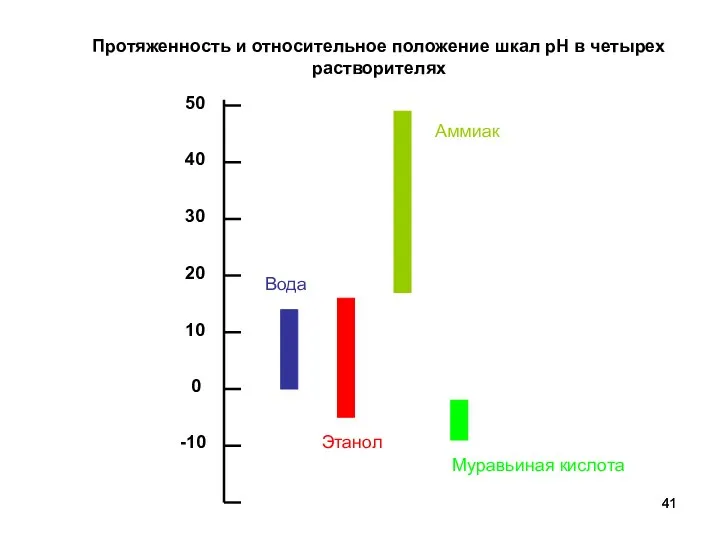
- 41. Протяженность и относительное положение шкал рН в четырех растворителях
- 42. Аналитическое применение потенциометрии - Прямое определение катионов и анионов, а также косвенное определение молекулярных веществ -
- 43. Достоинства Не оказывают воздействия на исследуемый раствор Датчики портативны, существуют микроэлектроды для измерения in vivo, in
- 44. Прямое определение концентрации и активности катионов и анионов Определяемые ионы: Ионные формы элементов периодической системы (из
- 45. При прямом определении концентрации в анализируемом растворе задается: Высокая ионная сила для поддержания постоянства коэффициентов активности
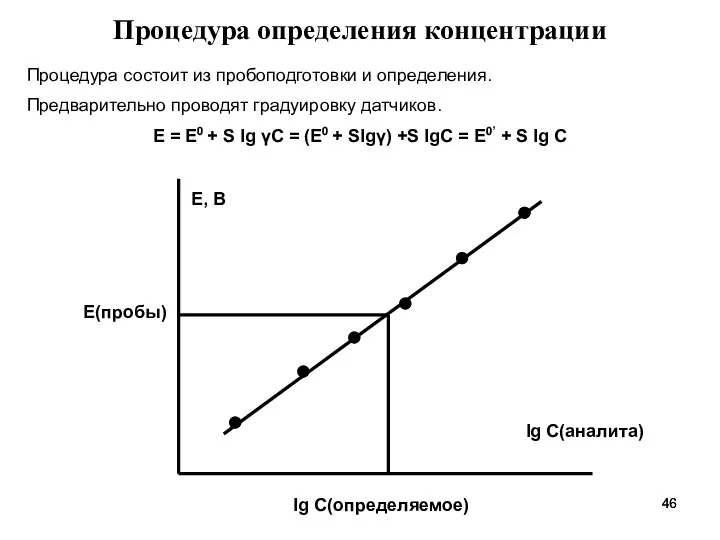
- 46. Процедура определения концентрации Процедура состоит из пробоподготовки и определения. Предварительно проводят градуировку датчиков. Е = Е0
- 47. Косвенное определение молекулярных компонентов 1. Определение газов (CO2, NH3). Принцип определения – по изменению рН промежуточного
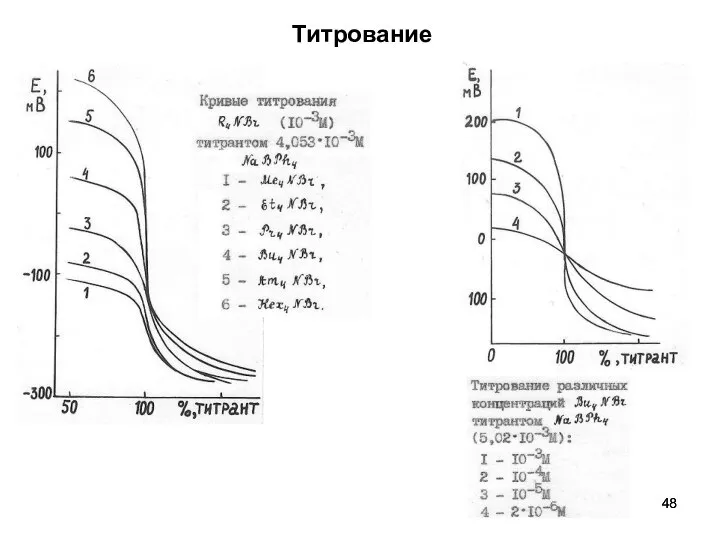
- 48. Титрование
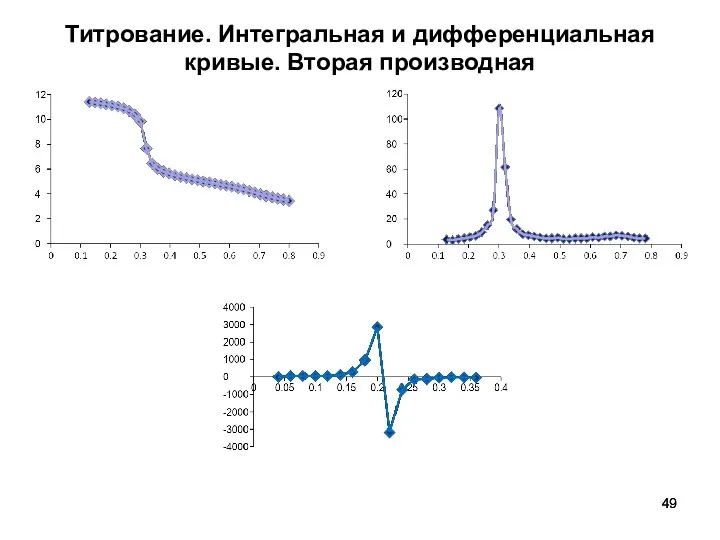
- 49. Титрование. Интегральная и дифференциальная кривые. Вторая производная
- 51. Скачать презентацию


























 Анализ лекарственных веществ гетероциклического строения, производных имидазола, имидазолина, пиразола, пиразолидина. (Тема 2)
Анализ лекарственных веществ гетероциклического строения, производных имидазола, имидазолина, пиразола, пиразолидина. (Тема 2) Выдающиеся открытия в области химии
Выдающиеся открытия в области химии Водорастворимые витамины
Водорастворимые витамины Галогены - простые вещества
Галогены - простые вещества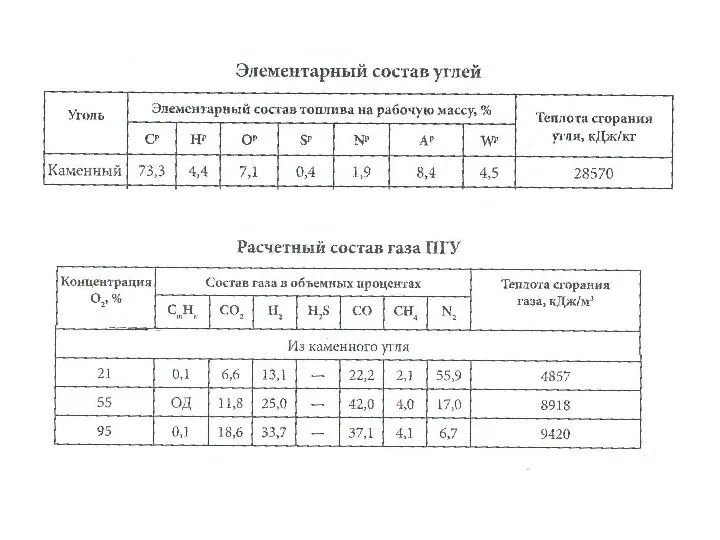 Элементарный состав углей
Элементарный состав углей Алкадиены. Состав и строение
Алкадиены. Состав и строение Презентация по Химии "Игра для знатоков химии "Пять звезд"" - скачать смотреть
Презентация по Химии "Игра для знатоков химии "Пять звезд"" - скачать смотреть 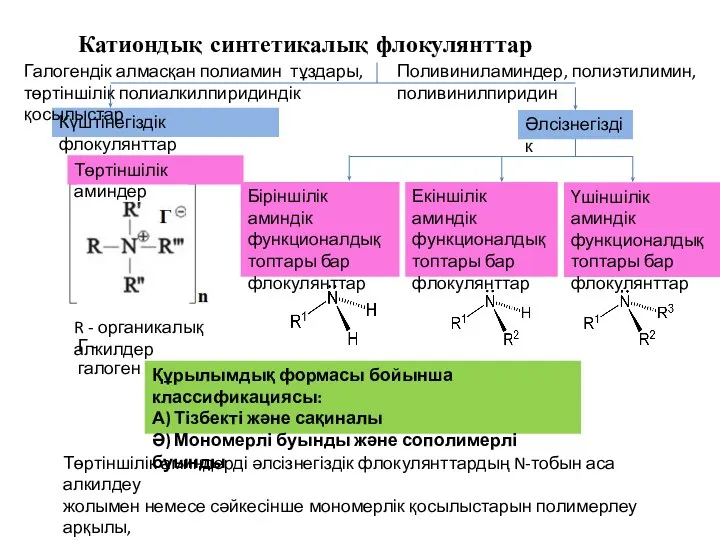 Катиондық синтетикалық флокулянттар
Катиондық синтетикалық флокулянттар Диагностика магматических горных пород
Диагностика магматических горных пород Гетероциклы. Гетероциклические соединения
Гетероциклы. Гетероциклические соединения Дәнді-дақылдар тыңайтқыштары
Дәнді-дақылдар тыңайтқыштары Металлы
Металлы  Углерод и 4 группа. 9 класс
Углерод и 4 группа. 9 класс Проект: «Мои любимые опыты с содой и уксусом»
Проект: «Мои любимые опыты с содой и уксусом» Арены. Бензол
Арены. Бензол Строение атома
Строение атома Предельные углеводороды
Предельные углеводороды Биологическая судьба химических веществ
Биологическая судьба химических веществ Газификация тяжёлых нефтяных остатков. Конверсия природного газа
Газификация тяжёлых нефтяных остатков. Конверсия природного газа Химические волокна
Химические волокна Многоатомные спирты
Многоатомные спирты Відкриття радіоактивності. У 1896 р. французький учений Антуан Анрі Беккерель (1852-1908) відкрив радіоактивність солей Урану – явище са
Відкриття радіоактивності. У 1896 р. французький учений Антуан Анрі Беккерель (1852-1908) відкрив радіоактивність солей Урану – явище са Гальваностегия и гальванопластика
Гальваностегия и гальванопластика Земля дарує буйство кольорів, Нектару пахощами щедро поїть, Щоб кожен з нас, як свічечка, горів Перед іконою природи дорогої… Основа вічної краси – Молекули цих дивовижних речовин Лиш два складають елементи, І Оксиген один із них…
Земля дарує буйство кольорів, Нектару пахощами щедро поїть, Щоб кожен з нас, як свічечка, горів Перед іконою природи дорогої… Основа вічної краси – Молекули цих дивовижних речовин Лиш два складають елементи, І Оксиген один із них…  Адиабатическое приближение в твердом теле
Адиабатическое приближение в твердом теле Свойства растворов ВМС
Свойства растворов ВМС Протолитические равновесия и процессы
Протолитические равновесия и процессы Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах